钙离子添加对沉水植物菹草(Potamogeton crispus L.)和金鱼藻(Ceratophyllum demersum L.)富集水体磷的影响*
2020-03-27王和云
陈 琦,王和云
(湖北工业大学河湖生态修复及藻类利用湖北省重点实验室,土木建筑与环境学院,武汉 430068)
沉水植物作为水生生态系统的初级生产者,对整个水体生态系统的结构与功能及系统稳定性有决定性的影响[1],能稳定生态系统[2],维持水生态系统健康[3]. 大量研究和实践表明,重建沉水植物对恢复湖泊生态系统,改善水质具有十分重要的意义[4-7]. 因此,富营养化水体中沉水植物的恢复与重建已成为生态修复领域的重点研究内容.
沉水植物生长过程中的根、茎、叶均能够吸收水体中的营养物质[8],可以有效降低水体环境中的氮磷浓度、缓解水体富营养化. 多数研究以植物干重基础上的全磷含量来表征植物对水体磷的富集效率,一般干重磷含量较高的植物被认定为除磷效果好[9-10]. 但一年生的沉水植物,植株死亡期会释放营养盐[11];在富营养化水体中,沉水植物过度的种内竞争会导致植物的腐烂,成为氮、磷的内污染源,引起水质恶化[12-13]. 因此,适当收割植物能防止死亡腐烂造成的二次污染,强化水质净化作用[14]. Scheffer等[15]认为,在0.25 mg/L以内的磷负荷下,浅水湖泊可以通过沉水植被固定营养物而维持清洁状态,而且仅仅在0.25 mg/L以下的磷负荷下才能实现,高于此浓度浮游植物将会占优势,使湖泊由清水态变为浊水态. 沉水植物去除水体磷主要通过表面吸附、植物吸收和与过饱和CaCO3共沉淀[16-18],从而在体内形成水溶性磷、有机磷和钙磷[19]. 不同的沉水植物物种,在不同的环境条件下,灰分磷中这三种磷的组成会发生变化,其对磷的去除效率不同[20].
钙是植物生长的必需营养元素之一,在植物生长发育和应对环境胁迫中处于中心调控地位[21]. 倪玲珊发现沉积物未添加钙种植菹草时,水体总磷(TP)(0.56 mg/L)去除率为59%,在沉积物中新增定量交换性钙后种植菹草(PotamogetoncrispusL.),可使TP去除率提高至82%[22],这表明,菹草在生长过程中,对水体磷迁移过程中发生了CaCO3-P共沉淀[23]. 在湖泊生态系统中,沉水生物的光合作用形成的微环境,或局部水体Ca2+高度过饱和是控制湖泊CaCO3沉淀的直接原因和形成细胞外CaCO3自生沉淀的主要原因[24]. 低于50 mg/L的低Ca2+浓度发生的钙化主要为生物钙化,高于200 mg/L的高Ca2+浓度则主要为以生物引发的物理化学钙化[25]. 在一些钙质水体中,CaCO3-P共沉淀被认为是湖泊水体的自净机制之一[26]. 基于此,对于富营养化湖泊,是否可以通过提高水体中钙离子浓度,促进沉水植物对水体磷的去除能力?国外已经有将CaCO3投加到湖泊中增加水体中磷的固定的应用[27],在水处理中采取用石灰等含钙物质回收污泥中的磷[28]和运用钙盐进行湖泊内源磷控制[29]均是对这个钙磷共沉淀过程的工程应用.
在任文君[30]的研究中,菹草分别在中营养(TP浓度0.177 mg/L)、高营养(TP浓度0.426 mg/L)、富营养(TP浓度0.858 mg/L)、超富营养(TP浓度3.211 mg/L)下,对水体中TP去除效果的顺序依次为: 高营养浓度>超富营养浓度>中营养浓度>富营养浓度. 在马剑敏等[31]的研究中,菹草即使在高磷浓度下(12.8 mg/L),现存量仍明显增加;伊乐藻(Elodeanuttallii)和苦草(Vallisenerianatans)在磷≤0.8 mg/L时现存量稳定或增长,在磷>0.8 mg/L时开始负增长,这表明菹草对高磷浓度的耐受性大于伊乐藻和苦草. 金鱼藻(CeratophyllumdemersumL.)是淡水湖泊常见的主要优势种之一,是一种较能耐受营养盐胁迫的沉水植物品种[32-33]. 但也有研究表明,金鱼藻较适应于中-富营养化水体环境(TN: 1 mg/L,TP: 0.1 mg/L),水体营养盐继续增加对金鱼藻有胁迫作用[34],长时间的高营养胁迫可能会导致金鱼藻的叶片全部脱落,进而造成金鱼藻死亡[35]. 沉水植物的恢复是解决湖泊富营养化的重要举措,但是植物的选择会直接影响生态修复的效果. 本研究选择沉水植物菹草和金鱼藻作为实验对象,比较两种沉水植物在不同营养水平的磷浓度下,钙离子添加对水体磷的去除和植物富集磷的差异,并通过植物灰分磷的组分分析,聚焦植物钙磷的变化,为生态修复中沉水植物的选择提供理论依据.
1 材料与方法
1.1 实验材料与预培养
2017年春季,将取自梁子湖的菹草(PotamogetoncrispusL.)和取自内沙湖的金鱼藻(CeratophyllumdemersumL.)栽培在湖北工业大学资源与环境工程学院后面无遮荫、自然光照的露天水池里,自来水培养. 在2017年11月后截取若干长势良好,长约5~8 cm的植物顶端洗净,使用去离子水对植物进行清洗,然后使用软毛刷刷洗植株叶片表面,去除植株表明的杂质和附着藻,分开放置于1 L的玻璃烧杯. 同时取水泥池的水样用玻璃纤维膜(上海兴亚孔径0.45 μm)过滤除去藻类与大颗粒物质后加入装有沉水植物的烧杯中进行预培养. 烧杯置于光照培养箱中,光暗比为12 h∶12 h,温度控制为光周期20℃,暗周期15℃,光照强度为110 μmol/(m2·s),预培养7天.

表1 实验培养液磷、钙添加浓度(mg/L)分组设计
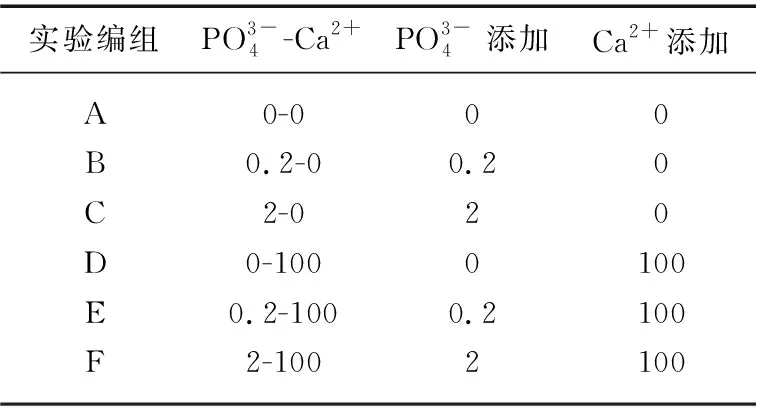
实验编组PO3-4-Ca2+PO3-4添加Ca2+添加A0-000B0.2-00.20C2-020D0-1000100E0.2-1000.2100F2-1002100
1.2 实验设计
预培养一周后将2种沉水植物的植株顶端转入1 L的烧杯中,每个烧杯中添加1 L不同磷浓度和钙浓度的培养液,4~5株植株顶端,鲜重约5 g. 磷浓度设置了3个水平,分别是无添加磷(0 mg/L)、中浓度磷(0.2 mg/L)和高浓度磷(2 mg/L),外加钙浓度设置了2个水平,分别是无添加钙(0 mg/L)和添加钙(100 mg/L). 因预培养水中钙离子浓度为25 mg/L,因此添加钙之后水体钙水平分别为25和125 mg/L. 该研究一共有6种处理(表1). 其中无机磷处理通过添加K2HPO4获得,Ca2+添加处理通过无水CaCl2实现. 平行处理为4个.
实验中植物的培养在光照培养箱中进行,培养的条件,包括光照和温度与预培养时一致. 实验周期8天. 实验每隔2天,在每个光周期开始时取培养液100 mL(不补充培养液). 用来测定培养液的总磷(TP)和溶解性反应磷(SRP)浓度.
1.3 实验测量
TP浓度的测定采用钼酸铵分光光度法,参见《水和废水监测分析方法》(GB 11893-1989)[36];SRP浓度的测定: 将水样预先用0.45 μm孔径的醋酸纤维滤膜,而后采用钼-锑-抗比色法进行测定.
实验结束后,将植物取出用自来水清洗,并用吸水纸擦干表面水分,分析天平称取鲜重(误差±0.001 g),然后60℃烘48 h至恒重,分析天平称量干重(误差±0.001 g). 植株干重全磷按照钼锑抗比色法(GB 7887-1987)测量[37];马弗炉焚烧(550℃,1 h)获得灰分以检测灰分磷的组成,植株灰分各成分磷的测量方法修改自Dou等[38]的方法,具体步骤为: 在植物灰化后,包括3个步骤: a)用50 mL蒸馏水萃取30 min以获得水溶性磷(H2O-P),b)用50 mL 1.0 mol/L的NaOH萃取20 h以获得有机磷(NaOH-P),c)用50 mL 1.0 mol/L的HCl萃取30 min以获得钙磷(HCl-P). 分馏后获得的组分采取过硫酸钾氧化法(GB 11893-1989),将H2O-P、NaOH-P、Ca-P的含量相加得植物的灰分总磷[38].
1.4 计算与数据分析
磷和钙对植物全磷、灰分磷以及灰分中磷组成(H2O-P、NaOH-P和HCl-P)影响通过二元方差分析获得,各处理间的差异通过t-test获得. 数据处理分析使用SPSS 17.0分析. 图表制作采用Origin 8.0软件.
2 结果与分析
2.1 不同处理条件下TP和SRP浓度的变化
在菹草培养体系中,随着时间的变化,溶液中TP浓度逐渐降低,第2天下降速度最快;TP浓度在2-0组和2-100组的变化无差异(P>0.05). 第8天收获植物时,2-0组的TP浓度由初始平均值1.97 mg/L降至0.43 mg/L,降幅为78.17%;2-100组的TP浓度由初始平均值2.04 mg/L降至0.44 mg/L,降幅为78.43%. 在金鱼藻培养体系中,TP浓度在第2天开始下降,随着时间变化,高磷浓度的两组(2-0组和2-100组)处理中TP浓度先升高后降低(P<0.01),但总体TP浓度仍低于初始值(P<0.01). 第8天收获植物时,2-0组的TP浓度由初始值2.06 mg/L降至1.01 mg/L,降幅为50.97%;2-100组的TP浓度由初始值2.05 mg/L降至为0.85 mg/L,降幅为58.53%.
0.2-0组和0.2-100组的菹草溶液中TP浓度没有显著变化,平均值维持在0.04~0.05 mg/L之间. 0.2-0组的金鱼藻溶液中TP浓度下降幅度低于0.2-100组(0.2-0组0.11 mg/L;0.2-100组0.08 mg/L).

图1 添加不同浓度水平处理下菹草体系溶液(a)和金鱼藻体系溶液(b)的TP浓度变化Fig.1 TP concentration changes in solution of Potamogeton crispus L.(a) and in solution of Ceratophyllum demersum L. (b) in response to different concentrations of and Ca2+ levels
在菹草体系中,随着时间的变化,溶液中SRP浓度逐渐降低. 第8天收获菹草时,2-0组的SRP浓度平均值为0.38 mg/L,2-100组为0.33 mg/L. 菹草体系中2-100处理组的SRP降低幅度低于2-0处理组(P<0.05). 对于金鱼藻培养体系,第2天SRP显著降低,高磷浓度的两组(2-0组和2-100组)处理中与TP浓度变化一致,SRP浓度呈先升高后降低(P<0.01),但是总体浓度还是低于初始状态,第8天时,2-0组SRP浓度为0.86 mg/L;2-100组SRP浓度为0.72 mg/L.
0.2-0组和0.2-100组的菹草溶液中,SRP浓度变化趋势相同. 0.2-100组SRP浓度在2d时降低的更多,但随着时间推移,在4d时,0.2-0组的SRP浓度降低到和2-100组相近,第8天收获植物时,0.2-0组SRP浓度为0.025 mg/L;0.2-100组浓度为0.023 mg/L. 金鱼藻体系中,中等磷浓度两组SRP呈下降趋势,0.2-0组浓度为0.012 mg/L,0.2-100组浓度为0.008 mg/L.
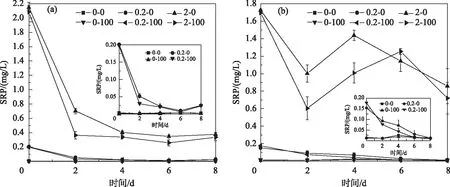
图2 添加不同浓度水平处理下菹草体系溶液(a)和金鱼藻体系溶液(b)SRP浓度变化Fig.2 SRP concentration changes in solution of Potamogeton crispus L.(a) and in solution of Ceratophyllum demersum L. (b)in response to different concentrations of and Ca2+ levels
2.2 2种沉水植物灰分总磷和干重总磷含量的变化
对菹草而言,植物干重全磷和灰分总磷在高磷水平处理条件下最高;灰分总磷在高磷高钙水平(2-100组)处理条件下最高,平均含量为76.55 mg/g;在低磷低钙水平(0-0组)含量最低,平均值为35.32 mg/g. 干重全磷在高磷低钙水平(2-0组)含量最高,平均值为5.82 mg/g;在低磷低钙水平(0-0组)含量最低,平均值为2.63 mg/g.
金鱼藻的灰分总磷在中等磷低钙水平(0.2-0组)处理条件下含量最高,平均含量为168.79 mg/g,在低磷高钙水平(0-100组)含量最低,平均值为86.01 mg/g. 干重全磷含量在高磷高钙水平(2-100组)条件下最高,平均含量为7.37 mg/g;在低磷高钙(0-100组)含量最低,平均值在4.33 mg/g. 金鱼藻在0-0组灰分总磷含量为136.02 mg/g,干重全磷含量为4.87 mg/g.
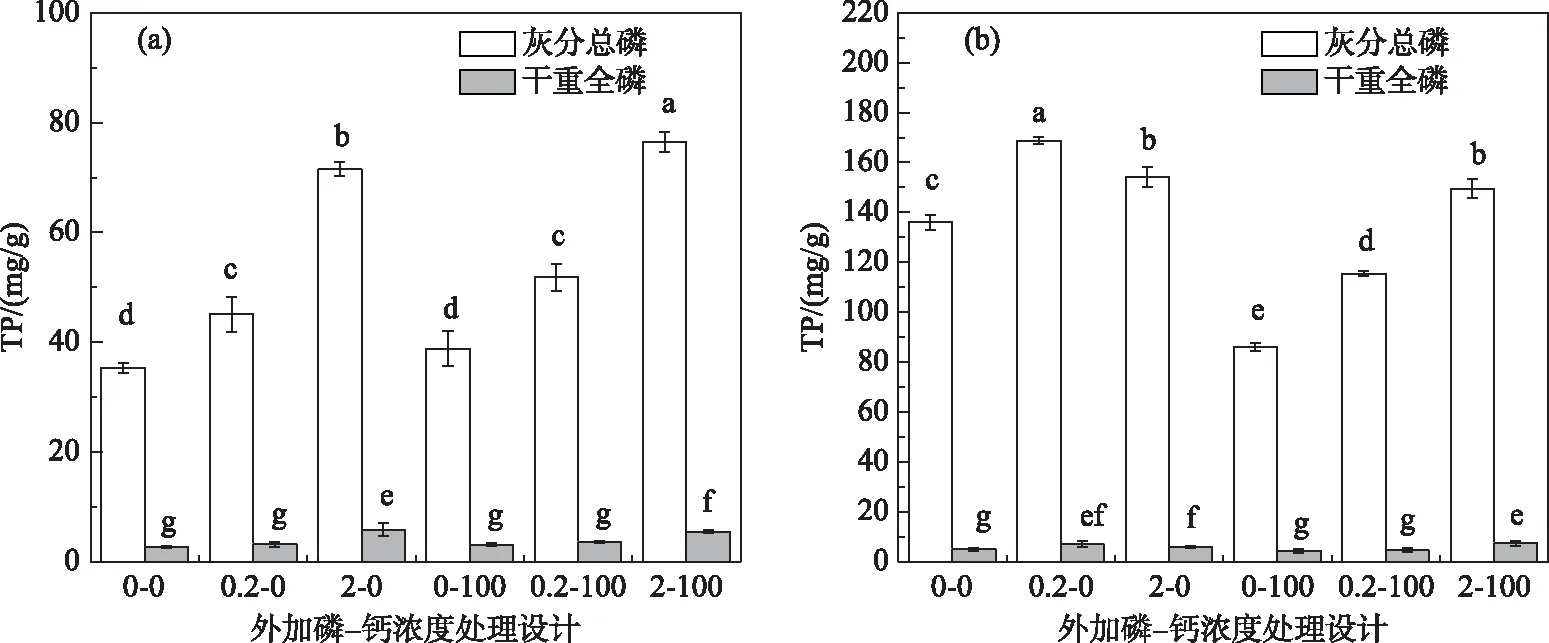
图3 添加不同浓度水平处理下的菹草(a)和金鱼藻(b)干重全磷和灰分总磷含量变化(不同字母代表处理间差异显著)Fig.3 Total phosphate content changes based on plant dry weight and based on plant ash of Potamogeton crispus L. (a) and Ceratophyllum demersum L. (b) in response to different concentrations of and Ca2+ levels(Different letters indicated significant differences between treatments)
二元方差显示磷浓度显著影响了菹草的干重全磷和灰分总磷含量,磷浓度对灰分总磷变异的贡献比(95.64%)高于干重总磷(86.42%),钙浓度对灰分总磷有影响而对干重全磷没有影响. 金鱼藻的干重全磷含量受到磷浓度(37.19%)的影响,而灰分总磷受到磷(40.02%)和钙(42.90%)浓度的共同影响.
磷浓度显著影响了菹草和金鱼藻的干重总磷和灰分总磷含量,但菹草的干重磷含量的贡献百分比(86.42%)高于金鱼藻(37.19%),灰分磷含量的贡献百分比(95.64%)也高于金鱼藻(40.02%).
2.3 两种沉水植物的灰分磷组成和变化
植物灰分总磷由H2O-P、NaOH-P和HCl-P组成. 菹草和金鱼藻灰分中的H2O-P、NaOH-P和HCl-P均受到磷和钙的影响. 二元方差分析表明磷浓度显著影响了两种植物灰分总磷中H2O-P含量(菹草71.07%,金鱼藻26.56%),NaOH-P含量(菹草84.74%,金鱼藻64.63%)和HCl-P含量(菹草85.54%、金鱼藻39.54%). 钙浓度显著影响了两种植物灰分总磷中H2O-P含量(菹草18.60%、金鱼藻66.62%),NaOH-P含量(菹草1.41%、金鱼藻14.45%)和HCl-P含量(菹草2.60%、金鱼藻35.63%)(表2).
表2 外加磷和钙对植物磷差异的贡献比
Tab.2 Percentage of contribution of phosphorus and calcium to plant phosphorus differences
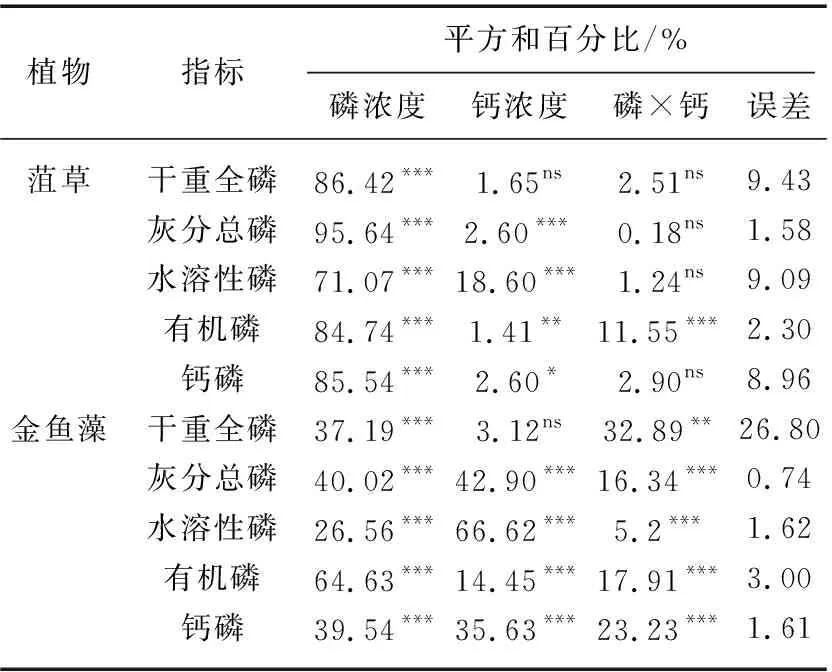
植物指标平方和百分比/%磷浓度钙浓度磷×钙误差菹草干重全磷86.42***1.65ns2.51ns9.43灰分总磷95.64***2.60***0.18ns1.58水溶性磷71.07***18.60***1.24ns9.09有机磷84.74***1.41**11.55***2.30钙磷85.54***2.60*2.90ns8.96金鱼藻干重全磷37.19***3.12ns32.89**26.80灰分总磷40.02***42.90***16.34***0.74水溶性磷26.56***66.62***5.2***1.62有机磷64.63***14.45***17.91***3.00钙磷39.54***35.63***23.23***1.61
*代表P<0.05水平上影响显著; **代表P<0.01; ***代表P<0.001; ns代表P>0.05.
菹草的H2O-P、HCl-P均在高磷高钙水平(2-100组)含量最高(图4b,c),NaOH-P在高磷低钙(2-0组)含量最高(图4a). 在未添加和添加0.2 mg/L磷浓度下的溶液中,钙离子添加对菹草的灰分H2O-P、HCl-P和NaOH-P含量均没有影响,但在添加2 mg/L磷浓度下,钙离子添加使NaOH-P含量降低,而H2O-P、HCl-P含量升高. 未添加钙离子的3组处理中,菹草NaOH-P含量随磷浓度升高而增加. 添加钙离子的3组处理中,HCl-P含量随磷浓度升高而增加.
金鱼藻的H2O-P和HCl-P均在中等磷低钙水平(0.2-0组)含量最高(图4b,c),而NaOH-P在高磷高钙(2-100组)最高(图4a). 未添加钙离子的3组处理中,与0-0组相比,0.2-0和2-0组的NaOH-P显著升高,H2O-P和HCl-P在0.2 mg/L磷浓度下含量最高. 添加钙离子后,金鱼藻灰分总磷中的H2O-P、HCl-P和NaOH-P含量均随着添加磷浓度的升高而增加. 在未添加和添加0.2 mg/L的磷浓度下,添加钙离子降低了H2O-P、HCl-P和NaOH-P含量,但2 mg/L磷浓度下,添加钙离子只降低了H2O-P和HCl-P含量,NaOH-P含量升高.
3 讨论
3.1 溶液TP和SRP变化
不同沉水植物的生长速率存在差异,因而对水体营养盐的需求和吸收能力不同. 例如在人工模拟太湖地区冬季的自然条件下,伊乐藻对水体磷的去除效果比菹草更好[39]. 但田琦等[40]的研究发现菹草对总磷(TP: 3.35 mg/L)的去除能力较伊乐藻和金鱼藻强,但金鱼藻对SRP的去除效率最高(42.02 μg/(d·g鲜重)),略强于菹草(40 μg/(d·g鲜重)). 从溶液中TP和SRP浓度变化来看,菹草、金鱼藻对水体中的磷均具有明显的去除效果,但是去除能力不同. 在高浓度磷(2-0组和2-100组)中,菹草体系的TP浓度降低到0.43~0.44 mg/L,SRP浓度降低到0.33~0.38 mg/L(图1a,图2a);而金鱼藻体系的TP浓度在1.01~0.85 mg/L之间,SRP浓度在0.86~0.72 mg/L之间(图1b,图2b). 这是因为虽然金鱼藻在受到较高营养胁迫时(N: 10~30 mg/L,P: 1~3 mg/L),仍具有一定的去除水体中N、P的能力,但这种净化能力随营养水平的升高(N: 30 mg/L,P: 3 mg/L)而降低[41]. 在2.0 mg/L磷浓度下,菹草对水体TP和SRP去除变化效果比金鱼藻明显,这是因为菹草对高磷浓度(12.80 mg/L)的耐受性[31]大于金鱼藻[35]. 在第4天,金鱼藻体系(2-0组和2-100组)的TP和SRP浓度较前两天的值有所升高,这与陈少裕[42]的研究一致,即沉水植物金鱼藻在重富营养化(陈少裕的研究TP: 1 mg/L,本研究TP: 2 mg/L)时可能存在磷吸收-释放-再吸收的利用机制.
菹草体系添加钙离子组在第2天时SRP浓度低于未添加钙离子组,金鱼藻体系添加钙离子组在第6天前的浓度均低于未添加钙离子(图2),表明添加钙离子使溶液中SRP浓度快速下降. 并且添加钙离子组的溶液中,SRP变化比TP更为明显. 这与Otsuki等[43]的研究相符合,通常SRP能有效地与CaCO3发生共沉淀.
3.2 两种植物的干重全磷和灰分总磷
沉水植物在湖泊中占优势时,通过其过量吸收营养物质的特性[44],富集水体中的营养物质,因此,植物对磷的去除能力往往被表征为植物富集的磷[40,45-46]. 本研究中,磷浓度显著影响了菹草和金鱼藻的干重全磷,且干重全磷均在高磷水平处理下最高(菹草在高磷低钙水平(2-0组),金鱼藻在高磷高钙水平(2-100组)),这说明2种植物在高磷水平(2 mg/L)均可有效去除水体磷. 与未添加磷浓度组(0-0组和0-100组)相比,植物体内的磷含量随着水体中磷浓度的升高而增加(图3),这和Kufel和Ozimek[47]的实验结论一致,水体中SRP浓度升高会增大植物生物量中的磷含量,这表明植物干重磷一定程度上表征了植物对水体磷的去除能力. 然而,沉水植物的生长具有一定周期性,死亡的植物经自然腐烂分解后,干重中直接吸附的磷由于吸附可逆性会快速溶解到水体中,通过吸收利用的磷经微生物分解后会释放到水体中[48-49],参与水体的营养再循环;只有不能被分解的磷部分保存在湖泊底泥中,参与地球化学循环[11,50-51]. 其中,通过生物沉积进入湖泊底泥中的这一部分磷才是植物从水体真正去除的磷[20]. 本研究参照陈琦等[20]的研究,将植物的灰分总磷分为水溶性磷、有机磷和钙磷. 其中,水溶性磷即为吸附磷,有机磷能为微生物分解磷,钙磷会进入底泥,属于真正去除的磷.
若以灰分总磷作为植物富集水体磷的指标,本研究中,金鱼藻灰分总磷含量在0.2 mg/L磷浓度下最高,而菹草灰分总磷含量在2 mg/L磷浓度下最高,这表明相对于金鱼藻,菹草对高磷水平有更强的耐受性,与马剑敏等的研究一致[31,34-35,41].
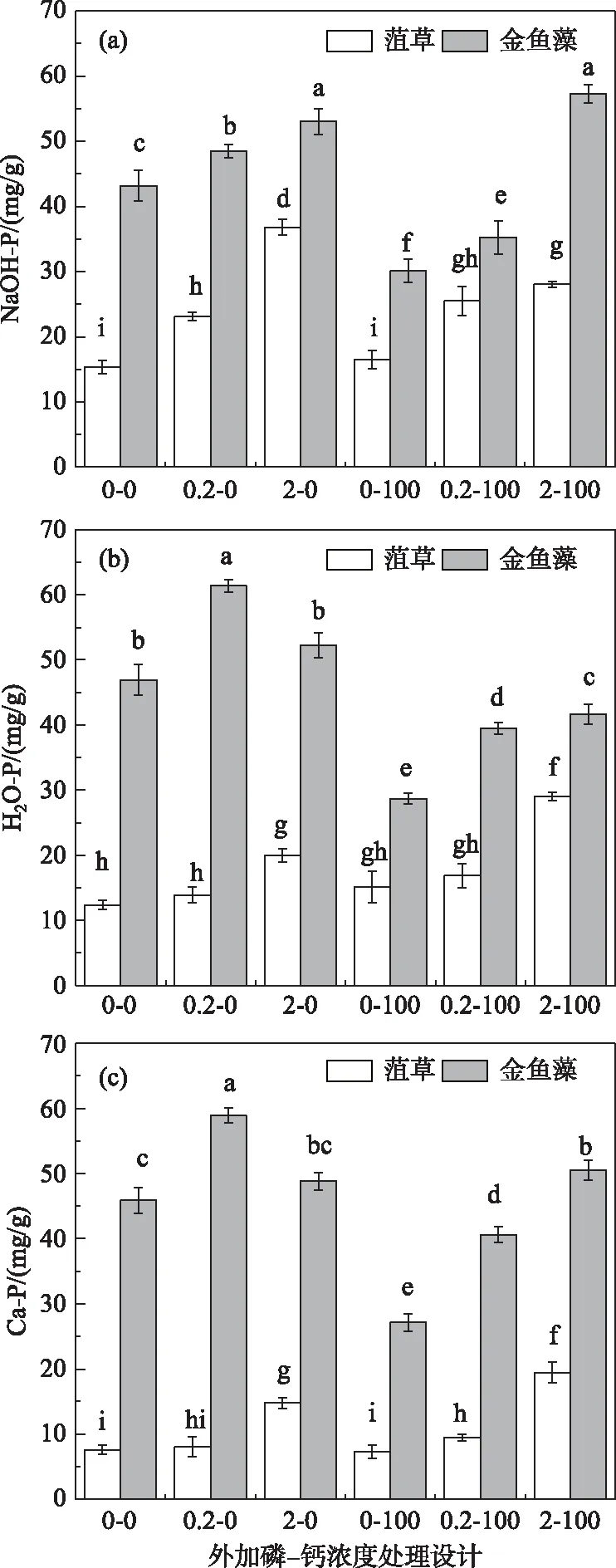
图4 添加不同浓度磷-钙水平处理下的植物灰分磷中NaOH-P、H2O-P和HCl-P含量Fig.4 Contents of NaOH-P,H2O-P and HCl-P based on plant ash in response to different concentrations of and Ca2+ levels
菹草干重全磷在高磷低钙(2-0组)含量最高,灰分总磷在高磷高钙(2-100组)含量最高(图3a),此时钙磷含量最高(图4c);金鱼藻干重全磷含量在高磷高钙水平(2-100组)下最高,灰分总磷含量在中等磷低钙水平(0.2-0组)处理条件下最高(图3b),此时钙磷含量最高(图4c). 干重磷与钙磷含量的趋势不一致,而灰分磷与钙磷含量趋势一致. 由于钙磷是沉水植物真正意义上去除的磷,灰分磷比干重磷更能表征植物对水体磷的去除能力.
3.3 钙的添加对植物灰分磷组成的影响及其生态意义
水体中,磷作为微量组分,碳酸根为常量组分,磷和碳酸根共同竞争钙离子,发生CaCO3-P共沉淀需要适当的温度、pH和相应的钙磷比. 在荷兰Veluwe湖泊中,上覆水磷浓度为0.1~0.2 mg/L,溶解性磷酸盐和方解石发生共沉淀时的磷钙比为2.7~7.2 mg P/g Ca[52]. 郭文文[53]发现,溶液中CaCO3-P共沉淀发生的最适条件: 50 g Ca/1 mg P,温度25℃,pH值在9.58~9.70之间,钙的沉淀率最大. 本研究中,光培养周期温度为20℃,暗培养周期为15℃,初始pH值8.0左右,0.2-100组(P: 0.2 mg/L,Ca2+: 100 mg/L)的钙磷比为500 mg Ca/1 mg P,培养液在加入磷溶液和钙溶液后不会马上发生共沉淀现象. 因此,溶液中磷浓度的降低我们主要归因于植物本身对水体磷的吸附吸收. 而2-100组(P: 2 mg/L,Ca2+: 100 mg/L)的钙磷比为50 mg Ca/1 mg P,但实际上,我们从滤膜过滤后的原水本身是含有20~30 mg/L的钙离子,因此0-100组、0.2-100组和2-100组的钙离子浓度超过了100 mg/L. 实验开始时水体中的磷和钙离子不会发生CaCO3-P共沉淀,但伴随植物生长及光合作用使水体pH值升高,影响了磷和钙离子的浓度,从而导致CaCO3-P共沉淀的发生.
朱端卫等[23]认为沉水植物驱动的水环境钙泵在水体磷循环中发挥着重要的作用,能将水柱中少量的SRP分配在碳酸钙中形成CaCO3-P共沉淀,导致水体中可溶性磷向难溶性磷转化. 杨汉东对洪湖生态系统的研究表明,水生植物的叶和茎巨大有效表面积能承接大量钙盐沉淀物(主要以CaCO3形式存在),植物进行灰化后,占其灰分的86.2%[54]. Siong等[19]研究发现,水柱中的磷能与碳酸钙发生共沉淀结合到植物的节间点,钙磷(HCl-P)形式的增加会增大磷营养盐的沉积.
大部分硬水中的水生植物均有沉淀Ca的能力[55],水生植物光合作用吸收CO2引起pH升高,导致磷酸盐和碳酸盐发生沉淀[43],当光合作用更强烈时,CaCO3-P除磷效果更加明显[56],与其它水生植物相比,轮藻对Ca的沉淀能力更强[57],碳酸盐高达其干重的60%[58]. 在Siong和Asaeda[19]的研究中发现,钙化轮藻比非钙化轮藻能存储更多与碳酸钙共沉淀的磷. 本研究中,在2 mg/L磷浓度下,添加钙离子使菹草的H2O-P和HCl-P含量升高(图4b,c),NaOH-P含量降低(图4a),但总体灰分总磷含量升高(图3a),这表明钙离子添加可通过提高菹草吸附性磷和钙磷含量增强磷的富集. 菹草的干重磷在2-0组含量最高,而灰分磷在2-100组含量最高,主要是因为添加钙离子与水体中的磷发生了共沉淀,导致水体中SRP浓度降低(图2a),菹草对磷的吸收减少,使有机磷含量降低,而共沉淀和吸附作用增强,使钙磷和水溶性磷含量升高,经灰分处理后菹草中的HCl-P被保留下来,有机磷易被分解,因此灰分磷在2-100组最高,而干重磷在2-0组最高.
对于金鱼藻而言,由于高磷浓度下(2 mg/L)的解吸附过程,无钙离子添加时,与0.2 mg/L磷浓度相比,2 mg/L磷浓度下的H2O-P和HCl-P含量显著降低,但钙离子添加显著降低了水体中磷含量(图1b,图2b)的同时,提高了高磷浓度下的植物NaOH-P含量(图4a),这是因为2-100组中的SRP浓度降低至0.6 mg/L左右(图2b),磷对植物的胁迫作用降低,金鱼藻能通过自身作用吸收水体中的磷,导致NaOH-P含量的升高. 对比未添加钙离子组,灰分中H2O-P和HCl-P含量的降低(图4b)导致灰分总磷含量的降低(图3b),金鱼藻的干重磷在2-100组含量最高,而灰分磷含量在0.2-0组最高.
显然,本研究中,100 mg/L的钙离子添加影响了两种植物对水体磷的去除方式和能力,对于菹草而言,是通过提高吸附性磷和钙磷含量增强磷的富集,对于金鱼藻而言,则是显著升高了灰分中有机磷的含量(图4). 这表明在高磷水平下,金鱼藻对水体磷的去除主要是通过吸收作用,如前所述. 由于有机磷在植物腐烂时会经由微生物分解重新进入水体,造成“二次污染”[14],因此,金鱼藻灰分有机磷含量升高仅能表征植物生长时期对水体磷的高富集能力,而不等于金鱼藻对水体磷的真正去除能力. 但CaCO3-P不具有生物活性[19],能在沉积物中长期存储. 在水生态系统中,植物以HCl-P形式来富集水体更多的磷,会增大磷营养盐的沉积,降低水体磷含量抑制浮游植物的生长,从而稳定清水稳态. 本研究中,添加钙离子后,菹草通过提高HCl-P含量增强磷的富集(图4),表现出比金鱼藻更强的形成CaCO3-P共沉淀的能力.
4 结论
1)培养周期内,菹草和金鱼藻均能通过吸收、吸附和CaCO3-P共沉淀作用有效富集水体中的磷,且钙离子添加后,菹草对水体磷的富集效率高于金鱼藻.
2)菹草的干重总磷在高磷低钙(2-0组)水平含量最高,灰分总磷及钙磷均在高磷高钙(2-100组)水平含量最高,而金鱼藻干重磷在高磷高钙(2-100组)水平含量最高,灰分总磷及钙磷含量均在中等磷低钙(0.2-0组)水平最高. 干重磷与钙磷含量的趋势不一致,而灰分磷与钙磷含量趋势一致,因此,以干重磷和灰分磷分别表征植物富集水体磷的能力,会得出不同的结论,灰分磷比干重磷更能表征植物对水体磷的去除能力.
3)添加钙离子对2种植物的影响不同. 在2 mg/L的磷浓度下,添加钙离子使菹草的H2O-P和HCl-P含量升高,NaOH-P含量降低;而添加钙离子使金鱼藻NaOH-P含量升高,H2O-P和HCl-P含量均降低. 这表明菹草通过提高吸附性磷和钙磷含量增强磷的富集,而金鱼藻则只提高有机磷含量. 显然,水体富营养化背景下,相较于金鱼藻,菹草具有更强的形成CaCO3-P共沉淀的能力,具备竞争优势.
