合成黄铁矿去除水中砷(V)的研究
2020-03-27钱天伟赵东叶丁庆伟霍丽娟
王 婷,钱天伟,赵东叶,丁庆伟,霍丽娟
(1.太原科技大学 材料科学与工程学院,山西 太原 030024;2.太原科技大学 环境与安全学院,山西 太原 030024;3.太原理工大学 环境科学与工程学院,山西 晋中 030600;4.奥本大学 土木工程学院,阿拉巴马 奥本 36849)
0 引 言
原生高砷地下水是我国存在的严重的地质环境问题之一,如山西大同盆地土壤及地下水中砷含量极高,且水中砷主要以砷酸盐形式存在[1].水中的砷可以通过农田灌溉等方式引起土壤、粮食中砷浓度的升高,危害居民健康.目前,水中砷的去除方法中,吸附、强化混凝、离子交换、膜过滤、电解等去除方法是人们研究的重点[2-3].基于实际工程应用及污染物去除的长期稳定性考虑,这些方法并不被十分看好.近年来,随着原位修复技术的发展,含铁矿物由于其环境协调性好、修复能力高、二次污染小、成本低等优点,逐渐成为研究的热点.铁氧化物或氢氧化物在固定地下水和土壤中砷污染领域已有应用研究,如水铁矿和针铁矿等在不同的环境条件下均显示出良好的砷吸附效果[3-6].
作为自然界最为丰富的铁硫矿物,黄铁矿(FeS2)分布广泛,海洋缺氧沉积物、海底热液喷口系统以及缺氧地下水系统中都可以发现黄铁矿存在[7].近几年来,黄铁矿对土壤及地下水中金属离子和放射性核素的阻滞和修复作用引起了广泛的关注[7-9].通常,在天然黄铁矿中含有砷杂质成分.黄铁矿的淋洗和风化过程也经常影响砷的迁移及转化[10].我国黄铁矿储量及开采量居世界前列,研究其作为屏障性材料或应急处理材料具有广阔的发展前景.黄铁矿性质稳定,具有较高的表面反应活性,氧化表面化学物质成分多变.黄铁矿粒径大小、结构及成分含量等都是决定黄铁矿表面性质的重要因素.对于合成黄铁矿来说,其污染物处理效果及反应路径与天然黄铁矿又有很大区别,需要进一步深入探讨.本文利用改进的方法合成了黄铁矿材料,对其组成、形貌等进行了分析,对与As(V)反应后的黄铁矿表面成分及形态进行了探讨,并且初步探究了pH以及腐殖酸(HA)添加对As(V)去除的影响,为利用黄铁矿处理土壤和地下水中砷提供了理论基础和实验依据.
1 材料与方法
1.1 化学药品及试剂
硫化钠(NaHS·xH2O),分析纯;三氯化铁(FeCl3·6H2O),分析纯;氢氧化钠(NaOH)和乙酸钠(NaAc),分析纯;盐酸(HCl),分析纯;腐殖酸(HA),去离子水(Direct-Q3,Millipore,美国).所有溶液先用N2气体净化约1 h,去除溶解氧.As(V)使用液(1 000 mg/L)购自济南众标科技有限公司.
1.2 实验仪器
离心机(CF16RXII,日立,日本);冷冻干燥机(LYO GT2-3,SRK,德国);手套箱(天美科学仪器有限公司);X射线衍射仪(XRD,D8 ADVANCE,Bruker,Germany);扫描电镜(SEM,JSM-7001F,JEOL,日本);能谱仪(EDS,QX200,Bruker,德国);激光粒度分析仪(MS2000,Malvern;Bettersize 2000,丹东百特仪器有限公司);X射线光电子能谱(XPS,Thermo Scientific Escalab 250Xi,USA).原子吸收光谱仪(novAA 400P,Analytik Jena AG,德国);HS55型氢化物发生(Analytik Jena AG,德国).
1.3 黄铁矿的制备
黄铁矿的合成是以Han等人(2012)的方法为基础[11].在手套箱中,将0.05 mol/L FeCl3和0.1 mol/L NaHS溶液等体积混合,Fe/S摩尔比是1/2.使用NaOH和HCl(0.1 mol/L)和NaAC(0.6 mol/L)溶液将pH值调整为4.3~4.5.NaAc/Fe摩尔比为1.2.制备的悬浮液在60 ℃左右的水浴中放置1 d.
1.4 合成黄铁矿的表征
合成的黄铁矿粒子用高速离心机以6 500 r/min 的转速离心20 min,然后倒掉上清液,放入冷冻干机中冷冻干燥.得到的粉末用X射线衍射仪(XRD)进行成分分析,用扫描电子显微镜(SEM)进行颗粒形貌分析.
1.5 黄铁矿对砷(V)的还原固定
在手套箱中将黄铁矿粒子、As(V)溶液混合于棕色反应瓶中,混合体积为35 mL,砷(V)初始浓度为1 mg/L,黄铁矿粒子浓度为0.48 g/L.再用NaOH和HCl(1 mol/L, 0.1 mol/L)调节溶液的pH值为3.0,6.0,8.0,10.0.将反应瓶放置在旋转仪上转动.用氢化物原子吸收光谱仪测定溶液中的砷浓度.用X射线光电子能谱仪(XPS)分析反应后黄铁矿表面及As形态.
1.6 腐殖酸对砷(V)去除的影响
2 结果与分析
2.1 合成黄铁矿的分析表征
图1 为新制备的黄铁矿颗粒的XRD图谱.其中,特征峰在2θ值为33.07°,37.03°,40.79°,47.45°和56.34°(标示区域)代表黄铁矿的晶体结构[11-12].其余特征峰在2θ值为30.16°, 36.51°, 47.98°和52.69°代表四硫化三铁(Fe3S4)杂质[12-13].XRD光谱清楚地显示了最终产物中FeS2和Fe3S4的共存.

图1 合成黄铁矿的XRD图
黄铁矿的合成反应产生了大量的H+.在合成过程中,低pH值(4.3~4.5)及高温(60 ℃)都有利于气态H2S的形成.硫化物的损失会改变Fe/S的比例,从而导致Fe3S4的形成[13].NaAc的添加可以稳定pH,减少pH调节过程中不必要的S损失.另外,Fe3S4与S原子结合或者Fe3S4失去铁原子都可转化形成FeS2(Eqs.(1)~(2))[13].
Fe3S4+2S→3FeS2,
(1)
Fe3S4→2FeS2+Fe.
(2)
图2 为添加NaAc为pH稳定剂合成的黄铁矿颗粒的SEM图像和相应的EDS谱.SEM图像显示,黄铁矿晶体呈现出较规则的长方体形态.EDS分析证实,S和Fe是主要元素,结果与XRD分析结果一致.NaAc/Fe摩尔比1.2合成的黄铁矿具有较高的S/Fe原子比(更接近2.0).不添加NaAc合成的黄铁矿平均粒径约为2.2±0.2 μm,比表面积(SSA)为2.93 m2/g.本文合成的黄铁矿颗粒平均粒径为1.6±0.2 μm,SSA为7.42 m2/g,粒径更小,比表面积更大.


图2 合成黄铁矿的SEM和EDS图
2.2 吸附动力学研究
为研究FeS2粒子对水体中As(V)的吸附动力学特征,Lagergren准一级动力学和Ho准二级动力学方程被用来对As(V)的吸附进行模拟.
Lagergren准一级动力学方程
qt=qe-qeexp(-k1t).
(3)
Ho准二级动力学方程
(4)
式中:qt和qe(mg/g)分别为t(h)时间和均衡时的As(V)吸附量,k1(h-1)和k2(g/(mg·h))分别为准一级、准二级动力学方程吸附速率常数.图3 是黄铁矿粒子在pH为8.0时对As(V)的吸附动力学拟合结果,拟合参数如表1 所示.由图可知,合成的黄铁矿粒子吸附As(V)的过程符合准二级动力学方程,拟合相关系数R2>0.999,并且拟合得到的qe2与实际试验中所得平衡吸附量相差不大.动力学模拟显示,黄铁矿对水体中As(V)的去除不仅有物理吸附过程,且包括化学吸附过程.化学吸附是控制反应速率的步骤.整个As(V)去除反应可能与多重吸附和电子转移的组成效应有关.
叶晓晓承认夏天的聪明和敏感,但她怎么才能让夏天明白她的苦恼,且不说夏天能不能接受这样的事,只是这件事从何说起啊。叶晓晓不想告诉夏天,他活在那个简单的世界里,他哪里能明白这个五彩缤纷的世界里的诱惑呢。


图3 合成的FeS2去除As(V)的吸附动力学曲线

表1 准一级和准二级动力学模型拟合参数
2.3 XPS分析
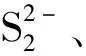
图4(c)为反应后的As(3d)XPS拟合图谱,砷特征峰有3d5/2和3d3/2双重峰,结合能差为0.7±0.1 eV,位于约44.4 eV(3d5/2)和45.0 eV(3d3/2)处为三价砷氧化物特征峰.三价砷结合能低于五价砷1 eV左右,对应45.4 eV(3d5/2)和46.1 eV(As3d3/2)处为五价砷化合物的特征峰[15-16].结果分析可知,还原固定和直接吸附作用都在黄铁矿表面发生.根据峰位面积进行半定量计算的结果可知,在pH为6.0的条件下,大约45.9% 的砷以三价砷的形式存在.



图4 与As(V)反应后黄铁矿表面Fe 2p,S 2p和As 3d XPS图
在接触溶解氧时,黄铁矿表面可能发生的反应为
(5)
FeS2+3.75 H2O+2.5O2→FeOOH+
(6)
在偏中性环境中,Fe(III)含量直接影响黄铁矿氧化程度.
FeS2+ 14Fe3++8H2O→15Fe2++
(7)
在含有三价铁的情况下,黄铁矿表面硫化物可能的氧化途径还包括[17]
(8)
(9)
表面铁氧化物的产生对As(V)的去除至关重要,其产物如FOOH,Fe(OH)3,Fe2(SO4)3等可以在共沉淀、表面吸附等作用下对As(V)有明显的去除效果[4-6,17].
2.4 pH影响
图5表明,在不同的pH值条件下,黄铁矿对砷(V)都有去除效果.pH值为3.0和6.0时,吸附去除效率都达到了99%以上.pH值为6.0时,在反应开始20 min后,砷(V)的去除率就达到了99%以上.在pH 8.0时,黄铁矿对砷(V)的去除效果也较好,约80%的砷(V)被去除掉.而pH值为10.0时砷(V)的去除率只有48.8%.随着pH升高,Fe(II)在黄铁矿表面析出速度大大降低.


图5 pH值对合成的黄铁矿去除As(V)的影响

2.5 HA影响
从图6 可以看出,腐殖酸对不同的pH值条件下的砷去除实验产生不同的效果,在pH值为6.0时,加入腐殖酸后砷的去除率有所降低,但影响并不很明显.pH值为10.0时,加入腐殖酸后,黄铁矿对As(V)的去除率明显升高.
HA结构复杂,是含有多个官能团的大分子物质.这些官能团具有还原性作用和吸附络合等作用[20].随着pH降低,HA的溶解度也随之降低.溶液中盐浓度、阳离子电荷密度、pH降低等变化都可以引起HA的团聚[21].带负电的HA易于在黄铁矿表面吸附(合成黄铁矿的pHPZC≈6),同时HA可与Fe3+和Fe2+等离子络合,与As(V)竞争黄铁矿表面吸附位点[22],造成As(V)去除效果的降低.且可溶性As(V)-HA类络合物也可能形成,由于空间位阻及表面电荷等因素影响而难以被黄铁矿表面吸附,从而影响As(V)的去除效果[23].但黄铁矿较大的比表面积使得表面吸附位点难以被HA饱和,且pH为6.0时,反应速率较快,HA添加对As(V)的去除有一定的抑制作用,但影响不是十分明显,混合液中HA浓度为30 mg/L 时,As(V)去除率依然可达94.5%.

图6 腐殖酸对黄铁矿去除As(V)的影响
随着pH升高,HA在黄铁矿上的吸附也会降低,这是由于带负电荷的黄铁矿表面与带负电的HA之间的静电斥力增加所致.HA的加入促进As(V)去除效果增强的原因可能是:① HA提供了As(V)的额外还原;② 吸附在黄铁矿表面的HA可以进一步吸附As(V)和As(III).此外,较高的pH有利于可溶性HA-铁物质的形成,使黄铁矿表面钝化程度降到最低,并且可溶性铁进一步可与As(V)发生吸附沉淀作用.
3 结 论
本文研究了合成的黄铁矿对As(V)的去除效果.实验结果显示,在不同条件下,黄铁矿对As(V)都有明显去除效果.主要结论如下:
1)合成的黄铁矿成分为FeS2,与一般条件合成下的黄铁矿相比,粒径分布范围更小,比表面积更大.含很少杂质,主要为四硫化三铁.
2)XPS图显示,反应后的黄铁矿表面出现了S2-、中间硫化态以及硫酸盐等产物,产生了大量Fe(III)-O 或Fe(III)-S等产物,易于对As(V)发生吸附或沉淀作用.黄铁矿表面氧化程度较高,氧化还原反应迅速.
3)黄铁矿在酸性条件下对砷的吸附率较快,pH为6.0时As(V)反应速率最快.在pH为8.0左右时,黄铁矿对As(V)的去除率也比较高,能达到80%左右;在强碱性条件下,去除率相对较低.
4)腐殖酸的加入,在pH为6.0偏中性条件下,对As(V)的吸附有轻微抑制作用;在碱性条件下加入腐殖酸对As(V)吸附有促进作用.
