仙灵骨葆胶囊对去势大鼠骨组织H3K36me3、H3K9me3及JMJD2A表达的影响
2020-03-26王粤淇霍少川陈德龙张濛唐宏宇王海彬
王粤淇 霍少川 陈德龙 张濛 唐宏宇 王海彬*
1.广州中医药大学第一临床医学院,广东 广州 510405 2.广州中医药大学岭南医学研究中心中医骨伤科学实验室,广东 广州 510405 3.广州中医药大学第一附属医院关节骨科,广东 广州 510405
骨质疏松症(osteoporosis,OP)是一种以骨吸收增多、骨显微结构损坏,最终导致易于骨折为特征的骨科疾病[1]。我国约有13%的人口患有骨质疏松症,且发病人数呈上升趋势,推测2020年患者人数可达2.86亿[2]。表观遗传是不通过DNA改变就能导致可遗传的基因表达变化,这种变化的调控方式包括DNA甲基化、组蛋白修饰、染色质重塑和微小RNA(miRNA)等[3]。骨质疏松与表观遗传关系密切[4],DNA低甲基化状态能提高成骨分化效率[5],组蛋白去甲基化酶KDM4B能通过调节DLX基因族促进骨髓间充质干细胞成骨分化[6],miR-138通过抑制局部黏附激酶的表达阻碍成骨过程序[7]。笔者前期研究发现骨质疏松症可能与体内 H3K9、H3K36甲基化升高有关,组蛋白去甲基化酶JMJD2 A、JMJD2B是骨质疏松症的潜在治疗靶点之一[8]。中医学认为骨质疏松的发生与肾虚存在密切关系[9],研究发现补肾健骨中成药仙灵骨葆对骨质疏松具有较好的临床疗效[10],目前缺少仙灵骨葆在表观遗传方面的研究,本研究观察仙灵骨葆在去势大鼠体内防治骨质疏松的潜在表观遗传学机制。
1 材料与方法
1.1 动物与实验药品
本次实验大鼠由广州中医药大学实验动物中心提供,通过动物伦理批准。12周龄的SPF级别雌性大鼠24只[许可证编号:SYXK(粤)2013-0001;质量合格证编号:44005800008146],体重(302±19) g,饲养于广州中医药大学第一附属医院SPF实验室,SD雌性大鼠适应当地动物实验中心条件(温度:24 ℃~26 ℃,湿度:67%,无菌状态,每天12 h光明/黑暗),大鼠自由获取水和饲料。
药物:仙灵骨葆胶囊由淫羊藿(加俄西)、地黄、丹参、川续断(窝魁乃)等多种中药制成,生产于贵州同济堂制药有限公司,药品批准文号:国药准字Z20025337。福美加,生产于杭州默沙东制药有限公司,药品批准文号:国药准字J20130085。
1.2 主要仪器与试剂
1.2.1仪器:本实验所需仪器主要包括由Bio-Rad公司提供的荧光定量PCR仪器、电泳仪、逆转录仪、全能型凝胶成像系统;Thermo公司提供的多功能酶标仪;Eppendorf公司提供的离心机;Leica公司提供的多功能自动染色机、全自动组织脱水,Merinton公司提供的微量核酸定量仪,OLYPUS公司提供的研究型正置荧光生物显微镜,灰度分析软件。
1.2.2试剂:本实验所需试剂主要包括由Genecopies公司提供的荧光定量PCR检测试剂盒(AOPR-1200),DBI公司提供的逆转录试剂盒(DBI-2220);弗德生物提供的BCA蛋白定量试剂盒(FD2001);美国Sigma公司提供的伊红液、苏木精。引物设计为:JMJD2A:上游:5’-CTCTCCCTGGAGGAGAATAAGA-3’,下游:5’-GGTGTCAGCTGTTCAGAAGT-3’;H3:上游:5’-TCACTCAGGATGAATGGAAAGAG-3’,下游5’-CACCCATCCCTTCTGCATATA-3’;GAPDH(内参):上游:5’-AGTTCAACGGCACAGTCAAG-3’,下游:5’-TACTCAGCACCAGCATCACC-3’,上述引物由广州四和生物科技有限公司提供。
1.3 动物分组与造模
采用随机数字表法将24只SD雌性大鼠分为空白对照组、阴性对照组、实验组和阳性对照组(6只/组)。阴性对照组、实验组和阳性对照组大鼠切除双侧卵巢,空白组大鼠仅去除卵巢周围等量脂肪组织,术中及术后无大鼠死亡。1周后实验组予仙灵骨葆胶囊,阳性对照组予福美加,参照《药理实验方法学》[11],按大鼠-人等效给药剂量换算,仙灵骨葆等效给药剂量为30.85 mg/(100 g·d),福美加等效给药剂量为11.7 mg/(100 g·d),空白对照组及阴性对照组予等体积生理盐水,给药频率:1次/d,6 d/周。大鼠每7天称1次体重并记录,根据最新大鼠体重计算各组给药剂量,持续喂药3个月。
1.4 实验指标检测
检测指标:RT-PCR检测组蛋白H3和JMJD2A mRNA;Western blot检测H3K36me3、H3K9me3和JMJD2A蛋白表达;HE染色观察骨组织。
将50 mg左侧股骨髁骨组织研成粉末状后置入EP管内,加入1 mL Trizol Reagent进行冰浴,并持续匀浆30 min,取匀浆后上清液至新EP管内,12 000 r/min离心15 min,上清液置入新EP管备用,提取总RNA。通过qRT-PCR检测组蛋白H3和JMJD2A mRNA表达。
向装有50 mg左侧股骨髁骨组织的EP管内加入约10倍股骨组织体积RIPA裂解液,匀浆处理,获取总蛋白并进行定量,上样、电泳与转膜,孵育一抗、二抗、成像、分析灰度值,校准采用β-actin为内参蛋白,采用蛋白条带灰度值/β-actin条带灰度值来表示H3K36me3、H3K9me3和JMJD2A蛋白表达水平。
取右侧股骨髁骨组织,冲洗,4%多聚甲醛液固定24 h以上,10%(w/v)EDTA脱钙液中脱钙约1个月,去酸、脱水、透明、浸润,石蜡包埋后切5 μm厚片。苏木精和伊红(HE)染色,显微镜下观察(bx53,奥林巴斯公司,日本),进行描述性分析。
1.5 实验数据分析处理
收集数据并用SPSS 19.0统计软件处理。采用方差齐性检验,方差齐时采用单因素方差分析,方差不齐时采用非参数方差分析,多组间两两比较采取单因素方差分析LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 股骨髁HE染色结果
40×镜下观察,与空白组相比较,阴性对照组骨小梁分布较紊乱,连续性较差,数目明显减少,厚度降低。与阴性对照组相比较,实验组和阳性对照组骨小梁连续性较好、排列较为整齐,骨小梁数量稍增多,骨小梁厚度增加。400×镜下观察,阴性对照组骨髓腔脂肪细胞明显多于实验组、空白组及阳性对照组。见图1。

图1 各组大鼠股骨髁骨组织HE染色 A:空白组;B:阴性对照组;C:实验组;D:阳性对照组。Fig.1 HE staining in the femoral and condyle bones of rats in each group. A: Blank group; B: Negative control group; C: Experimental group; D: Positive control group.注:各组中显微镜(400×)图像置于(40×)图像右侧。图中箭头标示脂肪细胞。
2.2 仙灵骨葆对去势大鼠组蛋白H3及JMJD2A mRNA表达的影响
与空白对照组相比,阴性对照组JMJD2A mRNA表达明显下降(P<0.05),组蛋白H3mRNA表达水平明显上升(P<0.05)。与阴性对照组相比较,实验组、阳性对照JMJD2A mRNA表达水平上升(P<0.05),组蛋白H3mRNA表达水平明显下降(P<0.05)。阳性对照组与实验组之间JMJD2A、组蛋白H3mRNA表达无明显差异(P>0.05)。见图2。
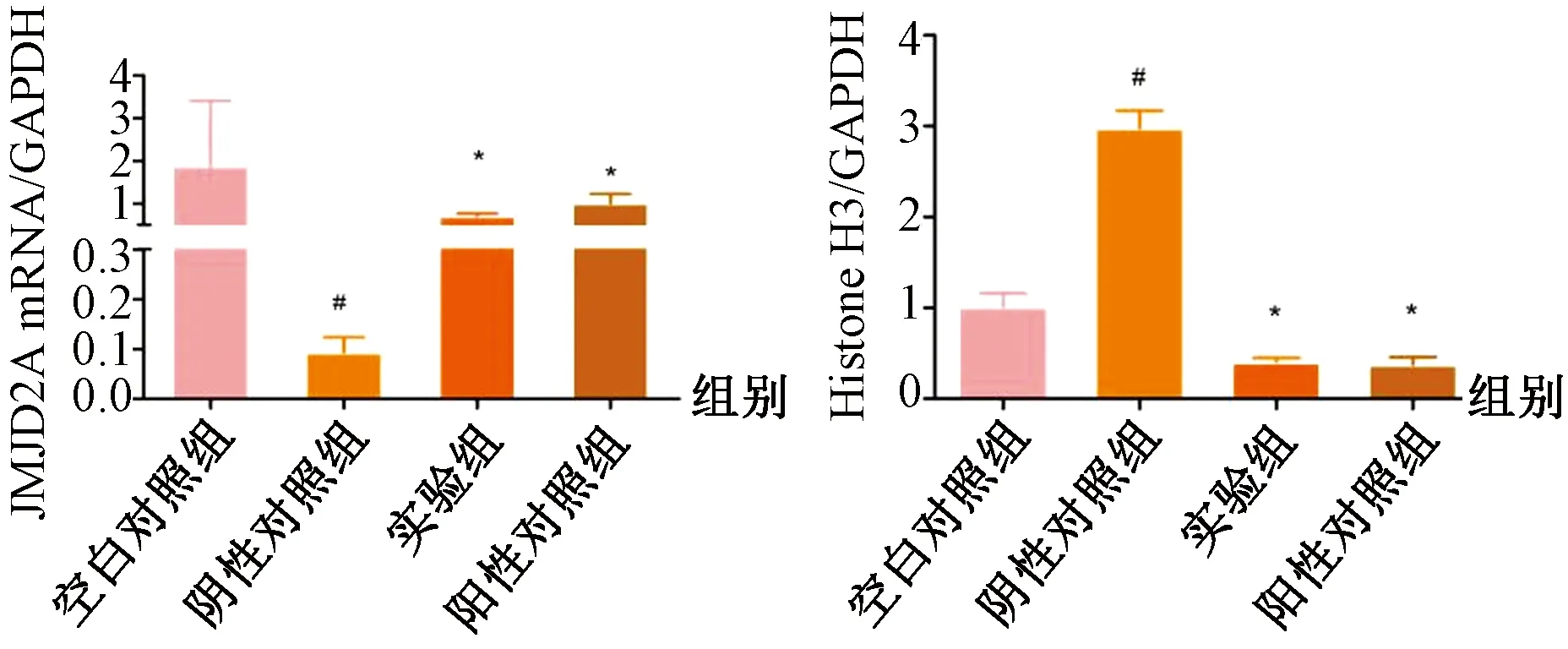
图2 各组大鼠JMJD2A、组蛋白H3 mRNA表达水平Fig.2 mRNA expression levels of JMJD2A and histone H3 in each group注:与阴性对照组比较,*P<0.05;与空白对照组比较,#P<0.05。
2.3 仙灵骨葆对去势大鼠H3K36me3、H3K9me3、JMJD2A蛋白表达的影响
与空白对照组比较,阴性对照组JMJD2A蛋白表达水平明显降低(P<0.05),H3K9me3、H3K36me3蛋白表达水平明显升高(P<0.05)。与阴性对照组比较,实验组、阳性对照组JMJD2A蛋白表达水平明显升高(P<0.05),H3K9me3、H3K36me3蛋白表达水平明显下降(P<0.05)。阳性对照组与实验组之间H3K36me3 蛋白表达无明显差异(P>0.05)。见图3。

图3 各组大鼠JMJD2A、H3K9me3、H3K36me3蛋白的表达水平Fig.3 Expression level of JMJD2A, H3K9me3, H3K36me3 proteins in each group注:与阴性对照组比较,*P<0.05;与空白对照组比较,#P<0.05。
3 讨论
现代医学认为,骨质疏松发病机制是骨重建时成骨-破骨之间的动态平衡被改变[12]。骨质疏松症在中医学范围内属“骨痿”,病因病机以肾虚为本,脾虚为促进因素[9]。仙灵骨葆胶囊主要由淫羊藿(加俄西)、地黄、丹参、川续断(窝魁乃)等中药组成,具有补肾益肝、强筋壮骨功效,是骨质疏松症首选中成药制剂[13]。研究表明,仙灵骨葆可通过调节BMP-2、TIMP-1和PDGF的表达与PGI2和PGE2合成来提高骨质疏松性骨折后骨密度[14],可显著降低骨周转率、促进成骨及抑制脂肪生成、促进骨小梁结构改善[15],对骨吸收起抑制作用[16]。
组蛋白甲基化是将甲基转移到赖氨酸残基,赖氨酸存在不被修饰(me0)、一甲基化(me1)、二甲基化(me2)或三甲基化(me3)4种状态,这些组蛋白甲基化状态导致染色质结构改变,调节转录因子获得相关基因启动子来调控基因[17]。甲基化的调控受到组蛋白去甲基化酶和组蛋白赖氨酸甲基转移酶(KMTs)的双向调节[18]。据报道,KMT1E/ESET能提升H3K9me3的表达水平[19],并通过减少Runx2的转录活性来抑制成骨分化[20]。组蛋白去甲基化酶被分为两类:赖氨酸特异性去甲基化酶家族和JmjC家族。KDMs从组蛋白赖氨酸残基中去除甲基[21],JmjC家族组蛋白去甲基化酶通过2OGFe(II)依赖的双氧酶反应催化去除甲基残基,发挥生物学功能[22]。JMJD2A又叫作KDM4A,是一种组蛋白去甲基化酶,它可以催化H3K9me3和H3K36me3去甲基化,发挥转录激活和抑制因子的作用[23-24]。组蛋白去甲基化酶KDM4B/KDM6B能调节骨形成相关基因Runx 2、AP-1、ATF 4、Smad等的表达,促进间充质干细胞(bone marrow derived mesenchymal stem cell,BMSCs)成骨性分化[25],KDM4B和KDM6B通过消除 H3K9me3和H3K27me3甲基化修饰影响骨髓BMSCs向成骨细胞分化[6]。上述研究说明JMJD2A能直接或间接通过组蛋白H3的第36和第9位点甲基化修饰影响成骨分化。
本研究结果表明,对比空白组,阴性对照组大鼠摘除卵巢后,HE股骨髁骨组织出现骨质疏松病理特征,实验造模成功。阴性对照组中H3K9me3及H3K36me3表达增加,这与笔者前期研究结果存在一致性[8]。仙灵骨葆胶囊干预后,对比阴性对照组结果,去势大鼠股骨髁骨组织中骨小梁结构改善,髓腔内脂肪细胞减少,JMJD2A高表达及H3K9me3和H3K36me3低表达。说明仙灵骨葆胶囊对大鼠去卵巢后形成的骨质疏松症状具有改善作用,能提高去势大鼠骨组织中组蛋白去甲基化酶JMJD2A表达量,抑制H3K9me3、H3K36me3水平。
综上所述,仙灵骨葆胶囊能参与去势大鼠组蛋白修饰,其治疗骨质疏松症的潜在机制可能通过提高JMJD2A表达,抑制H3K9me3、H3K36me3表达实现,为解释仙灵骨葆胶囊在抗骨质疏松治疗中的表观遗传机制提供了一定的前期基础,但JMJD2A调控成骨-破骨平衡的机制暂不明确,仍需更深层次研究。
