白藜芦醇对1型糖尿病小鼠骨组织代谢的影响
2020-03-26刘方超陈颖董冰子付正菊王颜刚胡建霞
刘方超 陈颖 董冰子 付正菊 王颜刚 胡建霞
青岛大学附属医院内分泌科,山东 青岛 266000
1型糖尿病(type 1 diabetes mellitus,T1DM)由于胰岛素绝对不足,引起蛋白质合成代谢障碍,高血糖引起多尿造成的钙、磷、镁从尿中大量丢失,致使患者骨量减少甚至骨质疏松,骨折风险较一般人群显著增加。随着医疗技术水平的提升,T1DM患者生存期明显延长,其骨骼损害被日益关注。T1DM多为青少年或儿童起病,针对该人群骨质疏松症的治疗经验较为有限,现有手段主要为控制血糖及钙剂、维生素D补充治疗。然而上述药物的具体使用剂量尚未统一,治疗效果尚不完全明确。白藜芦醇是一种中药单体,研究发现其具有优良的抗氧化和抗炎作用,能够促进骨髓间充质干细胞的成骨分化。因此,本研究旨在通过构建T1DM骨质疏松动物模型,研究白藜芦醇对T1DM鼠并发骨破坏的治疗作用,为临床治疗青少年T1DM合并的骨损害提供新思路。
1 材料和方法
1.1 实验动物
SPF级雌性NOD小鼠,体质量20~24 g,6~8周龄,购自南方模式动物有限公司。相对湿度40%~50%,室温22℃~25℃,自由进食及饮水。12 h日光交替照射。经检测NOD小鼠按随机表方法分为:(1)糖尿病组(DM组,n=6):糖尿病发病后用0.9%氯化钠溶液灌胃;(2)胰岛素组(INS组,n=6):发病后每日予甘精胰岛素皮下注射治疗,剂量为0.2~0.4 U/kg,根据当日血糖进行调整;(3)白藜芦醇组(RESV组,n=6):于发病后第3天予RESV 200 mg/(kg·d)灌胃;(4)饲养8周后,未发病的NOD小鼠作为正常对照组(N组,n=6)。
1.2 Micro-CT检测
治疗8周后脱颈处死小鼠,右侧股骨70%乙醇固定,进行Micro-CT扫描(eXplore Locus User Guide,GE),对骨组织各项参数进行分析。
1.3 股骨切片碱性磷酸酶染色(偶氮偶联法)
左侧股骨10%乙二胺四乙酸(EDTA)脱钙液脱钙21 d后,石蜡包埋、切片行碱性磷酸酶(alkaline phosphatase,ALP)染色(碱性磷酸酶染色液,Solarbio)。低倍镜(×100倍)下观察骨小梁形态,高倍镜(×400倍)计数骨股头骨小梁内成骨细胞数目。
1.4 骨组织内相关基因表达:OCN、Runx2、PPARr、TRAP mRNA表达
实时定量荧光定量 PCR(RT-PCR)检测 OCN、Runx2、PPARr、TRAP mRNA的表达。将小鼠股骨组织冲洗干净骨髓腔,称取质量后,加入适量TRIzol,按试剂盒说明书提取总RNA。取2 μL总RNA,加入5*PrimeScript Buffer(for real time)2 μL;PrimeScript RT Enzyme MixI 0.5 μL;Oligo dT Primer 0.5 μL;Random 6 mers 0.5 μL;RNase Free dH2O 4.5 μL。反应液震荡离心10 s,使其聚集于EP管底部。在PCR仪上按下列条件进行逆转录反应:37 ℃ 15 min,85 ℃ 5 s,4 ℃逆转录为cDNA。
RT-PCR反应条件为95 ℃ 30 s(升温速率为4.4 ℃/s)1循环;95 ℃ 5 s(升温速率4.4 ℃/s)、60 ℃ 30 s(升温速率2.2 ℃/s) 40循环;95 ℃ 5 s(升温速率4.4 ℃/s)、60 ℃ 1 s(升温速率2.2 ℃/s) 95 ℃ 5 s(升温速率 0.11 ℃/s)。反应结束后记录各样本CT值。PCR结果定量用ΔΔCT法,CT=目的基因CT-内参基因CT,以正常组作为对照样本,ΔΔCT=观察样本ΔCT-对照样本ΔCT。样本的相对表达量=2-ΔΔCT。检测骨组织相关基因引物序列见表1。
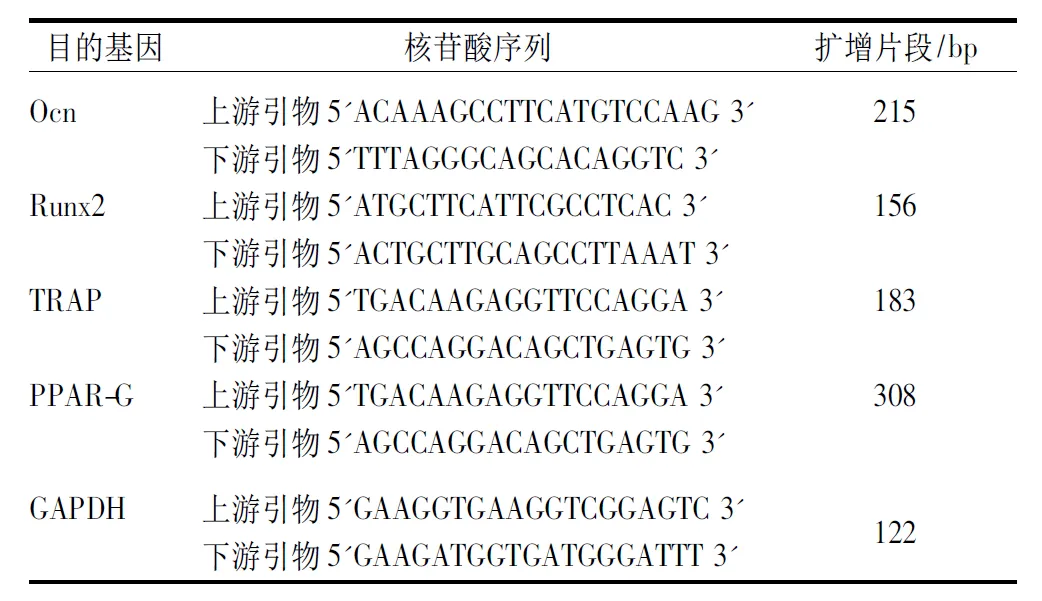
表1 检测骨组织表达基因引物序列Table 1 Primer sequences of expressed genes in bone tissues
注:以上引物均委托深圳华大基因科技有限公司合成。
血清酸性磷酸酶(acid phosphatase,ACP)检测(ELISA法)小鼠内眦取血室温静置30 min,2 000 r/min离心15 min,取上层血清。ELISA法检测血清酸性磷酸酶量。
1.5 统计学分析
运用SPSS 13.0软件分析,数据用均值±标准差表示,两组间差异用t检验,多组间比较用单因素方差分析,α=0.05。
2 结果
2.1 骨组织Micro CT结果
2.1.1Micro CT参数:骨组织3D参数分析(图1)显示,与正常组相比,糖尿病组骨密度(bone mineral density,BMD)降低(P=0.015),骨体积百分比(BV/TV)降低(P=0.049);与糖尿病组相比,白藜芦醇治疗组BMD升高(P=0.008),BV/TV升高(P=0.014)、骨表面密度(BS/TV)增加(P=0.016),结构模型指数(structural model index,SMI)升高(P=0.029);与胰岛素治疗组相比,白藜芦醇治疗组骨小梁数目(Tb.N.)明显增加(P=0.018)。

图1 各组间骨组织Micro-CT参数Fig.1 Micro-CT parameters of the bone tissue in each group注:BMD:骨密度;BMC:骨矿物质含量;SMI:股骨结构模型指数;Calib.Tb.Th.3D:三维校准骨小梁厚度;Calib.Tb.Sp.3D:三维校准骨小梁分离度;BV/TV:骨体积分数;Tb.N:骨小梁数目。
2.1.2骨组织Micro-CT平片:从骨组织2D平片纵切面上观察(图2),与正常组相比,DM组皮质骨变薄,骨髓腔相对扩大。与DM组相比,RESV组、INS组皮质骨致密。由图2C可见,与正常组相比,DM组骨股头骨小梁数量明显减少。与DM组相比,RESV组、INS组骨小梁增多。

图2 骨组织Micro-CT平片图像 A:股骨纵切面,观察皮质骨及骨小梁差别;B:取股骨中段切面观察皮质骨厚度;C:股骨头正中切面观察骨小梁差别。Fig.2 Micro-CT plain film image of the bone tissue. A: The difference of cortical bone and trabecula was observed in longitudinal section of the femur; B: The thickness of cortical bone was observed in midsection of the femur; C: The difference of trabecula was observed in median section of the femoral head.
2.1.3股骨头骨小梁重建:骨组织Micro-CT应用Image J软件对股骨头部分进行重建(图3A)。DM组骨小梁形态模糊,数量减少、变细、中断,残端游离,小梁间距增宽。INS组及RESV组骨小梁相互连接成立体网状,小梁表面光滑,小梁间距小。各组间骨小梁数目经Micro-CT扫描结果见图3B,结果表明,DM组骨小梁数量明显减少(P=0.018),INS组、RESV组与正常组之间比较差异无统计学意义。
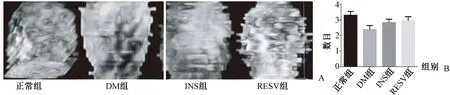
图3 股骨头骨小梁重建及参数比较 A:股骨头骨小梁重建;B:各组骨小梁数目统计。Fig.3 Trabecular reconstruction of the femoral head and comparison of the parameters. A: Trabecular reconstruction of the femoral head; B: Statistics of trabecular number in each group.
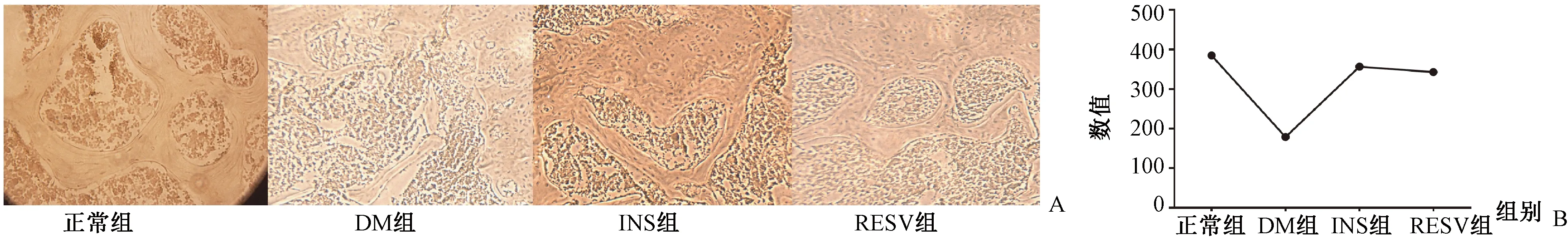
图4 骨组织切片ALP染色比较成骨细胞 A:ALP染色,成骨细胞;B:各组间成骨细胞数量比较。Fig.4 The osteoblasts were compared using ALP staining in bone tissue sections. A: ALP staining, osteoblasts; B: Comparison of the number of osteoblasts among groups.
2.2 骨组织切片并ALP染色
骨组织切片ALP染色可见,糖尿病组骨小梁结构杂乱、变细,胰岛素治疗及白藜芦醇治疗组骨小梁结构完整连续。各组分别取连续3张切片,应用Image J统计切片中股骨头处的成骨细胞,计算其平均值进行比较,结果(图4)显示,糖尿病组成骨细胞明显减少,胰岛素治疗组成骨细胞数目略多于白藜芦醇治疗组。
2.3 骨重建相关基因mRNA RT-PCR检测
各组骨组织相关基因mRNA RT-PCR相对表达量结果(图5)可见:DM组TRAP、PPAR-G相对表达量增加(P=0.032、0.013);与DM组相比,INS组TRAP、PPAR-G相对表达量降低(P=0.025、0.017),Runx2相对表达量增加(P=0.030);RESV组TRAP、PPAR-G表达量降低(P=0.013、0.028),Runx2表达量增加(P=0.034)。
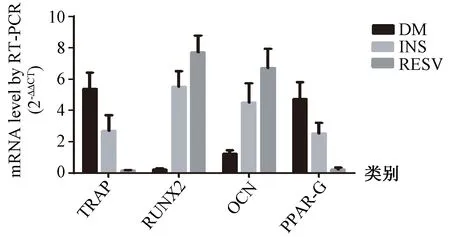
图5 各组间骨重建相关基因mRNA RT-PCR相对表达量比较Fig.5 Comparison of RT-PCR results of relative expression of bone remodeling-related genes among different groups
2.4 血清TRACP检测比较
正常组、DM组、INS组、RESV组小鼠血清TRACP检测结果分别为(15.24±0.85) μg/mL、(18.38±0.76) μg/mL、(13.84±1.02) μg/mL、(13.08±0.93) μg/mL。与正常组相比,DM组血清TRACP水平明显升高(P=0.026);与DM组相比,INS组TRACP水平明显降低(P=0.019);与DM组相比,RESV组TRACP水平明显降低(P=0.009)。
3 讨论
T1DM降低骨密度并增加脆性骨折风险的主要原因是骨形成减少,然而1型糖尿病对骨吸收的影响存在争议。Tsentidis等[1]通过对T1DM儿童和青少年骨代谢研究发现,成骨细胞相关信号减低,而s-RANKL等破骨细胞信号传导增加。Peng等[2]研究发现,T1DM小鼠表现出成骨细胞数量/骨表面积、矿物结合率减低,NF-κB配体受体表达下降,这些因素共同作用引起骨吸收受损。近年来研究表明,PPAR-G基因缺失可通过增加骨形态发生蛋白家族成员的产生和分泌来促进骨形成并减少骨吸收,从而增加小鼠骨密度[3]。与之相反,PPAR-G激活剂(如噻唑烷二酮类)通过增加骨硬化蛋白的表达抑制骨形成[4]。本研究结果显示T1DM小鼠骨组织骨小梁变细、数量减少,成骨细胞数量减少结合OCN、Runx2基因下调,符合骨形成减少,PPAR-G、TRAP基因表达增加,表明骨吸收增加。本研究表明,T1DM骨破坏是骨形成减少、骨吸收增加二者共同作用的结果。然而,T1DM引起的成骨减少、破骨增加,二者孰轻孰重、发生的时间前后关系以及补充VitD和钙剂是否能延缓甚至避免这些事件的发生,这些问题尚需要进一步研究。
T1DM继发的骨损害是通过多种机制实现的,血管生成损伤[5],糖尿病微血管病变[6-7],慢性血糖控制不佳[8]等。近年来研究发现,C肽替代治疗可以改善糖尿病相关并发症[9]。Russo等[10]研究发现C肽可激活人类成骨细胞样细胞(Saos-2)中的ERK1/2途径,增加I型胶原,参与骨重建过程。因此,T1DM患者继发的骨损害是无法完全通过胰岛素替代治疗来改善的。本研究发现,胰岛素治疗后的T1DM小鼠骨组织中,虽然OCN、Runx2基因上调明显,仍存在骨小梁变细、数量减少以及成骨细胞减少,表明胰岛素在改善糖尿病骨损害上仍有局限性。
研究表明,常规补充钙剂及VitD对治疗T1DM骨损害作用有限。阿仑膦酸短期治疗可抑制成骨细胞凋亡来预防T1DM鼠骨损害,长期治疗可以增加骨密度但是以抑制骨形成为代价的[11]。同时,美国食品药品监督管理局未批准阿仑膦酸用于儿童。因此,用于治疗T1DM青少年骨损害的方法非常少。
近年来,研究者逐步探求新的骨损害治疗方法。Zhang等[12]发现益生菌治疗T1DM鼠骨损害的新途径。Zhang等[13]研究发现枸杞子乙醇提取物通过对十二指肠钙转运蛋白和肾脏CaSR的调节作用从而减轻T1DM小鼠高钙尿并防止骨小梁退化,同时发现石榴籽提取物具有减轻糖皮质激素诱导的小鼠骨丢失和高钙尿[14]。Pino等[15]研究发现,白藜芦醇在治疗T1DM鼠合并骨外伤时,具有独立于胰岛素治疗以外的促成骨作用。本研究更进一步表明,白藜芦醇在治疗继发于T1DM的骨损害具有积极作用,其作用可能是从多方面实现的,除外已被证实的降糖、抗氧化作用外,本研究发现其上调Runx2、OCN基因,促进成骨细胞增殖,防止继发于糖尿病的成骨细胞凋亡;PPAR-G基因下调同时表明白藜芦醇有抑制骨髓干细胞向脂肪细胞分化的作用。白藜芦醇促进成骨的分子机制尚需进一步明确。
总之,T1DM引起的成骨细胞数量减少,成骨活性减弱,破骨活性增强,骨髓干细胞脂肪化是继发骨损害的主要原因。目前,治疗青少年骨损害方法有限,白藜芦醇可以从多角度增加成骨细胞数量、增加成骨细胞活性、减少骨吸收,或将成为临床治疗继发于糖尿病的骨损害的有效方法。
