甲状旁腺素联合降钙素对大鼠骨质疏松的治疗作用
2020-03-26何嘉张远成杨亚军刘丹孟庆飞
何嘉 张远成 杨亚军 刘丹 孟庆飞
唐山市丰润区人民医院骨一科,河北唐山064000
骨质疏松症(osteoporosis,OP)是以骨量骨密度(bone mineral density,BMD)降低,骨组织微结构退化,骨强度下降,骨组织脆性增加,骨折危险性增大为特点的进行性、系统性、全身性骨骼疾病[1]。骨折是其最严重的并发症,严重威胁人们的生命健康。因此,骨质疏松症的及时预防和有效治疗已成为当务之急[2]。目前,临床治疗骨质疏松的药物主要包括激素调节药物、加速骨形成药物、促进骨矿化药物等,这些药物对治疗OP有一定的疗效,但也伴有一定的严重副作用,如长期激素治疗出现的血液高凝状态及诱发子宫内膜癌、乳腺癌等风险[3]。而甲状旁腺素联合降钙素防治OP以其安全、毒副作用小,且可全身整体调节等特点,在治疗上有较大优势,更易于患者接受。因此,本研究探讨甲状旁腺素联合降钙素对去卵巢大鼠骨质疏松的治疗作用,为临床药物治疗OP提供理论依据。
1 材料与方法
1.1 实验材料
SPF级雌性SD大鼠100只,4月龄,体重(360±30)g,订购于北京维通利华实验动物技术有限公司[许可证号:SYXK(京)2017-0033],重组人甲状旁腺激素(1-34)(100μg/支,批号:1708072,美国Sigma公司),鲑降钙素注射液(密盖息)(50 IU/支,批号:1609045,瑞士诺华制药有限公司),Ca、P、碱性磷酸酶(alkaline phosphatase,ALP)试剂盒购于南京建成生物工程公司,7170A全自动生化分析仪购于日本日立公司,双能X线骨密度测定仪购于美国GE公司,MTS-858型生物力学实验机购于美国MA公司,大鼠 ER、血清骨钙素(osteocalcin,OC)、骨保护素(osteoprotegerin,OPG)、RANKL酶联免疫检测试剂盒购于美国R&D公司。
1.2 方法
1.2.1 实验分组及处理:100只雌性SD大鼠按随机数字法分组:假手术组、去势组、甲状旁腺素组、降钙素组、联合用药组。假手术组仅切除部分脂肪组织,去势组、甲状旁腺素组、降钙素组、联合用药组均行双侧卵巢切除术。造模成功后第2天给予药物干预,假手术组、去势组:皮下注射0.9%Nacl,1次/d;甲状旁腺素组:皮下注射 PTH(1-34)50μg/kg,1次/d;降钙素组:皮下注射降钙素5~10 IU/kg,1次/d;联合用药组:皮下 PTH(1-34)50μg/kg,1 次/d,皮下注射降钙素5~10 IU/kg,1次/d。
1.2.2 构建大鼠去卵巢骨质疏松动物模型:10%水合氯醛腹腔麻醉,备皮消毒,取腹背部中线第2腰椎水平做长约2 cm纵行切口,依次分离进入腹腔,沿输卵管寻找粉红色卵巢组织,严密结扎输卵管及其周围血管、脂肪组织,完整切除双侧卵巢,假手术组取出卵巢周围等量脂肪组织,不予切除卵巢,关闭腹腔,逐层间断缝合,术后肌肉注射青霉素[5万U/(kg·d)]3 d,预防感染。
1.2.3 标本取材与处理:给药干预8周后,给予10%水合氯醛腹腔麻醉后,采用快速心脏急性大失血法处死大鼠,取血8~10 mL,高速冷冻离心3 000 r/min,10 min,EP 管收集上层血清 0.5~1 mL,-20℃保存备用,待骨代谢生化指标和标志物检测。逐层剥离L4腰椎和股骨,以无菌生理盐水湿纱布包裹置于-20℃的冰箱保存备用,以行腰椎和股骨骨密度和生物力学检测。另留取股骨10%甲醛溶液固定,10%EDTA 6周,乙醇梯度脱水,二甲苯透明,石蜡包埋,制成5 μm切片,60℃烤箱4 h,取出室温保存备用。
1.2.4 BMD和骨矿物质含量(bone mineral content,BMC)测定:取出待测大鼠 L4腰椎和右股骨,在LUNAR双能X线吸收扫描仪扫测,采用小物体扫描模式,以分辨率1.0 mm×1.0 mm,扫描速度60 mm/s,扫描宽度5.0 cm的参数值,用仪器选定兴趣区,以2.0 mm×2.0 mm为中心区域,检测BMD和BMC值。
1.2.5 大鼠骨生物力学检测:取出右侧股骨,将大鼠股骨置于电子生物力学材料试验机进行三点弯曲力学试验,仪器调试正常后固定骨标本位置,右股骨横切面为准,支点跨距为20 mm,加载速度2 mm/min给予股骨载荷,计算机记录记录仪描记载荷一变形曲线,根据荷载变形曲线得出最大荷载。
1.2.6 血清雌二醇(E2)检测:采用ELISA法检测血清中E2水平,参照试剂盒说明书进行逐步操作。
1.2.7 骨代谢相关生化指标检测:取出上清液,采用7170A全自动生化分析仪检测相关生化指标:血钙(Ca)、血磷(P)、ALP,Ca、P、ALP 检测均采用比色法测定,均按试剂盒说明书步骤操作。
1.2.8 骨代谢标志物检测:取出各组上清液样本,采用ELISA法测定血清OC、OPG、核因子κB受体活化因子(receptor activator of NF-κB,RANK)含量,参照试剂盒说明书进行逐步操作。
1.2.9 HE染色:取出石蜡切片,参照HE染色法实验步骤进行操作[4],光镜下观察染色并采集图片。
1.3 统计学分析
运用SPSS 20.0软件分析,实验数据采用珋x±s表示,统计学分析采用单因素方差分析,组间比较采用SNK法,P<0.05表示差异有统计学意义。
2 结果
2.1 骨组织BMD和BMC
去势组较假手术组腰椎(L4)和股骨BMD和BMC显著降低(P<0.05),甲状旁腺组、雌二醇组、联合用药组均较去势组腰椎(L4)和股骨BMD和BMC均增高,其中尤以联合用药组增高最显著(P<0.05)。见表1。

表1各组大鼠腰椎和股骨的BMD和BMC比较(珋x±s)Table 1 Comparison of BMD and BMC between lumbar vertebrae and femur among the groups(珋x±s)
2.2 骨生物力学
假手术组、去势组、甲状旁腺组、降钙素组、联合用药组最大负荷(N)分别为:203.60±20.50、125.26±12.62、156.35±15.36、160.48±14.25、188.56±18.43。去势组较假手术组股骨最大负荷显著降低(P<0.05),甲状旁腺组、降钙素组、联合用药组均较去势组股骨最大负荷显著增高,其中尤以联合用药组增高最显著(P<0.05)。
2.3 血清雌二醇(E2)
假手术组、去势组、甲状旁腺组、降钙素组、联合用药组血清 E2含量(pg/mL)分别为:75.35±10.30、24.50±8.43、36.80±8.65、43.65±8.50、58.04±9.32。去势组较假手术组股血清E2显著降低(P<0.05),甲状旁腺组、降钙素组、联合用药组均较去势组血清E2显著增高,其中尤以联合用药组增高最显著(P<0.05)。
2.4 骨代谢相关生化指标
去势组血清 Ca、P显著低于假手术组(P<0.05),血清ALP显著高于假手术组(P<0.05),甲状旁腺组、降钙素组、联合用药组血清Ca水平均高于去势组,其中尤以联合用药组增高最显著(P<0.05),甲状旁腺组组、降钙素组、联合用药组较去势组血清ALP均降低,其中尤以联合用药组降低最显著(P<0.05)。见表2。
2.5 骨代谢标志物
去势组血清OC、RANK水平显著高于假手术组(P<0.05),甲状旁腺组、降钙素组、联合用药组较去势组血清OC、RANK水平均降低,其中尤以联合用药组降低最显著(P<0.05)。去势组血清OPG水平显著低于假手术组(P<0.05),甲状旁腺组、降钙素组、联合用药组较去势组血清OPG水平均升高,其中尤以联合用药组升高最显著(P<0.05)。见表3。

表2各组大鼠血清骨代谢生化指标比较(珋x±s)Table 2 Comparison of serum biochemical markers among the groups(珋x±s)
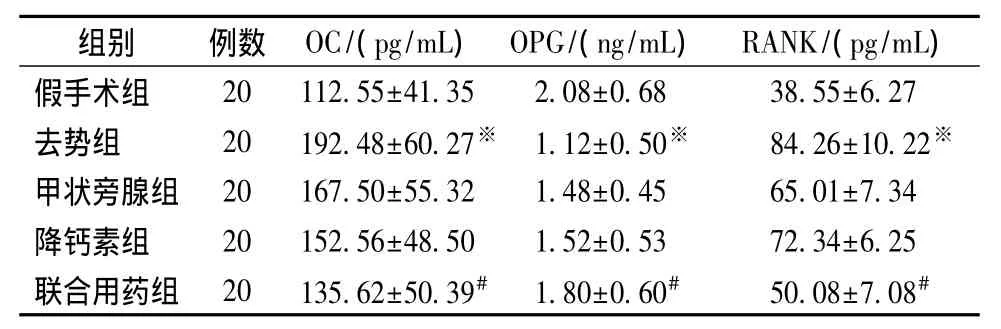
表3各组大鼠血清骨代谢标志物比较(珋x±s)Table 3 Comparison of serum bone metabolism markers among the groups(珋x±s)
2.6 骨组织病理学
假手术组骨组织结构完整,大量成熟骨组织,骨小梁粗细均匀,结构完整,生长旺盛,排列致密有序,互相交错呈网状,成骨细胞形态清晰可见。去势组骨小梁明显减少,排列稀疏错乱,部分出现大片断裂现象,大量纤维组织,骨细胞少见,钙盐沉积明显减少。甲状旁腺组和降钙素组骨组织结构较完整,骨小梁相对完整,骨小梁生长稍稀疏,小梁间有少量断裂,间隙略增大,排列尚规则,成骨细胞相对较少。联合用药组骨组织结构完整,板层结构致密,骨细胞排列整齐,骨小梁致密丰实粗壮,形态结构规整,连续性好,钙盐沉积。见图1。
3 讨论
骨折是OP最严重的并发症,骨质疏松患者一旦发生骨折,生存质量急剧下降,给家庭和社会带来了沉重的经济负担[5]。随着全球人口老龄化的快速进展,骨质疏松症的发病率亦逐年增加。加之老年患者对OP认识度不足,对治疗的依从性差,从而导致临床诊治的困难增加,也加大了骨折的发生率和病残率[6]。因此,如何防治OP和预防其并发症就显得极为重要。
甲状旁腺素(parathyroid hormone,PTH)是由甲状旁腺分泌的骨代谢过程中重要的调节因子,不仅可增加成骨细胞数量,促进骨生长因子释放,增加骨量骨密度,从而促进骨形成,而且可增强破骨细胞活性,促进骨吸收,它在维持骨稳态的过程中发挥着双重调节作用[7]。同时,PTH还可诱导成骨细胞分化,促进胶原合成和骨组织矿化,且可以抑制成骨细胞的凋亡[8-9]。PTH(1-34)是甲状旁腺素中具有活性的氨基酸序列,和PTH具有相同和相似的生物活性和作用机制,可刺激骨形成,增加骨强度,改善骨结构和增加骨量,具有一定的成骨作用[10]。
降钙素是调节骨代谢的重要激素,降钙素通过与破骨细胞的受体结合,不仅能抑制破骨细胞的活性,而且还能阻止它的生成,从而抑制骨组织的自溶和吸收,减少骨骼中钙和骨基质的流失,抑制骨转化[11]。同时降钙素增加骨质矿化,防止骨量丢失,增加骨矿含量,提高骨密度[12]。此外,研究还表明降钙素能作用于成骨细胞,刺激成骨细胞增殖和分化,促进骨小梁的改建,促进骨折愈合[13]。鲑鱼降钙素(salmon calcitonin,sCT)是一种人工合成的生物制剂,对其受体具有很强的亲和力,其活性高,且药效更持久。由于sCT起效迅速,疗效佳,使用方便,不良反应较少,安全性更好。因此,临床普遍用于治疗骨质疏松症等疾病,疗效逐渐被广泛认可。
本研究表明甲状旁腺素联合降钙素通过提高雌激素水平,调节维持骨代谢,提高骨密度和矿物含量,改善生物力学性能,改善骨组织病理形态学,起到抗骨质疏松的疗效和骨保护作用。周芸帆等[14]研究表明PTH(1-34)与降钙素都能显著提高BMD和缓解骨质疏松症状,对于治疗骨质疏松安全有效。刘海蔚等[15]研究表明国产PTH(1-34)联合降钙素能明显增加腰椎 BMD,升高骨转换指标,治疗PMOP安全有效。金成春等[16]研究表明PTH联合sCT治疗老年骨质疏松合并Garden I股骨颈骨折是一种安全、疗效更好的方法。
综上所述,本研究表明甲状旁腺素联合降钙素能减少骨量的丢失,促进骨矿化,提高骨密度,改善骨质量,提高骨的生物力学特性和抗骨折能力,降低骨折的发生率。虽然甲状旁腺素联合降钙素在治疗骨质疏松症起到了很大功效,但仍有许多问题需要解决,如不同的给药方法可引起的完全不同的生物效应,用药的准确疗程,长期用药的耐药性问题,远期并发症及药物具体作用机制等一系列问题限制了药物的长期使用,随着上述问题的解决,甲状旁腺素和降钙素的应用空间将更加广阔。
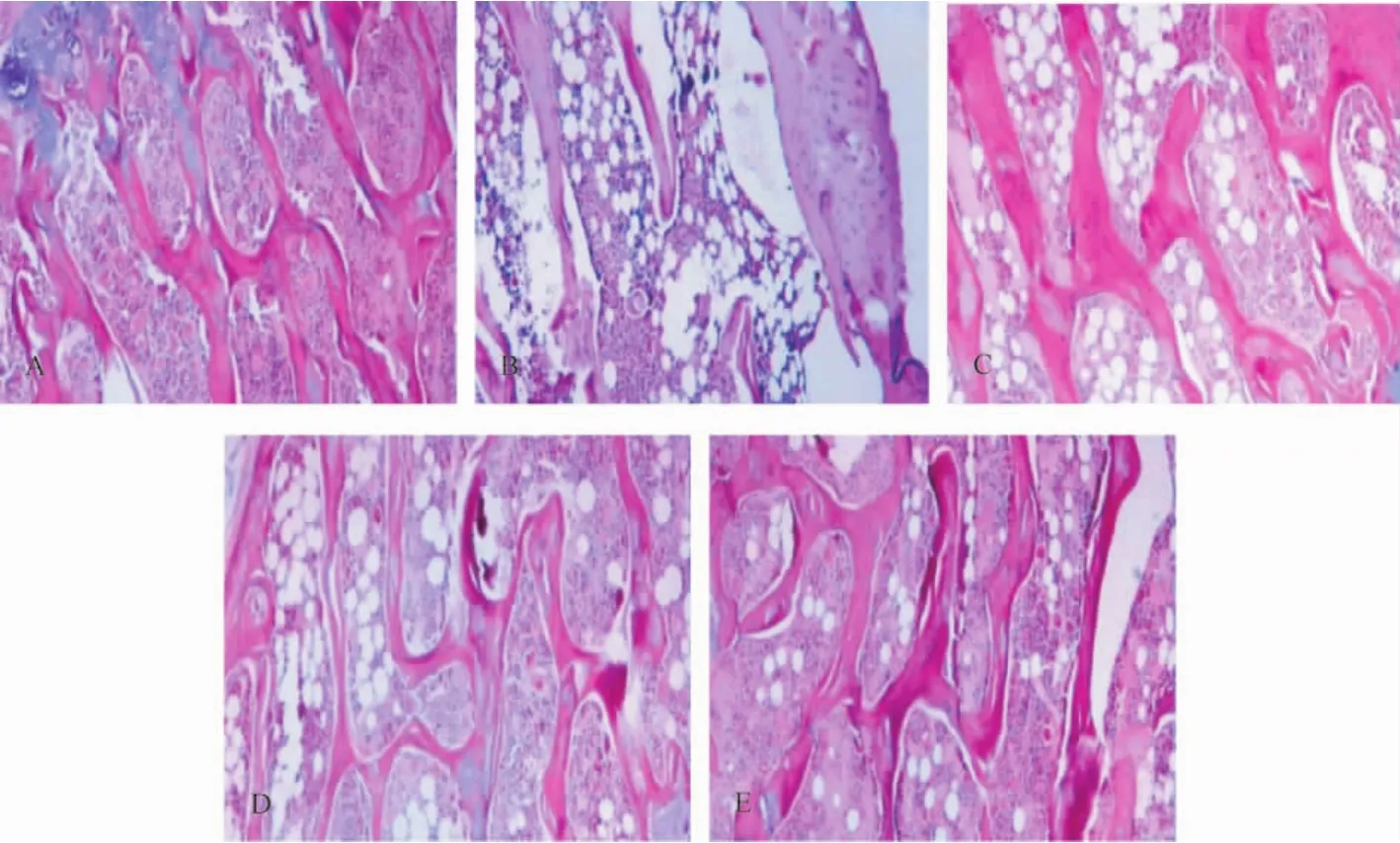
图1HE染色观察骨组织的形态结构变化(×200)A:假手术组;B:去势组;C:甲状旁腺组;D:降钙素组;E:联合用药组。Fig.1 Observation of morphological changes of bone tissue with HE staining(× 200)A:Sham operation group;B:Castration group;C:Parathyroid group;D:Calcitonin group;E:Combination group.
