通过骨基质表面培养板检测RANKL诱导破骨细胞骨侵蚀能力
2020-03-26陈武桂孙靖李松涛杨思振张莹胡旭廖通权初同伟
陈武桂 孙靖 李松涛 杨思振 张莹 胡旭 廖通权 初同伟
陆军军医大学新桥医院骨科,重庆400037
破骨细胞是唯一具有骨吸收活性的多核巨细胞,成熟破骨细胞的鉴定方法主要包括细胞形态观察、破骨相关基因检测、抗酒石酸酸性磷酸酶(TRAP)染色及骨侵蚀试验[1-2]。骨侵蚀试验是证明破骨细胞是否具有溶骨能力的重要试验,以往主要通过对动物颅骨、牛骨、牙槽骨等进行切片、打磨、消毒等多道工序后获得骨磨片,消毒后与破骨细胞共培养然后利用扫描电镜或者甲苯胺蓝染色对骨陷窝进行观察分析[2-4]。破骨细胞在骨磨片上产生的骨陷窝数量及骨陷窝面积,直接反映破骨细胞溶骨能力。但是在实际应用中该方法存在较多局限性:首先,骨材料来源困难,制作要求高(需要硬组织切片机、超声清洗器等),并且即使经过细致打磨后的骨磨片仍可能因骨小梁、骨单位存在厚度不均匀等原因导致破骨细胞黏附不均或粘附性差,影响骨陷窝的形成与进一步观察。其次,骨片上形成的骨陷窝需要借助扫描电镜观察分析,检测方法复杂、费时;在标准图片可见圆形、椭圆形、腊肠形骨陷窝,但是由于骨片平面无法绝对平滑,对形成的骨陷窝常难以进行精确的定量分析。本文拟以RANKL诱导RAW264.7细胞建立破骨细胞分化模型,使用骨基质表面培养板(Corning® Osteo Assay Surface Plate)替代骨磨片行骨陷窝试验检测成熟破骨细胞的溶骨能力,系统介绍其使用及检测方法。
1 材料与方法
1.1 材料
小鼠RAW 264.7细胞(中科院上海细胞典藏库,上海);高糖DMEM培养基(Gibco,US);胎牛血清(Gibco,US);无EDTA胰酶(Gibco,US);核因子kB受体活化因子配体(RANKL)细胞因子(315-11C,PeproTech,US);抗酒石酸酸性磷酸酶(TRAP)染色液(Sigama,Japan);骨基质表面培养板(Corning ® Osteo Assay Surface Plate)(Corning,US);4%多聚甲醛,10%次氯酸钠,1%甲苯胺蓝。
1.2 方法
1.2.1 破骨细胞的培养与传代:用FBS浓度为10%的高糖型DMEM培养基培养RAW 264.7,每1~2天换液1次,待细胞密度至60%~70%左右即可传代,传代比例可为1∶4~1∶6。细胞消化方式:常规换液后添加适量0.25%无EDTA胰酶37%消化5~10 min,用弯嘴吸管均匀、稍用力吹打即可使细胞脱落,避免暴力。破骨细胞培养传代详细方式及注意事项如前所述[5-6]。
1.2.2 破骨细胞的诱导分化:选取状态良好的RAW 264.7细胞以104个/cm2密度接种于细胞培养板,正常培养24 h后添加含不同浓度(0、10、25、50、100 ng/mL)RANKL细胞因子的高糖DMEM完全培养基,每2天换液一次直至5~6 d后肉眼可见明显的多核巨型破骨细胞形成,以抗酒石酸酸性磷酸酶(TRAP)染色检测破骨细胞形成情况。
1.2.3 抗酒石酸酸性磷酸酶(TRAP)染色:破骨细胞诱导结束后换液,用PBS冲洗2次后以4%多聚甲醛固定15 min,PBS漂洗3次后添加足量抗酒石酸酸性磷酸酶(TRAP)染色液,染色液配置方法参照试剂说明书,37℃避光孵育1 h后以自来水冲洗,干燥后倒置显微镜下拍照观察破骨细胞形成情况。
1.2.4 骨基质表面培养板(Corning® Osteo Assay Surface Plate)的使用方法:本实验采用24孔骨基质表面培养板(Corning® Osteo Assay Surface Plate),其具体使用方式可参照说明书。简要介绍如下:破骨前体细胞接种,诱导方式如前。细胞诱导结束后,PBS漂洗3次,可轻柔吹去部分细胞,添加400 μL/孔10%次氯酸钠溶液室温浸泡5~10 min以洗脱黏附细胞,超纯水清洗2~3次,可稍用力吹去细胞;1%甲苯胺蓝200 μL/孔染色2~4 min,超纯水清洗3次至液体清亮,吸干,晾干3~5 min。在普通倒置光学显微镜下观察,可见圆形侵蚀空白,侵蚀区域呈淡紫色,部分未洗脱细胞呈紫色,照相后可用Image J软件对侵蚀面积进行量化分析。
1.2.5 ImageJ软件对侵蚀面积进行量化分析:打开图片后将图片转换8-bit,并调高图片对比度使侵蚀圆环轮廓更明显(图1 A,图1B);使用魔棒工具逐一圈出所有侵蚀轮廓,并删除(Backspace)圈内颜色使轮廓更明显(图 1C);使用 Image→adjust→threshold圈定所有侵蚀轮廓(图1D,图1E),必要时可再次调整亮度及对比度,根据图片比例设定标尺。
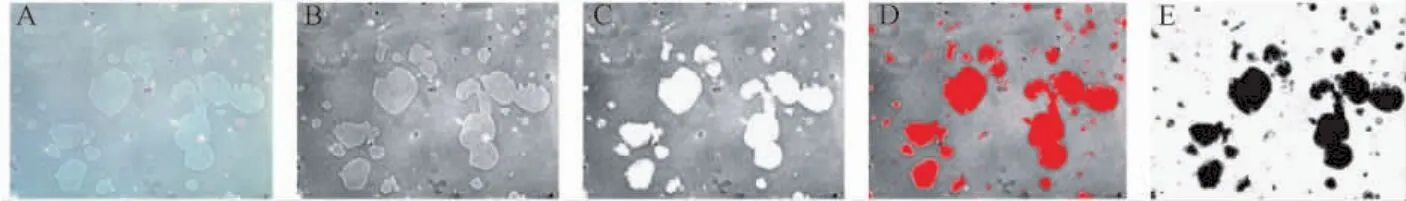
图1 ImageJ软件对侵蚀面积进行量化分析步骤详解Fig.1 Detailed analysis of the erosion area by ImageJ software
1.3 统计学方法
使用SPSS 20.0统计软件对资料进行统计学分析,实验数据采用(珋x±s)表示,用t检验判断其差异显著性,组间比较采用方差分析,P<0.05表明差异具有统计学意义。
2 结果
小鼠RAW264.7细胞经不同浓度的RANKL细胞因子诱导分化5 d后,行TRAP染色,结果如图2 A所示,随着RANKL因子浓度的增加,生成的成熟破骨细胞(呈酒红色,不规则圆形,细胞核数目≥3)数目逐渐增加,但在50 ng/mL及100 ng/mL浓度下破骨细胞的生成数量未见明显差别,100 ng/mL浓度下破骨细胞融合面积更大。对成熟破骨细胞数量进行定量分析时发现(图2C),单位面积内成熟破骨细胞的生成数量随RANKL浓度进行性增加,在50 ng/mL浓度下达到巅峰,但各浓度间的成熟破骨细胞的数量差异并不显著,在100 ng/mL浓度下数量甚至还有所下降。
与TRAP染色结果一致,随着RANKL因子浓度的增加,成熟破骨细胞在骨基质表面培养板上侵蚀的空白面积显著增加,呈不规则圆形,在最低浓度(10 ng/mL)下亦可见少量的骨侵蚀形成(图2B),而对照组(0 ng/mL)未见骨侵蚀形成。通过Image J软件对骨侵蚀面积进行定量分析(图2D),结果表明随着RANKL浓度的增加,骨侵蚀面积明显增加、增大,具有显著差异,分析结果与TRAP染色结果(图2 A,图2C)及肉眼下观察骨侵蚀形成情况一致,且更加直观、真实地反映了破骨细胞生成情况。

图2 TRAP染色及骨基质表面培养板检测破骨细胞形成与骨侵蚀能力Fig.2 Osteoclast formation and bone erosion were detected by TRAP staining and osteo assay surface plate
3 讨论
骨骼系统的稳定与功能依赖于破骨细胞介导的骨吸收与成骨细胞介导的骨形成构建的动态耦合平衡,亦称为骨重塑。在多种骨骼疾病如骨质疏松、肿瘤骨转移、关节炎、强直性脊柱炎等发病机制中,由于破骨细胞异常激活引起的骨吸收异常增强是重要机制之一,因此破骨细胞分化的机制被广泛研究,并取得了极大进展[7-10]。建立破骨细胞分化模型是研究破骨细胞分化机制的必要流程。因为破骨细胞为高代谢终末分化细胞,存在体内细胞数量少、难以分离获取、无法传代、生存时间短等特点,因此永生化破骨细胞系无法稳定存在。目前破骨细胞的体外培养方法包括原代培养和诱导法[11-12]。原代培养即在无菌环境通过机械分离动物四肢长骨,冲洗骨髓并收集并纯化获得破骨细胞,但存在取材困难、细胞量少、杂质多等缺点。诱导法即通过获取、培养、诱导包括从人或动物骨髓、脾脏、外周血等获得的原代单核细胞,或者诱导成熟的破骨前体细胞株如RAW264.7、FDCP、HL-60、THP-1 等,最终获得较稳定的成熟破骨细胞。通过原代细胞培养诱导破骨细胞虽然较贴近活体情况,但是存在取材困难、细胞量少、重复性差等缺点,而通过细胞株构建破骨细胞分化模型则不存在这些问题。其中使用RANKL诱导RAW264.7细胞分化为成熟破骨细胞是体外研究破骨细胞诱导分化的经典模型之一,在骨骼系统疾病、骨代谢等研究中广泛应用[5,11,13]。
RAW264.7细胞株来源于Abelson小鼠白血病病毒所致的肿瘤,是小鼠源性破骨细胞前体细胞,代表破骨细胞分化的早期阶段。相比于原代培养方式,该方法具有以下显著优点:首先,RAW264.7细胞生长迅速,容易培养,可获得大量均一性细胞,显著降低了破骨细胞培养的技术难度。其次,这种诱导方法方法成熟,已在大量研究中得到验证,获得的破骨细胞数目比其他分离、纯化等方法更多,且均一性好,并且具备破骨细胞吸收骨质、形成骨吸收陷窝的特性,便于开展后续针对破骨细胞的研究。但在实际实验中,破骨细胞的培养、诱导、鉴定等仍存在细节要求,给初学者成功培养、诱导破骨细胞带来一定困难,在近期诸多文献中也予以了详细介绍[5,6,11,13]。
目前成熟破骨细胞的鉴定方法主要包括细胞形态观察、破骨相关基因检测、抗酒石酸酸性磷酸酶(TRAP)染色及骨侵蚀试验[1-2],但均存在一定局限性。比如检测破骨细胞表型标志基因抗酒石酸酸性磷酸酶 (tartrate resistantacid phosphatase,TRAP)、金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、降钙素受体(calcitonin receptor,CTR)等,虽然可一定程度反映破骨细胞分化程度,但基因表达具有时限性,与破骨细胞分化时期密切相关。而抗酒石酸酸性磷酸酶(TRAP)染色虽然可有效鉴定成熟破骨细胞,但正如本次研究的观测结果,在高浓度RANKL因子刺激下,成熟破骨细胞晚期可相互融合,以成熟破骨细胞数量(细胞呈酒红色,形状呈不规则圆形,细胞核数目≥3)反映破骨细胞分化程度并不精确。以骨磨片行骨侵蚀实验是目前验证破骨细胞是否具备溶骨能力的主要实验,其局限性已在前文阐述。本文详细介绍了一种以骨基质表面培养板替代骨磨片鉴定成熟破骨细胞溶骨能力的方法。骨基质表面培养板是一种在表面铺设骨基质凝胶的商品化培养板,表面较光滑,各孔间差异性小,具有均一性,可有效模拟骨表面特性。在与不同浓度RANKL因子诱导的破骨细胞共培养后,可形成与破骨细胞分化程度一致的不规则侵蚀圆环,结果直观。并且便于利用图像分析软件进行分析,以侵蚀面积反映破骨细胞分化程度,数据具有客观性。该方法较传统的检测方法(骨磨片检测),具有操作简便、检测方法简单、性价比高、便于统计分析等优点,在破骨细胞研究中具有广泛的应用价值。
