萎胃康治疗大鼠慢性萎缩性胃炎的Akt-Mdm2-P53机制
2020-03-25宋汉娜于佳宁吕俊慧陈露林海燕
宋汉娜 于佳宁 吕俊慧 陈露 林海燕
(1滨州医学院,山东 烟台 264003;2滨州医学院烟台附属医院)
慢性萎缩性胃炎(CAG)是临床常见病、多发病,且有一定的癌变倾向。CAG常伴胃腺体萎缩、胃黏膜变薄,黏膜基层增厚或伴幽门腺化生和肠腺化生,是检测转变癌前病变的一个重要指标〔1〕。CAG归属于中医学“胃脘痛”“痞满”“嘈杂”等范畴。本研究所采用的萎胃康颗粒是以益气养阴活血法立意组方的中药制剂。萎胃康颗粒治疗慢性萎缩性胃炎疗效优于维酶素,无明显副作用,是治疗CAG的良药。本实验通过测定蛋白激酶B(Akt)-鼠双微基因(Mdm)2-P53信号通路上Akt、Mdm2、P53蛋白的表达研究萎胃康治疗CAG的可能机制。
1 材料与方法
1.1动物 健康雄性SD大鼠60只,6周龄,体重(120±20)g,由山东济南朋悦实验动物繁育有限公司提供。
1.2药物与试剂 萎胃康颗粒由西洋参、白术、白芍、延胡索、三七、熊胆、延胡索、甘草等七味药物组成。由滨州医学院附属医院制剂室提供。水杨酸钠(批号:20181107)由北京Solarbio提供;维酶素片配成3 g/(kg·d)浓度的水溶液;兔抗Akt(批号:10176-2-AP)由美国proteintech公司提供;兔抗Mdm2(批号:AF0208)由Affinity公司提供;兔抗P53(批号:AF0979)为Affinity公司产品;抗鼠/兔通用型免疫组化试剂盒由proteintech公司提供。
1.3动物分组及造模 健康雄性SD大鼠60只,按随机数字表分为空白组、模型组、萎胃康高、中、低剂量组、西药组各10只。模型组和药物组按传统造模方式〔2〕造模:以2%水杨酸钠2 ml每天灌胃,前3 w正常饮食,后3 w单日禁食,双日足量进食,结合饥饿饱餐因素,共6 w成模。6 w后从空白组随机抽取1只,造模各组各随机抽取1只,做苏木素-伊红(HE)染色,观察胃黏膜组织形态变化,检测造模是否成功。经病理确认造模成功后2 d开始灌胃治疗。
1.4给药方法 药物组按萎胃康高剂量组〔3.00 g/(kg·d)〕、萎胃康中剂量组〔1.50 g/(kg·d)〕、萎胃康低剂量组〔0.75 g/(kg·d)〕分别灌胃给予不同浓度的萎胃康颗粒水溶液,空白组、模型组分别灌胃等量的生理盐水,西药组灌胃维酶素混悬液0.3 g/(kg·d),1次/d,共30 d。固体饲料和水自由摄取。
1.5取材及标本制备 在给药30 d后,禁食24 h,2%戊巴比妥钠45 mg/kg腹腔麻醉,打开腹腔,取全胃,沿胃大弯剪开,肉眼观察整个胃的变化并拍照。后取胃窦部,切成两部分,一部分4%多聚甲醛浸润固定12 h以上,梯度酒精脱水,二甲苯透明,浸蜡后,石蜡包埋。
1.6检测指标 切片机上行厚度为5 μm连续冠状切片4张,1张做HE染色,3张做免疫组化检测。光镜下观察各组胃黏膜的病理变化;免疫组化法检测各组胃黏膜Akt、Mdm2、P53蛋白的表达量,具体实验步骤参照说明书进行。实验结果用积分光密度(IOD)表示:400倍高倍镜下,每张切片按同样的光度随机取5个视野,用Ipwin32图片分析软件测定IOD,5个视野的IOD平均值即为该张切片的蛋白表达量。
1.7统计学分析 采用SPSS20.0软件进行正态性及方差齐性检验、t检验、单因素方差分析。
2 结 果
2.1各组胃黏膜光镜下观察 正常组胃黏膜排列规则,胃黏膜厚,未发现腺体萎缩,模型组胃黏膜较薄,排列紊乱、稀疏,腺体萎缩,数目减少。治疗后,其他治疗组较模型组相比,腺体萎缩状况都好转,且萎胃康高剂量组恢复最明显。
2.2萎胃康对CAG胃黏膜Akt和Mdm2蛋白表达的影响 与空白组相比,模型组Akt和Mdm2的表达明显增加(P<0.05)。与模型组相比,其余治疗组Akt和Mdm2表达明显增加(P<0.05);与萎胃康高剂量组相比,其余治疗组Akt和Mdm2表达明显增加(P<0.05)。见图1、2,表1。
2.3萎胃康对胃黏膜P53蛋白表达的影响 与空白组比较,模型组胃黏膜P53表达显著下降(P<0.05);与模型组相比,各治疗组胃黏膜P53表达显著升高(P<0.05),其中萎胃康高剂量组p53表达升高最明显,与其他治疗组具有显著性差异(P<0.05)。见图3,表1。

图1 各组胃黏膜Akt蛋白的表达(HE,×400)
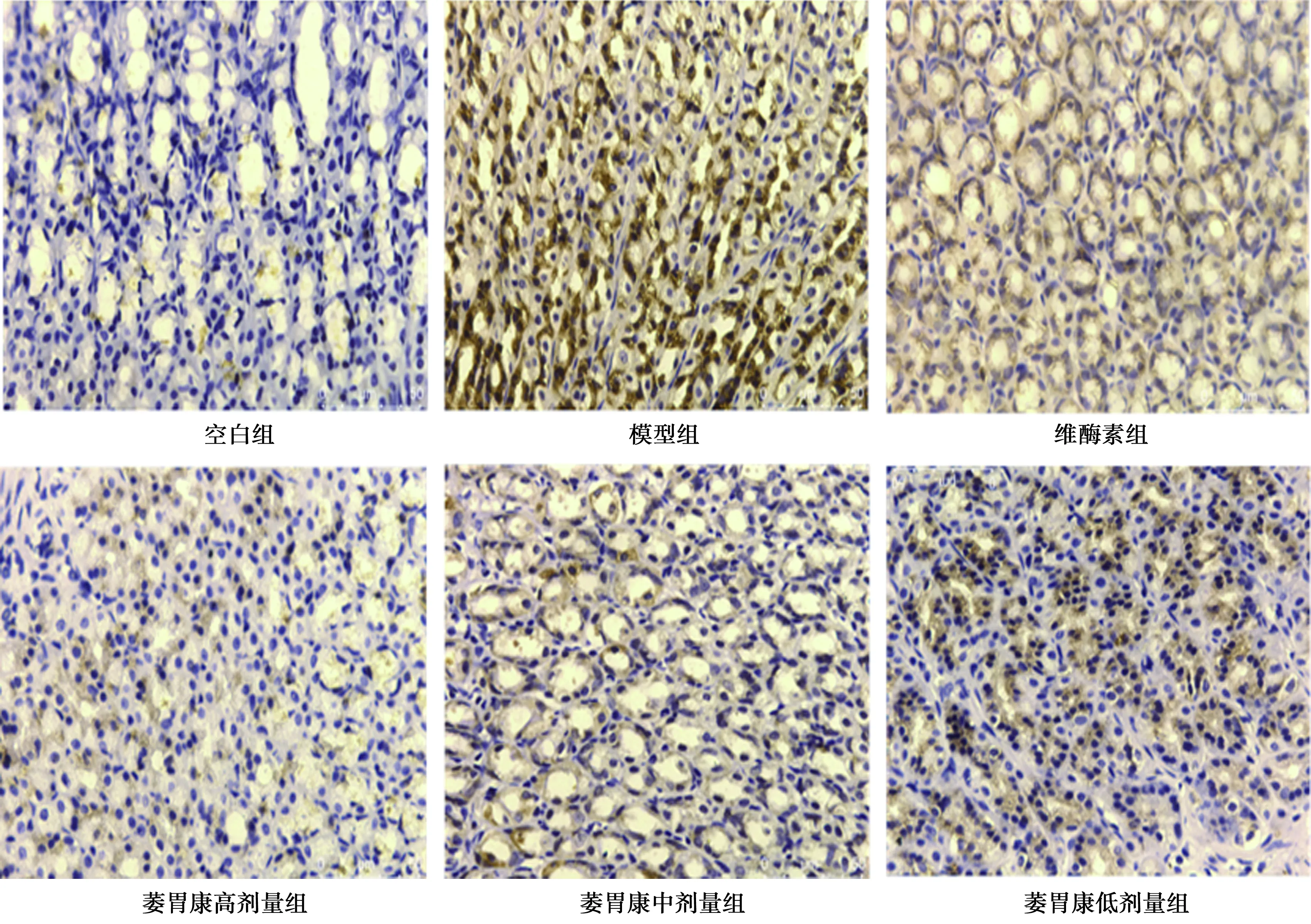
图2 各组胃黏膜Mdm2蛋白的表达(HE,×400)
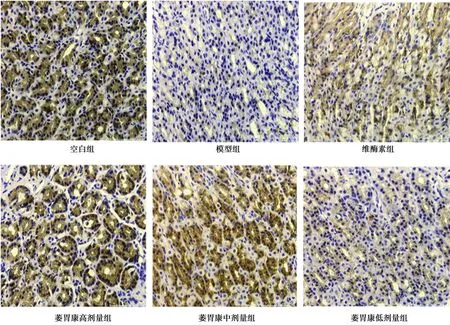
图3 各组胃黏膜P53蛋白的表达(HE,×400)

表1 各组胃黏膜Akt、Mdm2和P53表达的比较
与模型组相比:1)P<0.05;与高剂量组相比:2)P<0.05
3 讨 论
CAG常表现为上腹部隐痛、胀满、嗳气、食欲不振或消瘦、贫血等,无特异性〔3〕。CAG是多阶段胃癌发生过程的中枢阶段,因此了解其发生机制非常重要〔4〕。研究提出,CAG的主要原因是幽门螺杆菌感染〔5〕。CAG的病理表现是胃黏膜腺体的减少,胃肠上皮细胞的数量由细胞增殖和细胞凋亡平衡维持〔6〕。
胃是水谷气血之海,主腐熟水谷,胃气具有向下运动以维持胃肠道通降下行的特性,有喜润而恶燥的生理特性。寒湿或燥邪易导致食欲不振,出现胃脘痛、不思饮食、胃脘食滞等症状。中医学认为引起CAG的病因是多种多样的,多由侵袭邪气或饮食不调,劳倦太过及情志内伤等导致中焦受阻,胃气失和,脾气虚弱不和,损伤肝气,肝郁气滞,胃失和降,胆汁反流入胃;或禀赋脾胃虚弱,不能治愈,就容易损伤络脉,出现瘀血。CAG治疗应采取益气养阴活血法。本研究所采用的萎胃康颗粒是以益气养阴活血法立意组方的中药制剂。方中西洋参甘微苦,性凉,补气养阴,清热生津,属于气阴双补药,西洋参能益脾气,滋脾阴,常用于脾气阴两虚之纳呆食滞,口渴思饮,为方中君药。白术甘苦,性温,能益气健脾、燥湿利水,白术主归脾胃,以健脾、燥湿为主要作用,被誉为“脾脏补气健脾第一要药”,长于补气以复脾运。白芍苦酸,性微寒,养血敛阴,还有止痛作用,可缓解胃脘疼痛。白术和白芍共为臣药。延胡索活血行气止痛,配白术和白芍可治中虚胃痛,三七具有化瘀止血,消肿定痛之功,可化胃络瘀血和止痛,具有治疗胃黏膜的萎缩性病变,预防肿瘤的药理作用。熊胆可清热解毒,清肝明目,治疗胃炎等消化系统疾病。延胡索、三七、熊胆共为佐药。甘草味甘,性平,能缓能和,调和诸药而为使药。
CAG是由多种原因引起的胃黏膜慢性炎症性病变,发病过程中胃黏膜损害是主要的病理症结。在细胞凋亡和增殖的调控中,Akt-Mdm2-P53信号通路发挥着重要作用。Akt是细胞内重要的信号通路,研究显示,Akt以多种机制引起肿瘤的发生〔7〕。研究发现,Akt引起的肿瘤发生机制不仅是磷酸化,还可以解释为Akt基因的增殖过度表达〔8〕。Akt信号通路是细胞内的经典信号通路,以多种机制引起肿瘤发生。多种癌细胞(包括胃癌细胞)的恶性肿瘤化过程与Akt信号系统的异常活动增加有关〔9,10〕。Akt会磷酸化P53的抑制因子Mdm2,促进Mdm2向核移动,从而破坏P53的功能〔11〕。因此,Akt促进肿瘤形成的作用是通过其在细胞质内的位置来解释的。Mdm2是一种癌基因,可在多种类型的肿瘤中过表达。Mdm2的表达与胃癌的发生发展有密切关系〔12〕。研究发现,胃癌组织进行免疫组化分析显示胃癌组表现Mdm2蛋白阳性检出率为29.31%(17/58),癌旁组织mdm2蛋白染色均为阴性,Mdm2蛋白过表达与胃癌发生有关〔13〕。Mdm2对P53蛋白的增殖、凋亡和活性化起到重要作用。Mdm2被称为P53的主调节器。Mdm2是P53的催化剂,影响P53的生成、消失和功能。Mdm2基因有两个催化剂,称为P1和P2。细胞中活动的P53蛋白与Mdm2 p2催化剂附近的P53-响应元件(RE)结合,会诱发P2催化剂的转录活动〔14〕。当P53过度表达时,Mdm2蛋白与P53结合,阻断转录作用的功能,对P53起拮抗作用,并通过促进P53蛋白促进降解,从而使P53的浓度保持不变〔15〕。P53是一种抑癌基因,可促进细胞凋亡,参与细胞生长衰老,并在基因受损时发挥重要作用〔16〕。当基因受损或激活肿瘤基因时,P53肿瘤抑制基因被激活,促进蛋白转录,并阻止细胞周期,修复受损基因,如果不能修复,就会消失〔17〕。在胃癌的分子生物学发生过程中,P53基因的消失、改变或功能的丧失起着相对重要的作用。超过60%的胃癌中发现P53基因的等位基因丢失,并且发现突变率在30%~50%〔18〕。研究表示,胃癌细胞系中正常P53基因的转导可以降低肿瘤生长速度〔19〕,提示p53基因治疗可以作为抗肿瘤治疗方法。
本研究显示,萎胃康能明显改善大鼠胃黏膜萎缩的病理改变。Akt、Mdm2和P53蛋白对癌细胞生存起到重要的作用。CAG中Akt、Mdm2和P53的增加和降低是相互关联的。在大鼠模型中Akt-Mdm2-P53信号通路诱发CAG癌前病变。因此,Akt、Mdm2和P53的细胞增殖和凋亡功能可能与CAG癌前病变有关。萎胃康治疗CAG的机制可能与降低胃黏膜Akt、Mdm2蛋白表达和升高P53蛋白表达有关。
