血清骨膜素水平与老年髋部骨折患者骨密度相关性研究
2020-03-25李江华李新梅陈磊戴毅李琪
李江华 李新梅 陈磊 戴毅 李琪
1.石河子大学医学院第一附属医院骨科,新疆 石河子 832000 2.石河子大学医学院第一附属医院医务处,新疆 石河子 832000
骨膜素(sPostn)是具有诱导成骨细胞分化的粘附蛋白,由于在骨膜中的高表达而得名[1]。骨损伤后显著表达,特别是出现骨折后[2],且对机械和激素刺激很敏感。它可以在许多涉及损伤的病例中检测到,例如牙周韧带、梗死心肌、血管、骨骼肌损伤和皮肤伤口愈合。在骨组织中,骨膜素具有调控骨髓间充质干细胞的粘附和聚集,以促进骨修复和骨重建[3]。进一步研究表明骨膜素在骨骼的发育、骨重塑和维持骨骼强度起到重要的作用[4-5],因此骨膜素被提出作为具有价值功能的细胞外基质的组分。老年人髋部骨折常常伴随不良的并发症,包括残疾、死亡率和独立生活能力的丧失[6-7]。确定危险因素和监测促进骨折愈合的干预因素变得极为迫切。骨愈合可以通过直接或间接修复形成,即膜内骨化或软骨内骨形成,其模仿早期发育过程[8]。在实验性啮齿动物长骨骨折模型中,骨膜素基因在骨折组织中上调[2]。骨膜素对代谢性骨病的重要性因其对骨生长的影响而变得明显。此外,高水平的骨膜素与绝经后妇女的骨折风险显著相关,但是与骨密度(bone mineral density,BMD)和既往骨折无关[9]。据推测,急性髋部骨折与老年妇女骨膜素水平的短暂变化相关,并且在骨愈合阶段时间测量骨膜素可能包括评估对骨折治疗的反应。本研究的目的是研究血清骨膜素水平与骨质流失之间的关系,探讨影响骨修复的因素,并评估骨膜素作为监测骨折愈合的影响工具的可能性。
1 材料和方法
1.1 一般临床资料
本研究选取2015年1月至2017年6月在石河子大学医学院第一附属医院骨科就诊的65岁及其以上女性急性骨质疏松性髋部骨折患者作为研究对象,且所有患者均在低能量下出现骨折。排除标准是病理性骨折或高能量创伤性骨折。所有病例都有一般临床资料,人体测量资料和临床合并症、并发症、实验室数据,以及在到达急诊室后48 h内过夜禁食后测量的骨膜素水平。108例患者随访1年,在髋部骨折后第2、7、30、90、180和365天检测到一系列骨膜素和骨代谢指标水平。另外106名与年龄相匹配、无痴呆、低能量骨折和中风病史的女性从门诊作为对照组招募。如果她们有低能量骨折的存在或病史或无法提供知情同意,则排除这些老年人。这些受试者具有一般临床资料、人体测量资料和临床合并症、并发症、实验室数据和测量的骨膜素水平。在这两组中排除了可能影响骨代谢的疾病患者,如转移性骨癌、原发性甲状旁腺功能亢进症、甲状腺功能亢进症、多发性骨髓瘤、骨软化症、肾功能不全和佩吉特病、或药物补充剂。所有患者在随访期间均未接受抗骨质疏松治疗。
1.2 生化指标检测
在骨折患者中,在到达急诊室后48 h内在禁食过夜后的7:00至9:00进行血液样本,还从对照中获得空腹静脉血样。将样品立即离心并储存在-80 ℃直至检测。随访和对照患者的血液样本也获得非禁食。通过全自动测量I型胶原(PINP,骨形成标志物)的血清N-末端前胶原和I型胶原的β-异构化羧基-端肽(β-CTX,骨吸收标志物)。电化学发光系统(Cobas 6000 Analyzer,Roche Diagnostics Co,LTD. Germany)。最小检测限PINP和β-CTX分别为5 ng/mL和0.01 ng/mL。PINP的内部和实验间系数分别为5.0%和5.0%,β-CTX分别为2.7%和3.8%。使用ELISA试剂盒(USCN Life Science,Wuhan,China)测定骨膜素,其中内部和实验间系数(CV)分别<10%和<12%。所有实验室评估均在骨折后2 d内进行,随后在骨折后的第7、30、90、180和365天进行。
1.3 骨密度测量
在骨折后1周内测量BMD的测量值,通过双能X线吸收测定法(DXA,GE Lunar,Madison,WI,USA)测量腰椎(L1-L4)和股骨颈的BMD。对于髋部骨折患者,未受影响的一侧用于测量BMD。在本研究机构的每个站点,BMD的分析间内和分析内CV均<3%。在进行骨密度扫描后同时测量体质量和身高。
1.4 统计学分析
对于连续变量,两组之间的平均值通过正态分布变量的独立样本t检验和偏斜变量的Mann-WhitneyU检验进行比较。使用卡方检验比较分类变量数据。使用协方差(ANCOVA)或Mann-WhitneyU检验测试1年内骨膜素浓度变化的统计学显著性。计算Pearson相关系数以评估连续结果变量之间的相关性并评估这些变量变化之间的关联。为了评估多重比较的潜在影响和多重共线性现象的重要性,使用多个线性回归模型评估骨膜素和BMD值与骨标记估计量的关联,根据绝经年龄和时间进行调整。逐步方法用于计算R2的值。使用SPSS 19.0软件进行所有统计学分析。P<0.05表示差异有统计学意义。
2 结果
表1列出了急性髋部骨折患者和对照组的人口统计学、临床特征、实验室和DXA数据。在108例髋部骨折患者中,所有患者均签署了书面知情同意书,88例完成(81.5%)随访。1年随访期间,其他20人被排除在所有分析之外。在20名参与者中,4名失访,3名出现严重并发症,7名延迟愈合或不愈合,6名死亡。正如两组匹配设计所预期的那样,两组患者的年龄和绝经时间没有差异(P>0.05)。两组患者的骨膜素水平比较差异有统计学意义(P<0.05),腰椎和股骨颈BMD较对照组低(P<0.05);而体质量指数(body mass index,BMI)、估计的肾小球滤过率(estimated glomerular filtration rate,eGFR)和合并症没有显著差异(P>0.05)。髋部骨折患者血清β-CTX和PINP水平高于对照组,差异有统计学意义(P<0.05)(表1)。
在研究人群中,骨膜素的初始水平与β-CTX和PINP呈正相关,与股骨颈的BMD呈负相关(表2)。在患者中观察到类似的趋势,但在对照中未观察到。未发现年龄、绝经时间、BMI和eGFR有显著相关性。使用多元线性回归分析,发现骨膜素是股骨颈BMD的独立预测因子,这解释了19.1%的BMD变异。在进行所有进一步调整后,这种关联仍然显著(表3)。然而,在腰椎BMD的独立预测因子中未观察到这样的结果(表3)。正如预期的那样,β-CTX与股骨颈BMD之间存在强烈的负相关,并且在所有调整后仍可预测骨密度方差的21.8%。与骨膜素不同,β-CTX与腰椎BMD存在显著负相关,预测BMD方差的35.3%变化(表3)。在另一个回归模型中,使用骨膜素作为因变量,独立决定因素是β-CTX,而年龄、绝经时间、BMI和PINP未发现是所有人群和髋部骨折患者的独立混杂因素。
在髋部骨折后第2、7、30、90、180和365天检测骨膜素、β-CTX和PINP,见图1。骨膜素、β-CTX和PINP在骨折第7天时最高,随后下降到稍高于术后第2天水平。

表1 病例组和对照组的基线特征 Table 1 Baseline characteristics of cases and controls
表2所有女性骨折和骨膜素潜在危险因素之间的相关性
Table2Correlation between potential risk factors for fractures and sPostn in all women
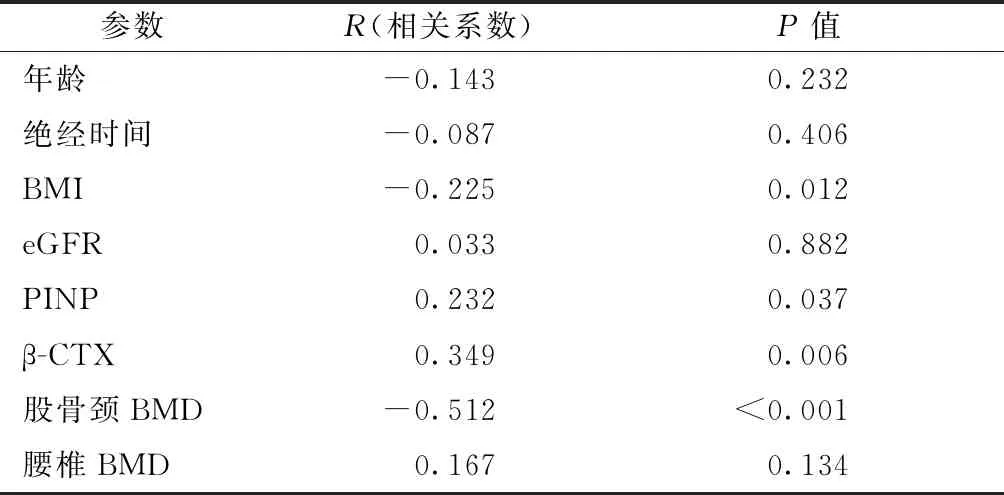
参数R(相关系数)P值年龄-0.1430.232绝经时间-0.0870.406BMI-0.2250.012eGFR0.0330.882PINP0.2320.037β-CTX0.3490.006股骨颈BMD-0.512<0.001腰椎BMD0.1670.134
表3多元线性回归分析以确定与髋部骨折患者的股骨颈BMD和腰椎BMD值相关的独立变量
Table3Multiple linear regression analyses to determine the independent variables associated with femoral neck BMD and lumbar spine BMD values in hip fracture patients
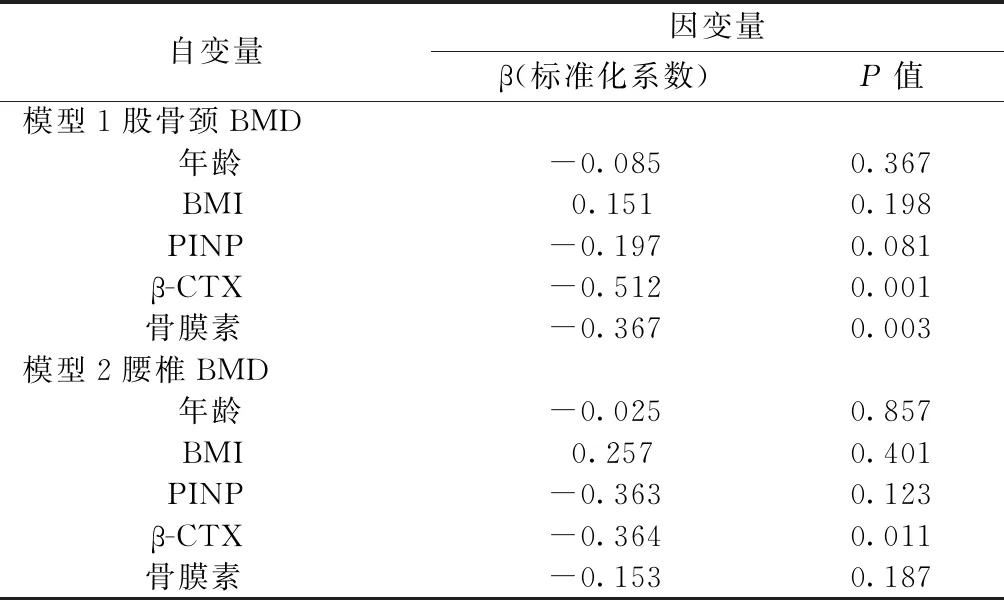
自变量因变量β(标准化系数)P值模型1股骨颈BMD年龄-0.0850.367BMI0.1510.198PINP-0.1970.081β-CTX-0.5120.001骨膜素-0.3670.003模型2腰椎BMD年龄-0.0250.857BMI0.2570.401PINP-0.3630.123β-CTX-0.3640.011 骨膜素-0.1530.187

图1 不同时间点骨膜素、PINP 和β-CTX水平Fig.1 Levels of periostin, PINP, and beta-CTX at different time points注:和骨折2 d时间点比较,*P<0.05。
3 讨论
本研究中对65岁或以上骨质疏松性髋部骨折和匹配对照的绝经后妇女的骨膜素分布进行描述,调查了骨膜素在这一特定人群中365 d的初始和长期影响。本研究证明了第一次增加的骨膜素水平是股骨颈BMD损失的独立预测因子,骨形成标志物(PINP)和骨重吸收标志物(β-CTX)在骨折早期愈合阶段明显增加。这表明骨形成和再吸收之间的相对不平衡与脆性髋部骨折后的高骨膜素水平相关,这反映了愈合过程中早期的骨膜内成骨[10]。骨膜素是机械因素对骨皮密度和骨修复影响的重要因子[11]。本研究发现老年女性髋部骨折的骨膜素水平显著高于年龄匹配的对照组。相比之下,低骨量女性骨膜素水平没有差异,且与BMD无关[12]。本研究表明骨膜素的水平在骨折后早期持续增加,并且在髋部骨折后1年内仍保持高水平,这表明骨膜素的释放不仅取决于髋部骨折本身,还取决于骨质疏松症的存在,同时作为骨质疏松性骨折的新调节因子,骨膜素可能反映了骨膜细胞代谢活动对骨折的适应性,从而使骨质修复得以加速。
骨愈合过程主要由骨膜决定,骨膜作为软骨细胞和成骨细胞的前体细胞的一种基质来源。骨膜素由成骨细胞和软骨细胞合成。此外,与不完全性骨折相比,骨膜素基因在1周内在硬骨痂中上调,随后在骨折中上调[10]。同样,本研究中髋部骨折后骨膜素的水平提高也是如此。在骨折修复过程中骨膜素的这种增加表达将通过更高的骨膜素水平反映在血清中。这些结果表明,骨膜素涉及骨折修复的双线性事件,在骨祖细胞募集到骨折组织期间以及骨发育和重塑的早期阶段。虽然骨膜素优先在胚胎发生过程中在新生儿的骨膜中表达,但它也可能在骨折愈合和骨修复过程中在骨形成中发挥核心作用[13]。在骨折修复期间的骨损伤部位,重新表达的骨膜素有助于促进骨形成的增加,这可以通过在不同时间点血清中循环骨膜素水平的增加来反映。了解各种骨质疏松症药物如何影响骨折愈合对骨质疏松症患者的治疗至关重要[14]。
以前的研究表明,合成代谢剂和抗吸收药物都不会干扰骨折愈合,甚至可能导致更强大的生物力学特性[14]。通过机械刺激骨骼,骨膜素水平可能会反映骨折愈合的预后并监测治疗过程。本研究表明更高的骨膜素水平是股骨颈BMD的独立预测因子,而不是腰椎的BMD。这种关联可以通过骨膜中骨膜素的主要表达来解释,骨膜主要覆盖长骨。然而,骨膜素和BMD之间的关联在其他研究中存在争议[15]。在笔者看来,骨膜附着部分弥补了绝经后的皮质内骨质流失。随着骨质流失的进展,皮质变薄,而机械应变由于微结构不良而增加,导致骨膜素表达增加以补偿骨脆性,从而增加骨折风险。因此,可以认为绝经后妇女骨质疏松性髋部骨折合成的骨膜素数量也可能增加。本研究结果和以前的研究一致表明,这种蛋白质可能是长骨中骨质疏松症骨折的更好的潜在生物标志物,特别是在髋部区域[12]。
本研究存在许多局限性。没有考虑骨折固定后骨折愈合,身体活动变化和康复锻炼对骨膜素的影响。除骨折分类外,髋部骨折部位、骨折后出血年龄和手术本身可能影响骨转换标志物的表达[30]。骨折组内固定设备的应用及固定的时间也会影响骨代谢指标。骨膜素的浓度可能受许多其他因素的调节,包括软组织损伤和应激反应。总之,与对照组相比,髋部骨折女性在初始和早期愈合阶段的骨膜素水平较高。对骨膜素水平的评估可能是骨丢失评估的一部分,甚至可能用于监测药物干预对促进骨折愈合的影响,但在解释存在急性骨折和医学合并症时的分析时需要谨慎。进一步的研究证实了骨膜素对骨愈合的额外益处的假设是必要的。
