微泡浓度联合脾脏硬度对初诊AML患者预后评估的价值
2020-03-25王宁方何文艳赵崇山尤月明周志伟王毅军
王宁方,何文艳,赵崇山,尤月明,周志伟,王毅军
河北中石油中心医院,河北廊坊 065000
急性髓系白血病(AML)是起源于造血干祖细胞的克隆性恶性血液病,近年来,随着新药的使用及造血干细胞移植的开展,完全缓解率(CR)显著升高,但仍有50%~70%的患者最终复发,5年生存率仅为20%[1]。研究发现,高危染色体核型、FLT3突变是影响生存的危险因素[2]。微泡(MPs)是从细胞表面脱落的直径<1 μm的颗粒,通过将MPs成分(包括细胞膜蛋白、有活性的脂类和mRNA)和感染性颗粒转移到靶细胞,从而激活靶细胞,微粒有促凝、促血管生成、参与癌症增殖和转移、诱发耐药等作用,并可预测预后[3]。研究发现,血浆组织因子来源微粒与急性早幼粒细胞白血病患者凝血异常密切相关[4]。FibroScan(FS)检测脾脏硬度(SSM)已被广泛用于肝病领域[5],并用来评估骨髓纤维化患者抗JAK2治疗效果[6]。目前尚鲜见AML患者MPs、SSM检测及二者与AML患者预后相关性的报道。2016年1月~2019年7月,我们对43例初诊AML患者进行了MPs及SSM检测,并分析其在患者预后评估中的价值。
1 资料与方法
1.1 临床资料 收集2016年1月~2019年7月于我院就诊的初治AML患者43例(AML组),男20例、女23例,年龄35~80岁,中位年龄62岁,其中M0 2例,M1 8例,M2 9例,M3 7例,M4 10例,M5 7例。t(8;21)9例,t(15;17)7例,t(16;16)1例,正常核型11例,+8 1例,t(3,3)、-5、-7、t(6,9)、5q-、7q-各1例,复杂核型8例。FLT3突变阳性16例。所有患者经骨髓细胞学、免疫分型、细胞遗传学、分子生物学、骨髓病理等确诊为AML。诊断标准参考WHO2016版标准。复发标准:完全缓解后外周血重新出现白血病细胞或骨髓原始细胞﹥0.05或髓外出现白血病细胞浸润。无复发生存时间(EFS):获得CR患者从CR之日至复发或者CR状态下死亡的时间。总生存时间(OS):从诊断之日至死亡或末次随访的时间。随访截止日期为2019年7月15日。排除标准:不能控制的癫痫患者,有严重未控制的精神疾病患者。另收集20例健康志愿者作为对照组,男10例、女10例,年龄25~60岁,中位年龄50岁。患者和志愿者均签署知情同意书。本研究已通过医院伦理委员会批准。
1.2 MPs浓度测定 采集AML患者(入院第1天)及健康志愿者(体检日)4 mL EDTA抗凝的外周血,为避免污染,将前2 mL丢弃。标本在采集后的1 h内送到实验室处理。取2 mL外周血,2-16型水平离心机(美国 Sigma 公司)2 000×g离心10 min。将上层血浆转移到EP管中,-80 ℃冰箱中保存,待集中处理。将保存在-80 ℃的血浆于4 ℃解冻,2 500×g 离心20 min,去掉血小板和细胞碎片(重复2次)。然后将无血小板的血浆16 000×g低温高速离心机(德国 Eppdorf 公司)离心1 h,沉淀即为MPs,用PBS冲洗1次。BCA法(试剂盒购自北京博凌科为生物科技有限公司)检测MPs浓度。配制工作液:将50体积的试剂A与1体积的试剂B混合后即为标准工作试剂,呈嫩绿色。标准蛋白溶液配制:用待测样品之缓冲液将浓度为2 mg/mL的标准品牛血清白蛋白(Bovine serum albumin, BSA)进行倍比稀释,使其终浓度为2、1.5、1、0.75、0.5、0.25、0.125、0.025、0 mg/mL。将5 μL标准品或待测样品与100 μL工作液混合,37 ℃ 30 min。将反应管温度冷却至室温,TECAN SUNRIS光吸收酶标仪(奥地利 TECAN 公司)测定562 nm处光密度(OD)值。记录所有样品的OD值,使用Office Excel软件绘制标准曲线,计算各样品浓度。
1.3 SSM测定 所有患者用FibroScan 502通过瞬时弹性成像技术检测SSM。由同1名专业医师对AML患者在初诊时、诱导化疗后14 d检测,之后每2个月检测1次。对20例健康志愿者进行SSM检测。测量区域要求远离脾脏边缘,无大血管结构,脾脏有足够的厚度,将扫描仪M探头垂直于受检者的皮肤表面,患者取侧卧位,左上肢上举,将探头置于其左侧左腋前线9~11肋间,检测成功标准:检测成功10次以上,四分位间距≤30%,成功率≥60%[7],检测值以Kpa表示。
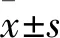
2 结果
2.1 AML组与对照组MPs浓度比较 AML组、对照组MPs浓度分别为(8.04±2.66 )、(3.80±0.34)g/L,两组比较差异有统计学意义(Z=-6.325,P=0.000)。
2.2 MPs浓度与AML患者临床特征间的关系 见表1。
2.3 Kaplan-Meier生存分析 对表1中因素进行筛选,MPs≥7.8 g/L者中位EFS短于MPs<7.8 g/L者(8个月 vs 27个月);SSM≥35 Kpa者中位EFS短于SSM<35 Kpa者(8个月 vs 27个月),随染色体核型分级升高,中位EFS逐渐缩短(28、18、6个月);FLT3-ITD+者中位EFS短于FLT3-ITD-者(6个月vs 20个月),P均<0.05。随外周血原始细胞比例及达CR1所需疗程增加,中位EFS缩短,P<0.05。CD7+、CD123+、CD56+者中位EFS缩短,P<0.05,见表2。随MPs、SSM升高,中位OS缩短(16个月 vs 38个月,16个月 vs 38个月);随染色体核型分级升高,OS显著缩短,分别为38、27、15个月;随年龄增长、外周血原始细胞比例升高、达CR1所需化疗疗程增加,中位OS显著缩短;FLT3-ITD+、CD56+者中位OS显著缩短;P均<0.05,见表2。

表1 MPs浓度与AML患者临床特征的关系
注:a代表Mann-WhitneyU检验。
MPs<7.8 g/L且FLT3-ITD-、MPs<7.8 g/L且FLT3-ITD+、MPs≥7.8 g/L且FLT3-ITD-、MPs≥7.8 g/L且FLT3-ITD+者中位EFS分别为28、18、12、4个月,P=0.000;中位OS分别为38、30、20、6个月,P=0.000。
MPs<7.8 g/L且SSM<35 Kpa、MPs<7.8 g/L且SSM≥35 Kpa、MPs≥7.8 g/L且SSM<35 Kpa、MPs≥7.8 g/L且SSM≥35 Kpa中位EFS分别为27、18、14、8个月,P=0.000;中位OS分别为38、30、26、16个月,P=0.000。
2.4 Cox回归分析 进一步将Log-rank检验有统计学差异的结果纳入Cox模型中,发现染色体核型、FLT3-ITD突变、MPs是影响AML患者EFS的独立预后因素(P分别为0.024、0.032、0.000,相对危险度分别为2.039、2.794、5.857)。FLT3-ITD突变、MPs是影响AML患者OS的独立预后因素(P分别为0.000、0.000,相对危险度分别为11.806、10.460)。
3 讨论
近年来,免疫标记、细胞遗传学、分子生物学异常等被用于AML患者的危险度分层、预后评估。但AML有较强的异质性,部分核型正常且无基因突变的AML患者预后评估尚缺乏特效方法。研究发现,白血病细胞衍生的MPs可转运白血病细胞膜受体进入骨髓微环境中,促进白血病细胞的增殖和存活,白血病细胞衍生MPs的表型与白血病的分型及临床分期有关[8]。SSM检测因无创、可重复操作等已被用于骨髓纤维化抗JCAK2治疗效果的评估[6]。

表2 AML患者Cox量化模型赋值与单因素分析统计结果(Log-rank检验)
研究报道,白血病细胞来源的MPs富含MMP9,能降解基底膜和细胞外基质,促进白血病细胞的侵袭和转移,增强白血病细胞的侵袭力[8]。在一项CLL实验中,CD61在Rai 0期患者血浆微泡中的表达量高达84%,在Rai I/Ⅱ期中表达量约60%,血浆中微泡的含量和Rai分期有关,且进展期患者血浆中,表达CD52和CD20分子的MPs显著增多,MPs与特异性抗体结合,直接导致阿仑单抗和利妥昔单抗耐药,最终白血病进展,患者生存期缩短[9]。我们发现,AML患者MPs高于对照组,与既往研究相符[8]。且高MPs与高龄、差染色体核型、较多达CR1所需化疗疗程等不良预后因素有关,且MPs浓度≥7.8 g/L组EFS、OS均显著缩短,MPs是影响EFS、OS的独立预后因素。高MPs者预后差。
FS因其具有无创、快速、准确度高等特点在肝病领域得到广泛应用[5]。研究发现,SSM或可用来预测HCV 感染失代偿性肝硬化的发生[10],SSM的检测可预测食管胃底静脉曲张破裂出血[5]。我们发现,SSM≥35 Kpa者EFS、OS短于SSM<35 Kpa者,且MPs浓度高于SSM<35 Kpa者,进一步分组发现,无论SSM高低,MPs≥7.8 g/L者EFS、OS均短于MPs<7.8 g/L者,MPs<7.8 g/L且SSM≥35 Kpa者EFS、OS稍长于MPs≥7.8 g/L且SSM<35 Kpa者,但无统计学差异,低MPs带来的生存获益或可被SSM升高所降低。
FMS 样酪氨酸激酶 3(FLT3) 是一种刺激性生长因子受体。FLT3-ITD基因突变,将导致酪氨酸激酶持续活化,使细胞发生自发性、非依赖性增殖,与肿瘤和白血病的发生密切相关,FLT3-ITD突变阳性AML患者具有外周血白细胞数目及骨髓白血病细胞比例高的临床特征,诱导缓解率低,EFS、OS短,预后差[2]。我们发现,FLT3-ITD+者MPs显著高于FLT3-ITD-者,进一步根据MPs及FLT3-ITD分组,MPs≥7.8 g/L者EFS、OS均短于MPs<7.8 g/L者,无论MPs浓度如何,FLT3-ITD+者EFS、OS短于FLT3-ITD-者,MPs≥7.8 g/L且FLT3-ITD+者生存期最短,由此推论FLT3-ITD突变或可促进白血病细胞分泌MPs,但FLT3-ITD对AML预后的影响不依赖于MPs,具体机制有待进一步研究。研究报道,CD56+AML患者治疗反应差,首次化疗后CR率、累积CR率、PFS、OS均低于对照组,诱导缓解后易复发,总体生存期短[11]。CD123是影响患者CR1及 OS的独立危险因素[1],而CD7+与预后不相关[11]。我们发现,CD7+、CD123+、CD56+者中位EFS缩短,CD56+者中位OS缩短,且CD56+者MPs高于CD56-者。高MPs AML患者CD56表达增多,生存期短,预后差。
综上所述,高MPs与高SSM、高龄、差染色体核型、达CR1所需疗程增加、FLT3-ITD突变、CD56表达等因素有关,MPs是影响EFS、OS的独立预后因素,联合SSM检测有助于评估患者预后。
