实验室无机废液处理初步探索总结
2020-03-24王晓琴赵树英董丽莉史乃立
王晓琴,赵树英,董丽莉,史乃立
(中国石油大学(北京)理学院,北京102249)
高校化学实验室不单单是培养学生动手能力的场所,在实验环节中更应贯彻对学生环保意识潜移默化的影响〔1-2〕。这种环保教育不应仅仅停留在理论上,更应贯彻落实到日常的化学实验环节中,譬如无机化学实验室由于实验教学产生很多有害废液,若未做处理就倒入下水道,势必造成严重的环境污染。而实验室把废液收集后统一委托外单位作无害处理,则每年需支付数万元的处理费用。无机废液中的污染物主要是重金属离子,进入环境后对生态造成极大危害〔3-4〕。重金属离子不能像有机污染物那样可以被细菌、微生物逐渐降解,而是会通过生物富集进入食物链中,甚至会直接威胁人体健康。重金属离子及其化合物的毒害在生物体中缓慢积累,开始不易觉察,一旦出现症状就会带来严重的后果〔5-7〕。在实验室建立废液处理装置,并尝试让学生自行动手处理实验过程中产生的废液,一方面可降低环境污染,减少废液处理费用;另一方面能使学生进一步掌握废液处理原理,并为他们在今后工作中贯彻落实环保理念打下良好坚实的基础。
1 化学实验室无机废液的组成与含量分析
本实验室无机化学实验中涉及到的有害重金属离子主要包含:铬(Cr6+)、铅(Pb2+)、汞(Hg2+)、镉(Cd2+)、镍(Ni2+)、铜(Cu2+)等,其中以 Cr6+含量最多。例如在Na2S2O3溶液标定实验中一次使用K2Cr2O7的质量约为0.5~0.6 g,每位同学至少需要标定3次。同时,实验室在某些情况下还会用到铬酸洗液,这将导致更多的Cr6+进入废水。而在一般情况下,其他重金属离子的使用量小于1 mL,试剂浓度均为0.1 mol/L,用量相对较少。虽然某些重金属离子总量较少,但也不宜采用自来水稀释排放。以铅离子为例,国家规定排放上限为0.1 mg/L,则0.1 mol/L的铅溶液至少需稀释至2×105倍,这对水资源是一种极大的浪费。另外,实验过程中用酸量超过用碱量,实验室产生废液普遍呈酸性。
在实验中选用二苯碳酰二肼分光光度法测定铬离子浓度〔8-9〕(检测范围:0.004~1.0 mg/L),以丁二酮肟光度法测定镍离子浓度〔10〕(检测范围:0.1~4.0 mg/L),汞离子与镉离子浓度以双硫腙分光光度法测定〔11〕(检测范围分别为 2.0~40 μg/L 与 0~5.0 mg/L),铅离子与铜离子浓度分别以双硫腙分光光度法和新亚铜灵萃取分光光度法测定。在实验中配制一定浓度的各离子水样来检测相应分析方法的可靠性。以含铬水样与含镍水样定量分析为例,平行实验中各数据的相对偏差列于表1。
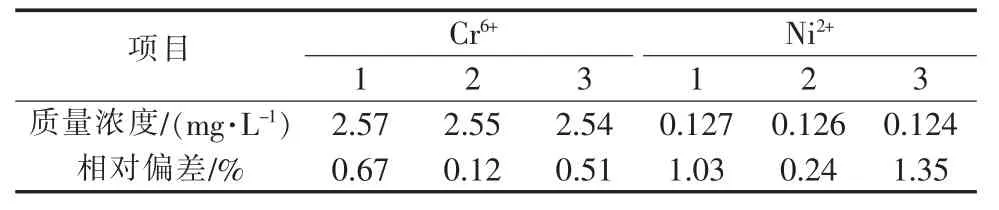
表1 含铬水样与含镍水样分析方法的平行实验
由表1可知各实验数据的相对偏差不大于1.35%,证明分析结果准确可信。以同样的分析手段进行重金属离子检测,发现废液中Cr6+浓度不超过0.01 mol/L,其他离子浓度不超过0.001 mol/L。
2 重金属离子的排放要求与废液处理方案的思考和选择
查阅文献资料获悉,现在的污水综合排放标准仍在沿用《污水综合排放标准》(GB 8978—1996),其中第一类污染物的最高允许排放质量浓度规定:总汞0.05 mg/L、总镉0.1mg/L、总铬1.5 mg/L、六价铬0.5 mg/L、总铅 1.0mg/L、总铜 1.0mg/L、总镍 1.0mg/L。
经处理后的无机废液中重金属离子含量不得超过以上各离子浓度要求。重金属离子处理现有方案很多〔12〕,例如:化学沉淀法、离子交换法、电渗析法、离子浮选法、吸附法、电解法、氧化还原法、硫化法、铁氧体法、膜处理技术等。考虑到学生操作难易程度与废液处理装置的长期运行需要,根据实验室现有条件,尽量选择流程简单可靠,设备投资成本低廉的处理方案。依据实验室产生无机废液中重金属离子的种类和性质,计划采用三段式方案,即:铁屑(Fe)还原、硫化亚铁(FeS)沉淀转化及碳酸钙(CaCO3)中和过滤的流程。
已知在酸性条件下,无机废液中加入铁屑后,会发生如下反应:
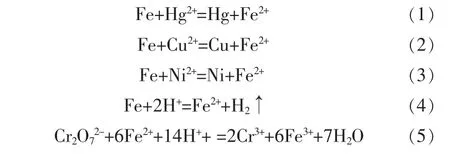
而各金属离子与FeS则发生如下反应:
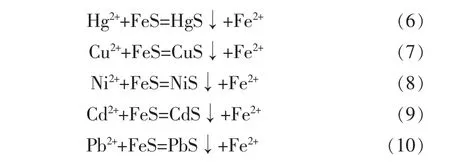
由以上各反应的标准平衡常数Kθ及生成难溶物的溶度积常数可以判断反应进行的完全状态。
2.1 Cr6+的处理
对于废水中的Cr6+来说,与Fe2+发生反应的标准平衡常数Kθ为8.27×1018,该反应可以完全进行。反应生成的Cr3+毒性虽远小于Cr6+,但在自然环境中Cr3+仍有转化为Cr6+的可能,所以环保排放标准对Cr3+也做了严格的限定,要求废液排放中总铬量小于1.5 mg/L〔13〕。对Cr3+的脱除可直接采用调节废液pH的方法,将 Cr3+转化为 Cr(OH)3沉淀,经过滤除去。
氢氧化铬的沉淀平衡常数Ksp为6.3×10-31,可沉淀完全。但氢氧化铬是两性化合物,在强碱中还会发生反应:Cr(OH)3+OH-=Cr(O。 据文献报道〔14〕,当溶液中Cr3+浓度不大于10-5mol/L,在pH为5.6时Cr3+即可沉淀完全;而在pH大于12后,氢氧化铬开始溶解。本实验计划将pH控制在6.5~9.0范围内〔15〕,此时经平衡计算溶液中Cr3+质量浓度远小于1.0 mg/L。
若废液处理结束后以CaCO3调节溶液pH,在酸性溶液中CaCO3发生反应:CaCO3+H+=Ca2++HC产生的HC在溶液中形成缓冲体系,此时溶液pH约为7,处于Cr3+完全沉淀的最佳条件之中,符合Cr3+完全沉淀实验要求,且不会造成二次污染。
2.2 Hg2+的处理
对于Hg2+来说,与Fe2+反应的标准平衡常数Kθ为 7.76×1041,反应(1)可以进行完全。 若选用 FeS作沉淀剂处理含汞废液时,已知在25℃,FeS的溶度积常数为 6.3×10-18,HgS 的溶度积常数为 4.0×10-53,则反应(6)的转化常数为1.58×1035,可转化完全。由此可知,不管用铁屑反应还是FeS处理含汞废液,Hg2+都可反应得相当完全,但金属Hg易挥发,所以选择FeS反应处理含汞废液生成沉淀的方法更为安全。
2.3 Cu2+的处理
处理Cu2+时选用铁屑作还原剂处理含铜废液,则反应(2)的标准平衡常数 Kθ为 2.24×1026,可沉淀完全。当选用FeS作处理剂处理含铜废液时,已知在25 ℃,CuS 的溶度积常数为 6.3×10-36,反应(7)的转化常数为1.58×1018,可转化完全。由此可知,以铁屑处理含铜废液时的沉淀效果比用FeS反应更为完全。
2.4 Ni2+的处理
处理废水中的Ni2+时,选用铁屑作还原剂处理含镍废液,反应(3)的标准平衡常数 Kθ为 3.55×106。若选用FeS作处理剂处理含镍废液,已知在25℃时,NiS 的溶度积常数分别为 1.07×10-21(α)、1.0×10-24(β)、2.0×10-26(γ),则反应(8)的转化常数分别为5.89×103、6.30×106与 3.15×108。 计算结果说明用铁屑或FeS处理含镍废液效果相似,反应后的产物具有不稳定性。
2.5 Cd2+、Pb2+的处理
Cd2+选用FeS作处理剂处理含镉废液时,反应(9)的转化常数为 7.88×108。Pb2+选用 FeS 作处理剂处理含铅废液时,反应(10)的转化常数为7.88×109。可知镉离子与铅离子的转化效果均可接受。
经过对以上反应的平衡常数计算,发现上述反应中各重金属离子基本能沉淀完全,加之氢氧化铁沉淀对重金属离子的部分吸附作用,用铁屑及FeS处理废液有望达到重金属离子的排放要求。
3 实验部分
3.1 实验仪器与试剂
仪器:METASH V-5000型分光光度计,OHAUS AR1140/C型0.000 1 g分析天平,METTLER FE-28型酸度计,NTU-630浊度计,装填铁屑反应柱(直径10 cm,高度100 cm),装填FeS反应柱(直径10 cm,高度100 cm)。
试剂:铸铁铁屑(Fe,1.5~2.0 mm 成品),硫铁矿颗粒(FeS,1.2~2.5 mm 成品),活性炭(C,2.0~2.5 mm成品),K2Cr2O7、CuSO4、Na2CO3、NiSO4、二苯碳酰二肼、柠檬酸铵、NaOH、HgSO4、CdSO4、丙酮、CaCO3、Fe2O3、H2SO4,均为分析纯。
3.2 反应柱装填与预处理
FeS反应柱:硫铁矿颗粒直接装填,不需要进行预处理。铁屑反应柱:下层为高度10 cm的活性炭层,上层为高度90 cm的CuSO4稀溶液处理过的铸铁铁屑。
在反应过程中铁屑极易被氧化黏结而失去效用,经过反复实践,发现将铁屑在0.5 mol/L的CuSO4稀溶液中浸泡一定时间后,则可保证使用半年而不发生黏结现象。同时由于单质铜在铁屑表面的沉积,会形成更多微电池,能加快氧化还原反应速率。方法是将铁屑先以Na2CO3溶液清洗去油,再置于CuSO4溶液中浸泡并加热至45℃左右维持4 h,然后洗涤除去Cu2+,再装填处理柱。
4 实验结果与讨论
4.1 实验装置流程与操作说明
无机废液处理装置流程见图1。无机废液在废水槽中经初步过滤去除少量有机物与不溶物后,控制在合适的pH。将初步过滤后的废液经真空泵转移至高位槽中,打开滴液计量器控制流量,使废液依次流经铁屑反应器与FeS反应器。废液中有汞离子存在时直接进FeS反应器进行处理。反应后的废液经三级沉淀过滤器过滤并中和后取样,检测浊度及各离子浓度,达标后接入排水,否则重返反应器进行再处理。
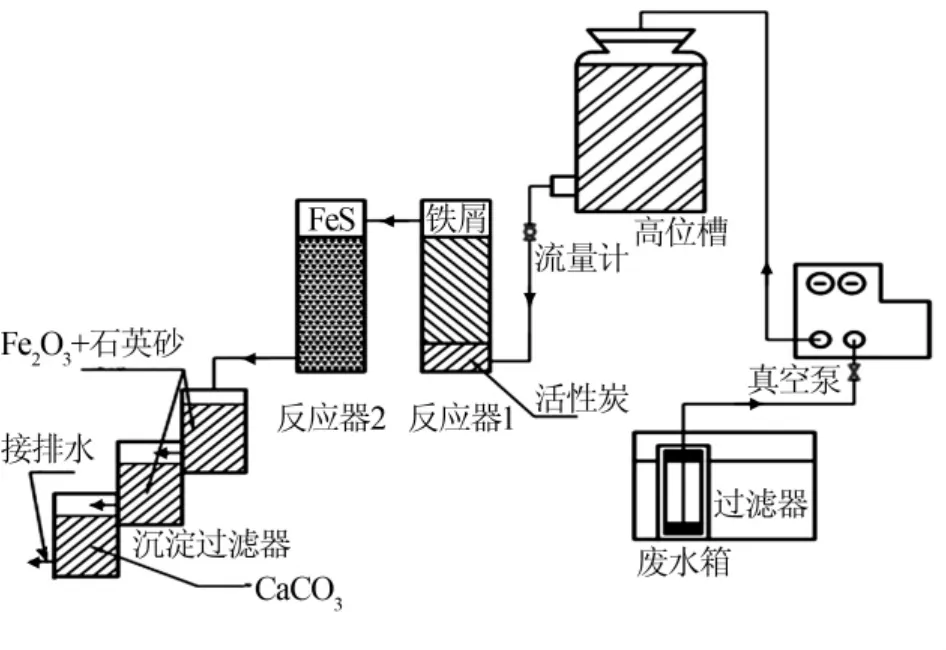
图1 无机废液处理装置流程
铁屑及硫铁矿颗粒批量购买,实验过程中不需考察粒径变化。当反应器中装填铁屑及FeS的粒度和填充量被确定后,要想达到重金属排放标准,需控制废液的浓度、酸碱度及处理流量。若废液浓度过大,重金属离子会有穿透危险,致使排放不达标。而处理溶液呈碱性时会使铁屑反应器中的铁屑钝化,但若酸性太强则反应放热量大,反应器升温过高,同时产生的氢气泡太多,易引发反应器短路。两个反应器需加盖防止水分蒸发,同时消耗的铁屑和FeS可进行适当补充或整体更换反应柱。沉降过滤器中若单独填充石英砂不足以过滤Fe(OH)3沉淀,需添加少量Fe2O3做过滤介质。下面对废液合适的pH及处理量进行实验分析。
4.2 不同实验条件下Cr6+的处理效果
为考察装置处理重金属离子浓度上限并准确对比处理前后浓度变化,先配制一系列已知浓度的重金属混合废液,用H2SO4与NaOH调节pH,在不同pH与处理流量下Cr6+的处理效果见表2。
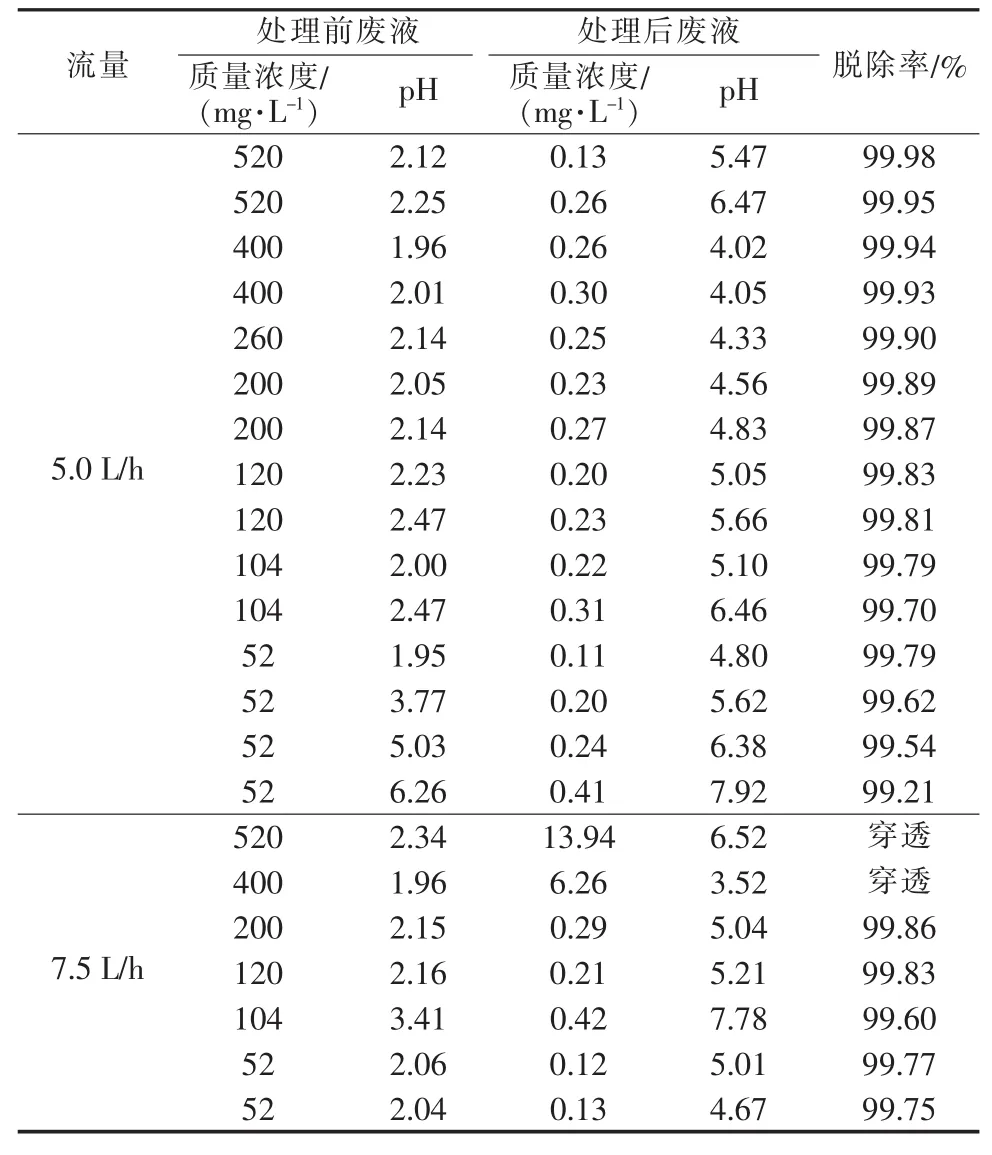
表2 Cr6+处理效果
由表2可知,在流量为5.0 L/h时,不同浓度废液中Cr6+的处理效果令人满意,都可达到排放要求。但当流量升高至7.5.0 L/h时,质量浓度为520 mg/L及400 mg/L的Cr6+废液在处理过程中发生了穿透。由重金属离子浓度分析可知,实验室无机废液中Cr6+浓度不会高于 0.01 mol/L(即 520 mg/L),因此废液处理流量控制在5.0 L/h比较适宜。从表2还可以看出,同一浓度下,废液pH越低,最终处理效果越好。当废液中Cr6+含量极少,即质量浓度在52 mg/L时,即使在中性实验条件下也能使废液中的Cr6+达到排放标准,但随着处理废液pH的增加,处理效果逐渐变差。有趣的是废液中重金属离子浓度较低的,最终处理效果并没有表现得更好,这应该是由反应的标准平衡常数或难溶物的溶度积系数决定的。
图2为废液中Cr6+质量浓度在52 mg/L时于不同处理流量下,最终流出的Cr6+浓度与废液处理前pH之间的关系图。
由图2可知,同一流量下pH越低Cr6+处理效果越好,在pH大于5以后Cr6+处理最终效果趋向平缓。同时可以看出,在pH≈2时,Cr6+处理效果与处理流量关系并不大,结合表2中数据,建议废液进入反应器前pH控制在2左右即可,酸性太强会消耗更多铁屑并产生较多氢气。由图2还可以看出,在pH相近时,废液处理流量低的情况下反应后的Cr6+流出浓度较低,说明高流速无益于废液处理效果。
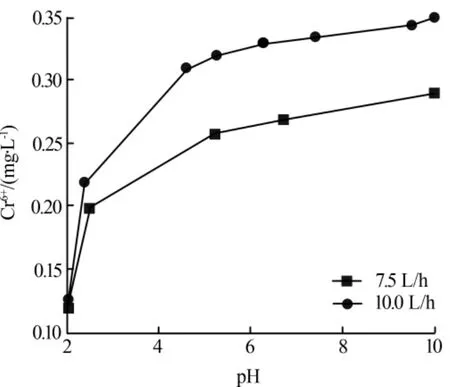
图2 不同处理量下Cr6+流出浓度与废液处理前pH的关系
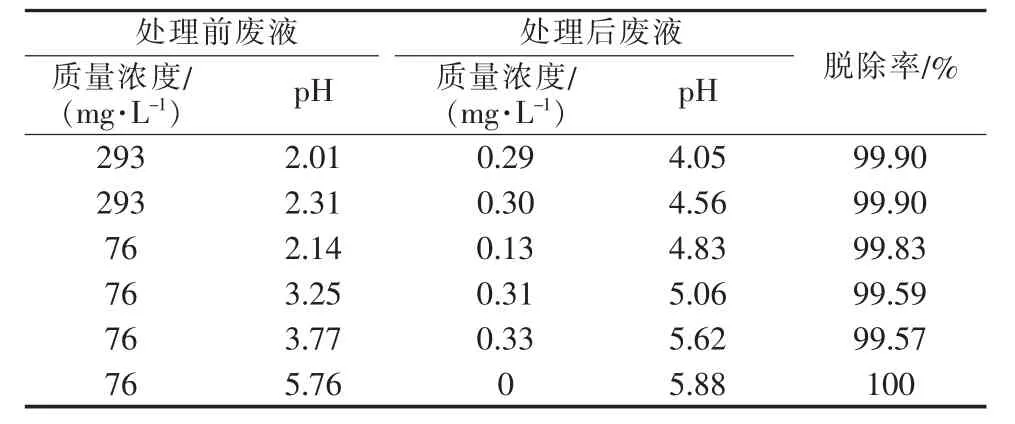
表3 废液中Ni2+处理条件及效果
4.3 Ni2+、Hg2+、Pb2+、Cu2+、Cd2+处理条件控制及处理效果
控制废液处理流量在5.0 L/h时,Ni2+的处理条件及处理效果见表3。
表3数据表明,在偏酸性条件下实验装置能处理低浓度镍废液(≤0.005 mol/L)。废液进入反应器前pH较低的情况下Ni2+处理效果较好,适宜的废液pH同样为pH≈2。废液中重金属离子浓度较低的,最终处理效果并不会表现得更好。同一浓度下,随着pH的升高,废液处理最终效果趋向变差。但实验过程中也发现,在反应器处理过含镍废液后,再处理不含镍废液时会有少量镍离子被带出。说明使用该装置处理含镍废液时存在缺陷(平衡常数偏小,Kθ仅为5.89×103、6.30×106、3.15×108),需进一步研究其他方法处理含镍废液。控制废液pH为2,处理流量在5.0L/h时,Hg2+、Pb2+、Cu2+、Cd2+等离子的处理效果见表 4。
由表4可知,无机废液经处理后重金属离子的最终浓度基本达到排放要求。处理后水样的检测中很遗憾未能得到Cd2+浓度的可靠数据,查阅文献可知在低浓度范围内以FeS处理含镉废水是可行的〔16-17〕。实际产生的无机废液中重金属离子浓度比实验配制的最高浓度要低得多,经离子检测证明在优化实验条件下完全可达到排放标准。
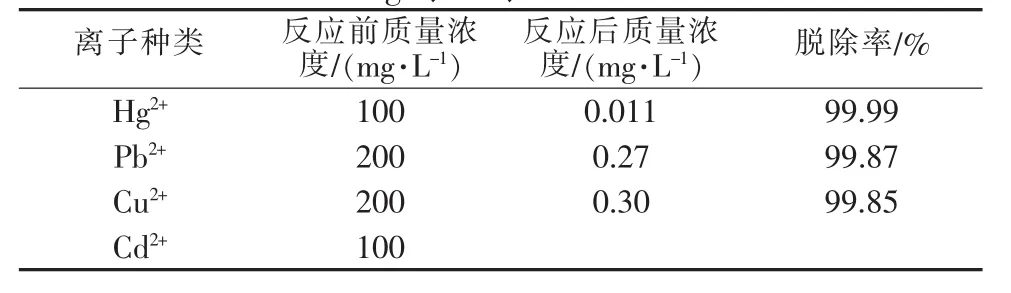
表 4 废液中 Hg2+、Pb2+、Cu2+与 Cd2+的处理效果
反应后的废液,经Fe2O3与石英砂过滤、CaCO3中和,最终流出液体pH≈7。在沉淀过滤器中石英砂与CaCO3的过滤作用有限,当过滤层中添加部分Fe2O3后过滤效果好转。沉淀过滤不完全时可循环沉降过滤,直至废水清澈透明。流出液体无色说明本身呈现绿色的Cr3+已基本被转化为 Cr(OH)3沉淀除去。无机废水的pH以酸度计测定,排出水的浊度以浊度计测定。
根据经验,1个学生班次进行3学时实验,产生的废液大约在10 L左右。为保证废液不积存,操作不过频,设备不臃肿,结合表2数据分析,确定装置的废液处理量为5.0 L/h。实验采取间歇性操作方式,每次操作,高位槽中可贮液10 L。实践证明反应柱可使用1学期后进行更换,经核算废液处理总体费用约600元/学期,远远低于校外机构废液处理价格。且该装置流程简单、操作易学,分组学生可完全自行动手处理实验过程中产生的废液,掌握一种无机废液处理技术的同时将环保观念镌刻于心。
5 结论
(1)根据实验室无机废液中涉及到的重金属种类、浓度、废水量、国家排放标准要求及实验室便利可行等条件,选取铁屑还原、硫化亚铁沉淀转化与碳酸钙中和过滤的三段式方案进行装置设计。该装置能有效处理教学过程中产生的低浓度重金属废水,适宜的处理量为5.0 L/h。
(2)废液处理要求 Cr6+浓度小于 0.01 mol/L,其他离子浓度小于0.001 mol/L。处理前需过滤掉不溶物并适当调节pH。当Cr6+质量浓度不高于52 mg/L时,废液可在中性条件下处理达标。处理过含镍废水后再处理其他废液会有镍离子被冲出的现象,需以其他方法做进一步研究。
(3)沉降过滤器中填充的石英砂与CaCO3不足以完全过滤Fe(OH)3,需增加Fe2O3做过滤介质。处理过的废液酸度有较大幅度降低,再经CaCO3中和过滤,最终流出滤液的pH接近中性并且无色透明。经检测重金属离子可达到排放要求。
(4)学生有机会切身参与到环境污染防治行动中,可逐步养成废液回收的良好习惯,环保观念深入内心。
