准确测定高锰酸盐指数的条件因素分析
2020-03-24李兰芳葛茂中舒必涛周祖明
李兰芳,葛茂中,刘 慧,舒必涛,周祖明
(江夏区环境监测站,湖北武汉430200)
高锰酸盐指数也被称为化学需氧量的高锰酸钾法(简称CODMn),是指在酸性或碱性条件下,用高锰酸钾氧化水样中的部分有机物及无机还原性物质,水样中的当氧量根据实验过程中消耗的高锰酸钾量计算,单位为mg/L。高锰酸盐指数作为水体评价的常用指标之一〔1〕,它反映的是水体受到有机物及无机可氧化性物质的污染程度,适用于地表水、饮用水等较为清洁的水体的测定。
由于高锰酸钾氧化水样中有机物及无机还原性物质的持续时间为30 min,在此时间段内,被氧化的只是水体中的部分有机物,而非总有机物〔2〕。因此高锰酸盐指数是一个相对性的条件指标,不同的条件因素都会影响其测定结果,任何一个条件控制不好都会引入测定误差〔3〕。为此,从实验用水、加热时间、高锰酸钾标准溶液的浓度、反应体系的酸度以及滴定条件的控制等方面进行分析,提出准确测定高锰酸盐指数的方法。
1 条件因素分析
1.1 实验用水
实验用水对高锰酸盐指数测定结果的影响表现在以下两个方面:(1)对环境样品有影响,在配制高锰酸钾标准溶液、草酸钠标准溶液和(1+3)硫酸溶液时,引入带有还原性物质的实验用水,会使测定结果产生偏差;(2)对标准样品有影响,在测定标准样品时,需要移取10.0 mL标准样品稀释至250 mL,实验用水参与了标准样品报出值的计算,若实验用水中含还原性物质较多,空白值较高,则会对标准样品的测定产生较大的影响,使测定结果偏高。张莲莲〔4〕的实验研究表明,不同空白值的实验用水对高锰酸盐指数测定结果的影响与上述结论相同,结果如图1所示。
《水质高锰酸盐指数的测定》(GB 11892—1989)规定在高锰酸盐指数的测定实验中,实验用水不得使用去离子水,必须是不含还原性物质的蒸馏水或纯度等达到同等要求的水。史长云等〔5〕将去离子水与重蒸馏水进行了对比,做全程序空白与标准样品的测定实验,结果表明,电导率小于2.0 μS/cm(25℃)的去离子水与重蒸馏水的测定结果无显著性差异。而丁欣梅等〔6〕探究了普通蒸馏水、无有机物水和高纯水3种不同的实验用水对高锰酸盐指数测定结果的影响,结果表明几种不同实验用水测定标准样品的准确度和精密度均较为理想。因此在笔者看来,在实验用水的选择上,首要的考虑因素应是空白值的高低而非水的种类。实验用水的空白值越低,即水中的还原性物质含量越少,实验结果相对越准确。
顾祥等〔7〕分别对稀释测定和未稀释测定两种情况下不同空白值对高锰酸盐指数测定结果的影响进行了实验,发现对于未稀释水样,空白值越大,高锰酸盐指数测定结果越高,产生的误差越大;对于稀释水样,空白值的变化对高锰酸盐指数的测定结果有一定的影响,但影响偏小。
研究表明〔4,8-9〕,实验用水的空白值应控制在小于等于0.5 mg/L,才能保证其测定结果的准确性与可信度。当实验用水空白值较高时,应采用二次蒸馏等方式对实验用水进一步纯化,控制实验用水的空白值在0.5 mg/L范围内,才能进行下一步实验。此外,应当注意到,在实验用水确定后,实验的全过程即包括(1+3)硫酸的配制、贮备液的配制、标准溶液的配制以及标准样品的稀释等都应统一使用该实验用水。

图1 不同空白值的实验用水对高锰酸盐指数测定结果的影响
1.2 加热时间
高锰酸钾法测定的是30 min内高锰酸钾所氧化的水体中的物质的量,而非总有机物含量,因此加热时间会对高锰酸盐指数的测定产生影响〔10〕。加热时间过短,氧化反应不充分,高锰酸盐指数测定结果偏低;加热时间过长,氧化率过高,测定结果偏高。
根据《水质高锰酸盐指数的测定》(GB 11892—1989),以样品放入水浴锅后再次沸腾开始计时,控制加热时间在(30±2)min。以(9.60±0.50)mg/L 标准样品为例,取50 mL水样,各进行5次平行实验,不同加热时间下的测定结果如表1所示。

表1 加热时间对高锰酸盐指数测定结果的影响
由表1可知,随着加热时间的延长,高锰酸盐指数的测定结果在不断增大,当加热时间在28~32 min时,其测定结果在标准样品真值的范围内,而加热时间为30 min时,测定结果最接近真值,相对误差最小,因此在高锰酸钾法的测定实验中,应严格控制加热时间为30 min。
1.3 高锰酸钾标准溶液的浓度
研究表明〔4,11〕,当高锰酸钾标准溶液的浓度控制在0.009 8~0.010 1 mol/L时,样品测定的相对误差较小,在不确定度范围内;当高锰酸钾标准溶液的浓度为0.010 0 mol/L时,相对误差最小,最接近真值。
理论上说,如果高锰酸钾溶液浓度偏低,则样品消耗高锰酸钾溶液的体积增加,使测定结果偏高;如果高锰酸钾溶液的浓度偏高,那么在进行空白实验时,10 mL的草酸钠溶液不能将其完全还原,溶液紫红色无法彻底退去,样品消耗高锰酸钾溶液的体积减少,从而使测定结果偏低。
1.4 反应体系的酸度
当体系中加入5 mL(1+3)的硫酸和10 mL高锰酸钾溶液后,在酸性条件下得到电子被还原成Mn2+,发生如下半反应:
根据能斯特方程,其氧化电极电位为:

H+浓度越大,越大,的氧化性越强。因此,反应体系的酸度会对高锰酸盐指数的测定结果产生影响。一方面,当体系中的酸度过高时,H+浓度显著增大,在强酸性介质中变为强氧化剂,使待测样品中原来不能被氧化的物质也同时被氧化,导致测定结果偏高;而另一方面,当体系中的酸度过低时,的氧化性较弱,不能使水体中的有机物充分被氧化,导致测定结果偏低。研究表明〔11〕,当体系中加入(1+3)的硫酸试剂时,高锰酸盐指数测定结果的相对误差较小。因此在实际操作中,应严格控制好样品酸度,精确配制浓度为(1+3)的硫酸试剂。
1.5 滴定过程的控制
1.5.1 滴定温度
李萍等〔12〕研究了温度对草酸钠标定高锰酸钾标准溶液的影响,探究在70~90℃范围内,随着温度的升高,草酸钠标定高锰酸钾标准溶液浓度的变化,结果如图2所示。
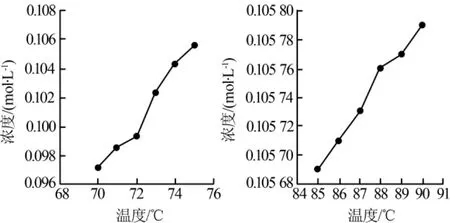
图2 高锰酸盐标液浓度随温度的变化趋势
研究表明,在滴定温度过低(低于75℃)或过高(高于85℃)时,高锰酸钾标准溶液的浓度均随着温度的增加不断升高。这是因为当滴定温度过低(低于75℃)时,随着温度的增加,反应速率逐渐增大,所消耗的高锰酸钾标准溶液逐渐减少,其浓度逐渐增大;当滴定温度过高(高于85℃)时,草酸在酸性条件下易发生分解(H2C2O4→CO2+H2O),使消耗的高锰酸钾标准溶液进一步减少,其浓度逐渐增大。
当滴定温度在75~85℃时,高锰酸钾标准溶液的浓度随着温度的升高基本保持稳定,略有升高,如图3所示。
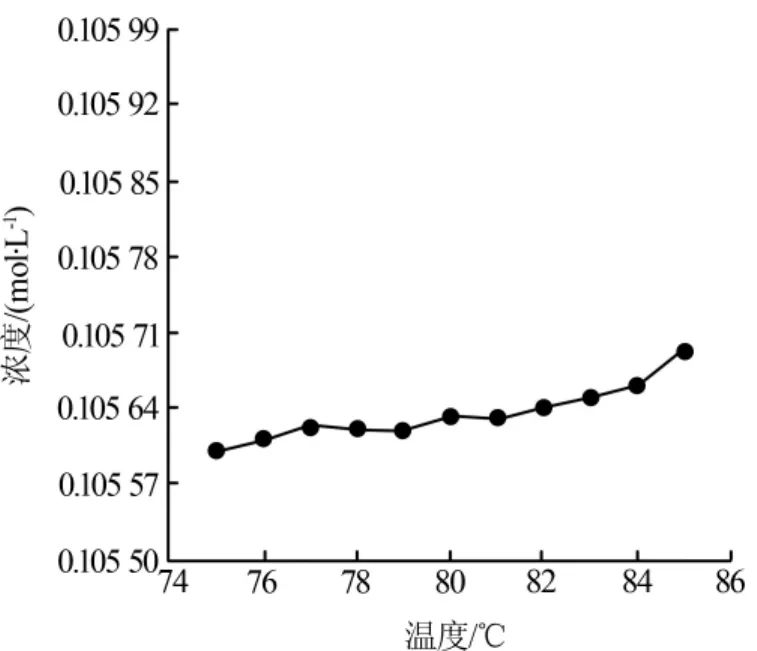
图3 75~85℃时高锰酸钾标液浓度随温度的变化趋势
在该温度范围内,反应体系处于较为稳定的状态,既不会因为温度过低使反应速率变慢,也不会因为温度过高使草酸发生分解,该温度范围是适宜于滴定反应的温度。
同理本实验中,高锰酸钾滴定草酸钠的反应,滴定温度应保持在75~85℃,使反应体系处于较为稳定的状态,保证滴定的准确性。
1.5.2滴定速度
高锰酸钾与草酸钠的反应是一个自催化反应,其作用机理比较复杂,赵怡等〔13〕利用动力学-光谱数据解析,模拟高锰酸钾衰减速率曲线,证实了高锰酸钾与草酸钠的反应是被产物Mn2+所催化的自催化反应。王春等〔14〕通过研究高锰酸钾与草酸反应的机理发现,该反应的速率呈现先慢再快再慢的变化过程。
在该实验中,滴定速度的变化也应当随着反应速率的变化呈现先慢再快再慢的过程。若一开始就快速滴入高锰酸钾溶液,会造成高锰酸钾相对于草酸钠局部过量,此时在热的弱酸性溶液中,Mn被还原成 MnO2〔15〕:Mn+4H++3e-=MnO2+2H2O。 然后 MnO2被 Na2C2O4还原〔16〕:MnO2+C2+4H+=Mn2++2H2O+2CO2。
因此在滴定开始时,速度不能太快,当体系中产生催化剂Mn2+后,才能逐渐加快滴定速度。一般认为在第一滴高锰酸钾滴入锥形瓶中并完全褪色后,溶液中产生了催化剂Mn2+,然后可以开始加快滴定速度,待到滴入锥形瓶中的高锰酸钾颜色褪去变慢时,说明滴定临近终点,要开始放慢滴定速度,以避免过滴的情况出现。
此外应当注意到,如前文所述,75~85℃是适宜于高锰酸钾与草酸钠反应的温度,因此,为保证滴定过程在75~85℃下进行,滴定速度也不能太慢。这一滴定速度的“快”与“慢”的控制,需要监测人员在日常的实验中多多思考,总结手法经验,才能将滴定速度控制好,保证滴定的精确。
1.5.3 滴定时间
滴定过程持续的时间不能太长,否则会因为滴定时间过长,使反应体系温度下降影响反应进程。研究表明〔17〕,滴定时间应控制在 2~3 min 内,这样才能保证测定结果可信有效,在误差允许的范围内。
此外,应该注意到,滴定时间还应随着外界气温的变化而适当调整。夏季天气炎热气温较高,体系温度下降得较慢,此时滴定时间可以略长,滴定速度可稍微放缓;而在冬季天气寒冷,体系温度下降得很快,此时应当缩短滴定的时间,保证滴定温度,或者在加入草酸钠后,将锥形瓶重新放到水浴锅中,保证体系温度在70℃以上,取出后再滴定。
1.5.4 滴定终点
溶液中的Mn2+和空气中的还原性物质、尘埃都可缓慢使Mn还原,使溶液粉红色褪去,因此当滴定至刚出现粉红色且保持30 s不褪,即可视为滴定终点。在实际操作中,因粉红色颜色很淡,不容易观察,因此可在操作台上锥形瓶下方垫一张白色的纸张以便于观察实验颜色的变化。此外,在进行滴定终点判定时,应当尽量确保所有样品的终点颜色一致,才能使测定结果具有可比性。
此外,还需要注意以下事项:
(1)为确保在水浴加热过程中溶液受热均匀,水浴锅水面应比锥形瓶中水样高度高出约1/2~1/3。
(2)该方法只适用于氯离子质量浓度低于300 mg/L的水样,对于氯离子质量浓度高于300 mg/L的水样,应采用碱性法〔18〕。
(3)加热氧化后体系内应剩余1/2~1/3的高锰酸钾,溶液呈现明显的紫红色。若加热氧化后,溶液颜色明显变淡,则说明水样中的有机物含量过高,应适当减少取样量,经稀释后测定。
(4)加热氧化的开始时间不是锥形瓶放入水浴锅的时间,而应该是锥形瓶放入水浴锅后再次沸腾时开始计时,水浴锅再次沸腾的时间与水浴锅的型号、外界的气候环境等因素有关,一般为1~2 min。
(5)多个样品加入水浴锅的间隔时间以3~5 min为宜,这为样品之后的滴定过程留下充足的时间。做空白样品时,间隔时间可适当延长,因为空白样品还需要进行反滴定操作。
2 结论
(1)实验用水的空白值应小于 0.5 mg/L;(2)水浴加热时间严格控制在30 min;(3)高锰酸钾标准溶液的浓度尽量保持在 0.010 0 mol/L;(4)使用(1+3)的硫酸溶液调节体系酸度;(5)在75~85℃条件下,遵循“先慢后快再慢”的原则,在3 min内滴定至溶液呈现微粉色,并保持30 s不褪。
此外,还有诸如水样中氯离子的浓度、高锰酸钾的消耗量和水浴加热的开始时间等细节问题也需要考虑,在实际分析中,必须要进行严格的条件控制,对体系的温度、酸度、加热时间、滴定过程以及高锰酸钾溶液的浓度等因素严格把控,才能准确测定水样中高锰酸盐指数的浓度。
虽然近些年来很多学者都对影响高锰酸盐指数的条件因素进行了深入的分析,在实际应用中起到了一定的指导作用,但是由于各地实验环境差别较大且实验人员手法各异,同一样品在不同地方由不同实验人员操作仍然会存在一定的差别。因此在实际操作过程中,除了要总结前人经验,注意各条件因素的控制,更要结合本地的实验条件以及自身的操作手法,总结出一套适用于自己的操作方法。只有在日常的监测分析中,不断地总结思考、吸取经验教训,才能将高锰酸盐指数的分析实验做得更好。
