猕猴进行遥测系统植入子植入手术的经验体会*
2020-03-23卢祺炯陈灵芳夏丽娟杨红忠郑高利
卢祺炯 徐 聪 陈灵芳 杨 倩 夏丽娟 杨红忠 郑高利
(杭州医学院安全性评价研究中心,杭州 310053)
安全药理学研究中,为获取更加准确的药物的非期望影响的暴露剂量、暴露时间等信息,使用遥测系统,通过长时间不间断获取清醒无束缚动物给药前后的呼吸、心电、血压等核心指标数据,经综合分析与比较,以确认药物可能的对动物心血管系统与呼吸系统的不良影响,该方法符合中国食品药品监督管理总局《药物安全药理学研究技术指导原则》[1]、ICH S7A《Safety Pharmacology Studies for Human Pharmaceuticals》[2]对安全药理学研究试验方法的要求。遥测系统的硬件主要分两类:一类是依靠植入子监测动物心血管、呼吸系统的数据,该类设备需要对动物进行植入子植入手术,手术恢复后方可开展试验;另一类是应用无创遥测技术,将传感器置于动物体表,并用马甲保护和放置遥测系统设备,此类设备无需进行手术,只需要对动物进行马甲穿着的训练筛选依从性好的动物即可开展试验。在选择试验仪器时,应根据供试品特征与试验要求选择植入或者无创的方法。
梁春南[3]曾报道犬因伤口开裂后续感染导致植入手术失败,为了避免本试验猴术后出现类似的情况,作者根据之前应用Beagle犬进行植入手术出现过的一些异常状况,根据猴的身体特征,针对性地调整了手术方案、并对可能出现不期望出现的不良反应建立了解决预案,最终全部8只受术猴手术顺利完成、术后愈合良好,血液学、生化学指标与心血管系统未显示感染或炎症指标,植入子工作正常,并顺利地完成了后期的安全药理学试验。
1 材料与方法
1.1 实验动物
恒河猴,普通级,年龄3~5岁,体质量3.1~6.5 kg,8只,雌雄各半,由宁波市鄞州东吴天童猕猴养殖场提供,实验动物生产许可证:SCXK(浙)2013-0027,动物质量合格证号:0002570。饲养于浙江省医学科学院安全性评价研究中心普通级猴饲养室中,温度16~26 ℃,相对湿度40%~70%,中央空调集中通风8~10次/h,光照12 h明、12 h暗,实验动物使用许可证:SYXK(浙)2012-0176。喂饲猴全价颗粒营养饲料,LAWS-2000实验动物反渗透纯水机处理的饮水。经IACUC批准动物使用申请书编号GLP-A-033。
1.2 主要仪器与试剂
DSI电生理遥测系统,植入子型号TL11M3-D70-PCTR,美国DSI公司;Matrix动物麻醉机,美国MIDMARK公司;BayerADVIA 2120血细胞分析仪,西门子公司;日立7100全自动生化仪,日本日立公司;TCS-15电子秤,梅特勒-托利多;注射用头孢西丁钠(0.5 g/瓶),批号:120615,海口市制药厂有限公司。
双氯芬酸钠缓释胶囊(50 mg),批号:130105,南京长澳制药有限公司;戊巴比妥钠,批号:WS20171005,规格:25 g/瓶,购于上海西唐生物科技有限公司;异氟烷,批号:120204,鲁南贝特制药有限公司。
1.3 实验方法
1.3.1术前准备工作:猴检疫结束次日,称体质量,后肢静脉抽血样进行5分类血常规分析与生化学分析,如出现WBC分类异常伴随体温偏高的、PLT偏低、PT较长的猴,则请兽医对症处理,恢复正常后再行安排手术。术前3 d耳温计检测体温;之后肌注注射用头孢西丁钠0.5 g/猴,对动物进行围手术期抗生素覆盖处理,连续2 d;术前禁食不禁水12 h以上。预备经清洗、消毒、干燥的猴饲养笼作术后恢复关养用。
1.3.2麻醉方法与麻醉程度的控制:术前后肢静脉缓慢注射3%戊巴比妥钠1 mL/kg体质量诱导麻醉,以四肢松弛并且牵拉无反抗、针刺反射消失、眼睑反射迟钝为诱导麻醉完成状态,之后完成备皮、建立静脉通道、滴注0.5%头孢西丁钠注射液(100 mL)等预备工作后手术台固定,异氟烷吸入维持麻醉。麻醉维持期间不间断观察猴麻醉状态,如猴出现肌张力增加、身体扭动等异常状况时,应暂停手术操作并增加异氟烷蒸发速度加深麻醉程度,若心率减慢过快同时血压降低(遥测系统手术时可监测猴血压和心率)则减少异氟烷的蒸发速度。
1.3.3手术方法:确认猴的麻醉状态适宜手术之后,即按本机构制定的植入子手术标准操作规程完成植入手术。分别在猴的右侧锁骨下方(与身体纵轴垂直,切开约2 cm)、左右两侧腋下第五对肋骨处(平行身体纵轴,切开约5 cm)、左下腹腹斜肌位置(平行身体纵轴,切开约8 cm)、左后肢股动脉位置(与股骨平行,切开约3 cm)先后作切口。左侧腹部腹斜肌钝性分离开口,在肌层下方钝性分离出一个可以放置植入子本体的“口袋”,置入植入子后,先后将压力导管插入左后肢股动脉、心电和呼吸电极导线自皮下建立的通道导引至左右两侧腋下和右侧锁骨下方并固定,完成以上植入操作,肌肉层与皮下组织用4号吸收缝合线分层间断缝合,皮肤3号吸收缝合线皮内连续缝合,全部切口缝合完毕,经鼻饲灌胃双氯芬酸钠胶囊内容物用以术后镇痛,待0.5%头孢西丁钠注射液滴注结束后停止异氟烷吸入。移回猴饲养笼内侧卧放置待苏醒,期间打开植入子电源开关并监测猴心电、血压等参数,观察至术后4 h确认无呕吐、缝合处无开裂与大量渗血,心电、血压等指标无异常后方可关闭植入子电源并离开。
1.3.4术后观察与护理:术后次日起,每日观察并记录受术猴切口的状态,出现疑似感染时及时抽取血样检查血液学与生化学指标,并给予对症治疗。恢复期间鼻饲法灌胃双氯芬酸钠胶囊内容物每日1粒,给药2 d;肌注注射用头孢西丁钠0.5 g/d,给药3 d;每日碘伏擦拭消毒切口至愈合;每日观察缝合处有无开裂、血肿等异常,如有血肿但缝合处无特殊状态,可用注射器穿刺至积液处抽取。至术后7 d起,伤口结痂愈合、无水肿的,称量体质量,抽取血样进行血液生化检测,测量耳温,并开启遥测系统记录猴的心电、呼吸、血压等指标1 h,经分析比较后如各指标正常即认为可进行下一步的安全药理学试验。
1.3.5各类检测指标选择与比较方法: 血常规选取WBC(白细胞)、RBC(红细胞)、HGB(血红蛋白)、PLT(血小板)、NEUT(中性粒细胞)、LYMPH(淋巴细胞)、MONO(单核粒细胞)、EOS(嗜酸性粒细胞)、BASO(嗜碱性粒细胞)、 NEUT(中性粒细胞计数)、LYMPH(淋巴细胞计数)、MONO(单核粒细胞计数)、EOS(嗜酸性粒细胞计数)、BASO(嗜碱性粒细胞计数)进行手术前后比较;生化学选取ALT(丙氨酸转氨酶)、AST(天门冬氨酸转氨酶)、TP(总蛋白)、ALB(白蛋白)、TBIL(总胆红素)、ALP(碱性磷酸酶)、GLU(血糖)、BUN(尿素氮)、Crea(肌酐)进行手术前后比较;心电、呼吸和血压选取HR(心率)、R-H(R波幅度)、P-H(P波幅度)、T-H(T波幅度)、ST-E(ST位移)、QRS(QRS时程)、PR-I(PR间期)、QT-I(QT间期)、QTcb(校正QT间期)、SYS(收缩压)、DIA(舒张压)、Mean(平均压)、呼吸频率等指标与猕猴白昼基础值进行比较;体温进行手术前后比较。
2 结果
2.1 手术结果
2.1.1术前肌注给予注射用头孢西丁钠,对动物实行抗生素覆盖;应用3%戊巴比妥钠1 mL/kg剂量静脉注射诱导麻醉;术前备皮;异氟烷吸入维持麻醉等试验操作均顺利完成,期间无异常。
2.1.2猴术中出血量少、皮下脂肪少、止血快、术野清晰;皮肤与皮下组织易分离、缝合难度较大,缝合操作量多;吸入维持麻醉的程度易控制,术中猴均未见任何异常。一般在术后30 min内恢复意识开始清醒,开始出现睁眼、转头、四肢伸缩等活动,但保持侧卧状态;至术后3~5 h猴可坐或趴卧,活动少;至术后24 h观察均恢复基本的活动能力,正常摄食饮水。
2.1.3术后护理期间,猴神态、活动、饮食、应激反应均正常,各切口术后愈合良好,至术后7 d均可结束护理,转至实验使用,全部猴未见可能因术后恢复不良导致的受术区域的功能异常。术中建立的皮下导管和电极导线通道区域,全部8只猴术后1~2 d均发现至左后肢的压力导管通道位置均出现短期、程度不一的轻度水肿,但无需干预处理,术后3~5 d水肿全部消失。手术前后猴的平均体质量分别为(4.88±0.76)与(4.86±0.70)kg,n=8,配对t检验结果t=0.424(P>0.05);手术耗时(134~260)min,平均(182.0±43.7)min;苏醒耗时(12~24)min,平均(17.5±4.1)min;术后活动起始时间为3~5 h,平均(3.6±0.7)h;后肢在术后1~2 d内均出现水肿,平均(1.4±0.5)d;后肢水肿在术后3~4 d均消退,平均(3.8±0.5)d。
2.2 各类指标手术前后检测结果
2.2.1血常规:对各项5分类血常规指标手术前后配对比较t检验发现:除RBC、HGB、LYMPH三项血液学指标术后检测结果低于手术前之外(P<0.05或P<0.01),其余指标手术前后相似(P>0.05),未见明显变化。详见表1。

表1 猕猴手术前后血常规指标Table 1 Rhesus monkey’s blood routine indicators before and after surgery
2.2.2生化学:对各项生化学指标手术前后配对比较t检验发现:ALT、TP的术后均值低于手术前(P<0.05或P<0.01),AST的术后均值高于手术前(P<0.05),其余指标手术前后均相似(P>0.05),未见明显变化。详见表2。

表2 猕猴手术前后生化学指标Table 2 Rhesus monkey's biochemical indicators before and after surgery
2.2.3心电、血压、呼吸、体温:受术猴术后第7日应用遥测系统检测心电、血压、呼吸等指标,与作者之前获得的猕猴白昼基础值[4]进行单样本t检验比较发现,T波幅度与呼吸频率有少许降低,其余指标手术前后相似,未见明显变化。详见表3。
猕猴体温手术前后测量值分别为(37.3±0.4)℃和(36.9±0.5)℃,配对t检验结果n=8,t=1.943,P=0.093,手术前后无显著性差异。
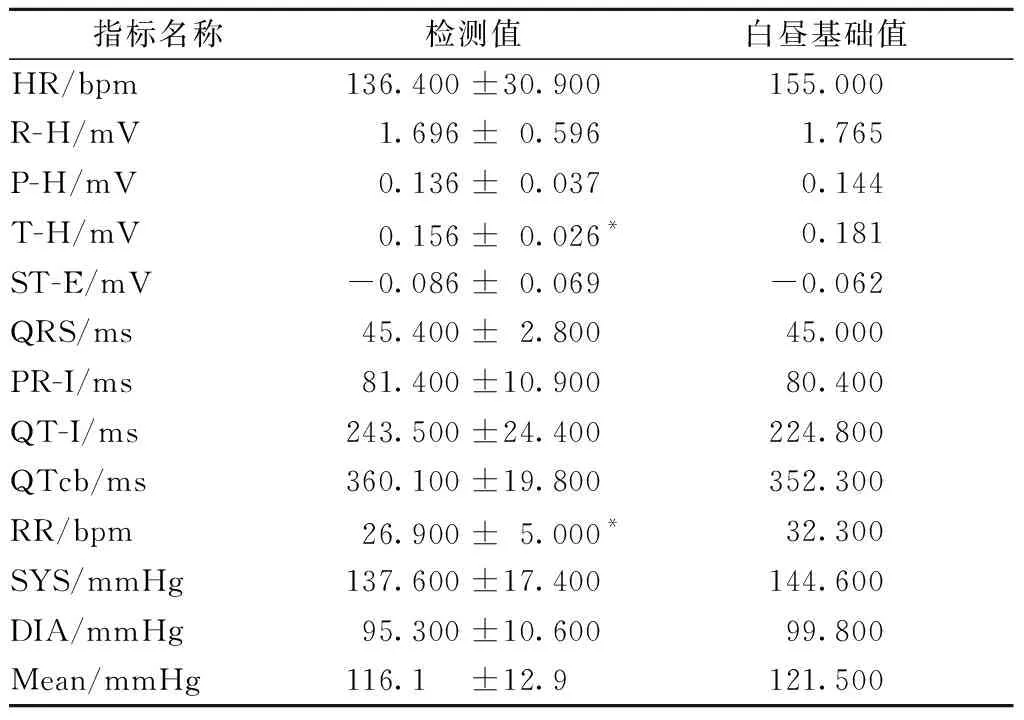
表3 猕猴手术后心电、血压、呼吸指标Table 3 Post-operative ECG, blood pressure, and respiratory index of Rhesus monkey
3 讨论
3.1 结论
通过猕猴遥测系统植入子植入手术实例,成功实施猴应用遥测系统的手术流程,术后愈合良好,提高了遥测动物模型建模的成功率。对国内机构使用植入式遥测系统建立大动物模型在安全药理学研究的应用中起到一定的借鉴作用。
3.2 讨论
3.2.1猴血液学与生化学指标检测发现术后RBC、HGB、ALT、TP的均值低于手术前,AST值高于手术前等变化。上述变化中RBC与HGB降低可能与手术期间失血与术后出血有关,ALT的降低变化无临床意义,但TP降低、AST升高可能与术后愈合过程中创口自修复过程有相关性。呼吸、血压、心电指标与猴白昼基础值比较,仅有术后T波幅度、呼吸频率偏低,考虑大部分心血管系统指标均符合猴的白昼基础值,且各类指标基本偏向于频率减缓(HR)、幅度降低(RH、PH、TH等)、时间延长(QRS、QT、QTc等)的基础值下降的变化趋势,故作者认为T波幅度与呼吸频率降低的变化与术后恢复期间生理指标基础值降低趋势是一致的,并无参考意义。综合血液学、生化学、心血管系统的指标手术前后的变化,可以认为猴手术期间无感染、炎症等不良反应。
3.2.2考虑到猴在试验中的依从性、体质量、年龄和猴的基础卫生状况等因素,围手术期抗生素覆盖的给药剂量参照幼儿给药量给予,给药方式术前与术后使用肌注,术中应用静脉滴注给予。
3.2.3Bertrand等曾报道过异氟烷与七氟烷的麻醉效果相同[5],刘雪萍等也认为异氟烷是效果优秀的全身麻醉药品[6],且异氟烷在国内属易于购买使用的吸入麻醉药,故作者选择异氟烷作为吸入麻醉药物。为保证麻醉效果适于手术并且不会因麻醉程度过深影响手术操作,采用了戊巴比妥钠诱导麻醉与异氟烷吸入维持麻醉结合的方法。在静注戊巴比妥钠时尽可能地缓慢推注并观察猴的反应,发现猴针刺反射消失,肌肉松弛即刻停止推注,尽快完成备皮操作与手术台固定,并更换异氟烷吸入维持麻醉,吸入麻醉的初期若出现四肢的肌肉活动,则增加异氟烷的蒸发速度,待猴进入稳定的适合手术状态后,逐渐减少异氟烷的蒸发速度,并在整个手术过程中保持观察猴的麻醉状态并调节异氟烷蒸发速度。
3.2.4恒河猴皮下脂肪少,故切开皮肤时应避免用力过猛导致切到肌肉组织,考虑到术后创口愈合的速度与缝合方法的要求,作者选择手术刀作切口,仅使用双极电凝器止血。
3.2.5作者进行该试验之前,进行过8例Beagle犬的植入手术,虽出现过个别犬因为抓挠伤口自拆线导致创口开裂,需要重新清创缝合、延长术后护理期的个例,但犬身体结构与活动方式与猴不同,在使用缝合方法时,一般无需考虑自拆线的可能性,皮肤缝合时应用非吸收线间段缝合法即可。并且犬皮下脂肪层较猴多,脂肪层血管分布丰富,在术中分离脂肪层易出血,术后愈合时伤口区域的脂肪组织也容易出现液化,严重时需要引流,并且会延长愈合时间。但猴的受术区域基本无脂肪分布,只需切开后及时止血即可;考虑到恒河猴的依从性极差,前后肢动作灵活与人相似,术后一旦恢复活动能力,猴的自发活动与猴对正常的饲养、护理等操作的应激反应,可能会出现伤口崩裂或擅自拆线行为,对伤口的恢复有一定的影响。所以作者除了选择牢固、可吸收的缝合线之外,在缝合时适当减小针距,减少伤口崩裂的可能,并且缝合皮肤时,所有切口均用皮内连续缝合法缝合皮肤,不再暴露缝线,缝合后伤口闭合牢固,避免了猴抓挠伤口,撕拉缝线的可能性。
3.2.6因植入子本体与股动脉插管之间的压力导管的通道是用医用不锈钢中空管钝性分离建立的,该通道对应位置的水肿/血肿基本上在术后24 h左右才开始出现。其原因可能是建立通道时损伤的小血管虽然有破损,但因为手术期间猴属固定状态,并且麻醉时血压偏低,术后则因为苏醒和恢复活动需要一定时间,待猴可以自由活动后,压力导管通道区域开始渗液/出血,导致水肿/血肿出现,但因为无感染,止血后被自体吸收即恢复正常。
