药物致横纹肌溶解的动物实验研究*
2020-03-23鹿双双汪聿坤胡艳欣卢选成
裴 佩 鹿双双 汪聿坤 胡艳欣 卢选成 王 锐 路 凯
(1.中国疾病预防控制中心,北京 102206)(2.中国农业大学,北京 100193)
横纹肌溶解(Rhabdomyolysis,RM)是多种原因引起的横纹肌细胞膜完整性破坏、肌肉组织溶解,细胞内电解质、肌红蛋白(Myoglobin,MYO)、酶类如肌酸激酶(Creatine Kinase,CK)、醛缩酶、乳酸脱氢酶、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)等释放入血,临床可表现肌肉组织坏死,肢体疼痛、肿胀、功能障碍,往往伴有血尿,严重者可出现急性肾功能衰竭,甚至多脏器衰竭[1-3]。目前明确的导致RM的病因可分为获得性因素及遗传性因素两大类,还有很大一部分病因不明确。哈夫病就是一种由于进食加工后的淡水、海水产品后24 h内突然发生的RM[4],该病首次报道于1924年,至今病因不明,有关研究推测,病例进食的水产品中可能存在一种耐高温的未知致病因子,经口摄入后导致了RM的发生[4]。为了筛选可能含有致病因子的食物样本,为哈夫病病因研究提供线索,须进行动物实验。而目前研究RM的动物实验多采用50%的甘油溶液肌肉注射导致RM的动物模型[5],是一种创伤性RM动物模型,直接损伤肌细胞致病,不适用于哈夫病等非创伤性RM的研究。在非创伤性RM中,约50%的病例因服用药物发病[6],与哈夫病经口摄入而致病的特点相似。我国2000—2018年药源性RM的统计分析显示,他汀类药物引发RM的病例数量最高,占61.06%,与贝特类药物联合使用时RM发生率会升高[7]。因此,本研究通过对Wistar大鼠、ICR小鼠给予辛伐他汀(Simvastatin,SMV)、吉非罗齐(Gemfibrozil,GF)两种药物,观察联合给药及单独给药引起肌肉损伤等生化指标水平的变化情况,筛选出可发生横纹肌溶解的动物,为后续进行哈夫病等病因不明的RM提供参考。
1 材料与方法
1.1 实验动物
SPF级Wistar大鼠5周龄雌性21只、雄性45只,SPF级ICR小鼠5周龄雌性21只,雄性45只,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002,大鼠2只/笼,小鼠5只/笼,饲养在22~26 ℃,日温差≤3 ℃,相对湿度40%~70%,换气次数15次/h,照明时间12 h的负压屏障动物实验设施中,许可证编号:SYXK(京)2017-0021。动物实验方案经中国疾病预防控制中心实验动物福利伦理委员会审核批准(批准文号:2019-CCDC-IACUC-004, 2019-CCDC-IACUC-016),每次实验前动物在设施内适应性饲养7 d,实验期间给予60Co照射灭菌鼠全价颗粒(维持料)饲料及实验动物饮用水,实验过程中按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
吉非罗齐胶囊(广东彼迪药业有限公司,批号:H44021201);辛伐他汀胶囊(湖北舒邦药业有限公司,批号:H20000107);羧甲基纤维素钠(上海嘉禾生物科技有限公司);大鼠、小鼠肌红蛋白酶联免疫分析试剂盒(上海酶联生物科技有限公司,批号:ML720372);肌酸激酶、谷丙转氨酶、谷草转氨酶测定试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号:141518012)。迈瑞BS-240VET全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);PHOMO酶标仪(安图生物公司)。
1.3 实验方法
1.3.1药物的配置及剂量设置:SMV临床成人每日最大摄入量为40 mg/d,GF临床成人用量为600 mg/d,根据药理实验动物间与人体间剂量换算方法[8]及种间差异,得到20 g(标准体质量)小鼠SMV等效剂量为80 mg/kg,GF等效剂量为1200 mg/kg,150 g(标准体质量)大鼠SMV等效剂量为40 mg/kg,GF等效剂量为600 mg/kg。SMV及GF用0.5%CMC制成混悬液。
1.3.2实验动物分组及给药方法:
1.3.2.1不同性别动物进行不同剂量SMV、GF联合给药实验
将大鼠、小鼠各42只,雌雄各半,按种属、性别分开,随机分为4组:低剂量组、中剂量组、高剂量组、对照组,其中高剂量组12只,其余各组10只,剂量如表1。采用灌胃给药的方式,每天给药1次,持续给药14 d。大鼠、小鼠均于7 d、14 d给药后24 h采集血液。
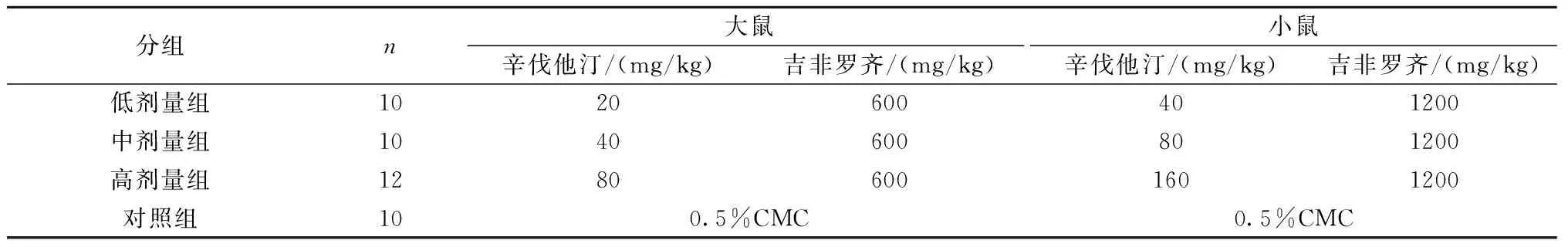
表1 不同剂量SMV、GF联合给药实验分组剂量Table 1 Dosage regime of different dose SMV and GF-administered animals
1.3.2.2SMV、GF联合给药、单独给药实验:将雄性大鼠、小鼠各24只按种属分开后,随机分成4组,SMV&GF组、SMV组、GF组、对照组,分组及给药剂量见表2。每天灌胃给药1次,持续给药14 d。小鼠于给药前、给药7 d、14 d后24 h采集血液,大鼠于给药前、给药3 d、6d、8 d、10 d、12 d、14 d后24 h采集血液。
1.3.3血液样本采集:在麻醉机中加入异氟烷,旋转调节氧气流量计前端的气源阀门,使输出的气体达到所需要的流量(大鼠500~700 mL/min,小鼠300~500 mL/min),打开麻醉机蒸发器,调节诱导浓度为4%,待异氟烷充满诱导盒后,将动物放入,等待2~3 min,待动物完全麻醉,从诱导盒取出,左手固定鼠,压迫颈部使其眼球充分外凸,右手持毛细玻璃管自内眦插入眼睑与眼球之间,略加捻转,使血液自毛细管流入ep管中。大鼠采血量为1 mL,小鼠为0.5 mL。将血液于4 ℃冰箱放置过夜,4 ℃ 5 000 r/min离心15 min,分离血清,-20 ℃冻存。
1.3.4血清生化检测:使用迈瑞BS-240VET全自动生化分析仪测定收集到的血清中CK、ALT、AST含量。使用鼠源MYO酶联免疫分析(ELISA)试剂盒,体外定量检测鼠血清中MYO表达水平(双抗体夹心法)。具体的操作方法严格遵循试剂盒说明书进行操作。

表2 SMV、GF联合给药、单独给药实验分组剂量Table 2 Dosage regime of SMV- and/or GF- administered animals
1.3.5组织学检查:在最后一次采血后对动物实施二氧化碳安乐死,取左后肢的股骨直肌、股二头肌和腓肠肌三个部位骨骼肌,置于10%甲醛固定液中固定。骨骼肌标本在10%甲醛固定液中固定至少24 h,选取CK值高于参考值上限5倍及发生步态不稳、后肢无力或瘫痪等行为学改变的动物肌肉标本,进行苏木精-伊红(HE)染色查看横纹肌溶解情况。
1.4 统计方法
2 结果
2.1 大鼠RM发生情况
2.1.1不同性别、不同剂量组大鼠联合给药血清CK、ALT、AST的表达水平
给药14 d后,低剂量组大鼠的血清CK、ALT、AST与对照组相比显著升高(P<0.05)(表3),雌性大鼠、雄性大鼠之间的差异不具有统计学意义(P>0.05)。其中低剂量组雄性大鼠有2只CK明显升高,1只出现行为学改变(CK值3035.96 U/L),另一只CK值高于参考值上限5倍(CK值4734.72 U/L)。根据这项结果,在后续不同药物实验中采用SMV 20 mg/kg&GF 600 mg/kg这一剂量给药。考虑到性别无显著性差异,为了避免雌性发情周期对生化指标测定的影响,选择雄性大鼠。

表3 不同性别、不同剂量组大鼠血清CK、ALT、AST的表达水平Table 3 serum CK, ALT,AST levels in different SMV dose administered male or female Wistar rats
2.1.2不同药物组大鼠血清CK、MYO、ALT、AST的表达水平及变化趋势
所有大鼠的CK值均未达到参考值上限5倍,也未观察到明显的后肢无力等行为学改变。各组的血清CK、MYO、ALT、AST水平及变化趋势见图1、表4。
与给药前相比,SMV&GF组大鼠血清CK水平在给药10 d后显著升高(P<0.05),达到峰值(1171.20±250.79 U/L),而后一直保持在较高水平,CK水平在给药6 d、10 d、12 d较同时间点对照组升高,差异显著(P<0.05)。血清MYO水平在给药后稍有上升,给药第14天达峰值,但差异不具有统计学意义,给药6 d、8d与同时间点对照组相比降低(P<0.05)。ALT与AST给药10 d后开始显著升高,给药6 d、10 d、12 d、14 d时均高于对照组(P<0.05)。

图1 不同药物组大鼠血清CK、MYO、ALT、AST水平变化趋势Fig.1 Time-dependent changes of serum CK, MYO,ALT, and AST levels in
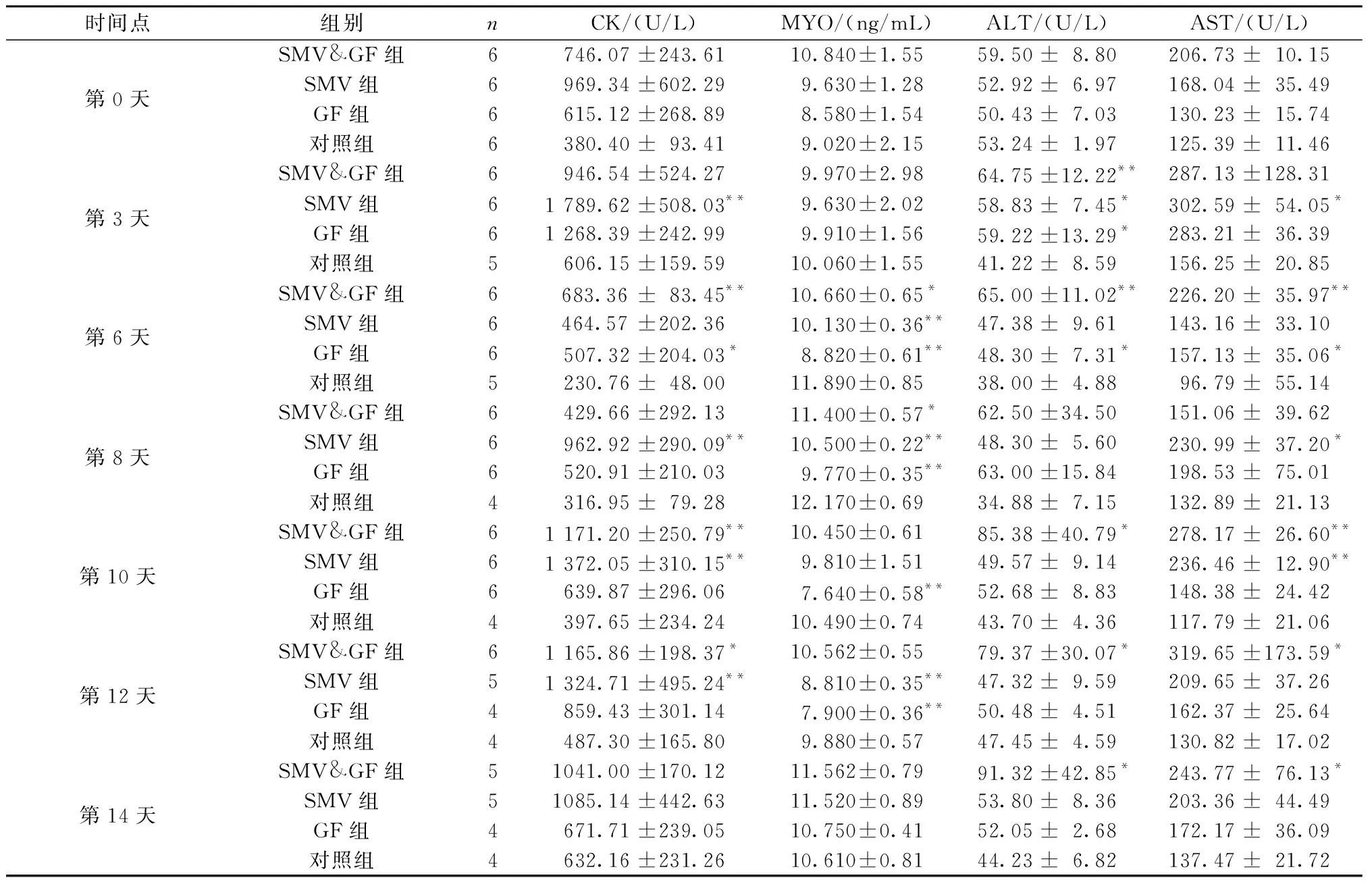
表4 不同药物组间大鼠血清CK、MYO、ALT、AST的表达水平Table 4 Effects of SMV and GF administration serum CK, MYO, ALT, and AST levels in rats
SMV组大鼠血清CK水平波动较大,在给药3 d后达到峰值(1789.62±508.03 U/L),与给药前相比差异有统计学意义(P<0.05),但在给药6 d后降至最低(464.57±202.36 U/L),之后又缓慢上升,第10天达第二高峰,CK水平在给药3 d及8d、10 d、12 d较相同时间点对照组升高(P<0.05)。血清MYO水平在给药前后的差异不具有统计学意义,与对照组相比,给药6 d,8 d,12 d时低于对照组(P<0.05)。血清ALT给药3 d时出现一过性升高(P<0.05),且高于对照组(P<0.05)。血清AST水平同样在给药3 d时一过性升高(P<0.05),随后降低,与对照组相比,给药3 d、8 d、10 d时AST显著升高(P<0.05)。
GF组大鼠血清CK给药3 d后一过性升高(P<0.05),给药6 d后与对照组相比有所上升(P<0.05)。血清MYO给药前后差异无统计学意义(P>0.05),给药3 d、6 d、8 d、12 d时低于对照组(P<0.05)。血清ALT、AST给药3 d时高于给药前,且高于对照组(P<0.05)。
2.1.3大鼠骨骼肌肉组织病理学变化
对1只对照组大鼠、1只血清CK水平超过参考值上限5倍(CK值4734.72 U/L)的SMV&GF组大鼠、1只出现后肢无力表现(CK值3035.96 U/L)的SMV&GF组大鼠所采集骨骼肌标本进行HE染色病理检查。对照组大鼠(图2-A-2)骨骼肌细胞呈长形,可看到交错的横纹;出现行为学改变的大鼠(图2-C-1,图2-C-2)肌纤维严重坏死、消失,肌纤维间可见大量的淋巴细胞、多核巨细胞、巨细胞、嗜中性粒细胞等炎性细胞浸润;CK值超过参考值上限5倍的大鼠(图2-B-1,图2-B-2)病理检查未见明显异常。

图2 大鼠骨骼肌病理变化(HE染色)Fig.2 Histological examination of the skeletal muscle in rats(HE staining)
2.2 小鼠RM发生情况
2.2.1不同性别、不同剂量组联合给药小鼠血清CK、ALT、AST的表达水平
给药14 d后,中剂量组雄性小鼠的血清CK水平与对照组相比有所升高(P<0.05),不同性别的小鼠间CK、ALT水平差异具有统计学意义(P<0.05),雄性小鼠高于雌性小鼠。根据这项结果,在不同药物给药实验中均采用SMV80 mg/kg&GF1 200 mg/kg这一剂量对雄性小鼠进行实验。其中,3只小鼠CK值超过参考值上限的5倍,均为低剂量组雄性小鼠;所有小鼠均未观察到明显行为学改变。

表5 不同性别、不同剂量组小鼠血清CK、ALT、AST的表达水平Table 5 Serum CK、ALT、AST levels in different SMV dose administeredmale or female ICR mice
2.2.2不同药物组小鼠血清CK、MYO、ALT、AST的表达水平及变化趋势
由图3可知,SMV&GF组小鼠血清CK水平在给药后持续升高,给药14 d达到峰值,血清MYO水平在给药14 d较给药前稍有上升,血清ALT、AST给药第7天后稍有降低,并于给药14 d上升,但与给药前相比差异不具有统计学意义(P>0.05)。SMV组与GF组小鼠的血清CK、MYO、ALT、AST给药前后差异不具有统计学意义(P>0.05)。不同给药组小鼠与对照组相比血清CK、ALT、AST水平差异无统计学意义(P>0.05),SMV&GF组、SMV组小鼠给药14 d时血清MYO水平较对照组升高(P<0.001),其他血清指标结果无显著性差异(P>0.05)。血清CK值高于参考值上限5倍的小鼠有2只,均为SMV&GF组小鼠(2430.17 U/L,3245.16 U/L),但同组的其余4只小鼠CK值均未升高。所有小鼠均未观察到行为学改变,见表6。

表6 不同药物组小鼠各时间点血清CK、MYO、ALT、AST的表达水平Table 6 SMV and GF administrationon serum CK, MYO, ALT, and AST levels in mice

图3 不同给药组小鼠血清CK、MYO、ALT、AST水平变化趋势Fig.3 Time-dependent changes of serum CK, MYO,ALT and AST levels in
3 讨论
药物因素在RM获得性非创伤性病因中占很大一部分[9-10],通过动物实验研究,筛选出能发生药物相关RM的实验动物,对研究非创伤性RM如哈夫病具有参考价值。本研究选择SMV、GF两种药物探索在不同性别的ICR小鼠、Wistar大鼠中造成RM的情况,发现Wistar大鼠在SMV、GF联合给药时肌酸激酶升高,发生肌肉损伤,为后续进行哈夫病动物实验提供了参考,也为建立药物相关RM动物模型奠定了基础。
目前临床中导致RM的药物主要是用作降脂的他汀类药物,即HMG-CoA还原酶抑制剂,包括SMV、普伐他汀、洛伐他丁、阿托伐他汀等,常与贝特类抗高三酰甘油药物联合用于治疗混合型高脂血症和单一用药不能控制的高脂血症[11]。其中,西立伐他汀与贝特类代表药物GF联用曾导致了大量病例死亡,迫使西立伐他汀全球撤市[12]。他汀类药物的肌肉毒性风险由高至低排序依次为西立伐他汀、SMV、洛伐他汀、普伐他汀[13]。因此,本研究采用SMV、GF两种药物联合给药进行探究。
肌细胞损伤是RM的主要表现,血清中CK、MYO、ALT、AST的含量反映肌细胞内容物入血情况[14-16]。临床上RM的诊断标准为肌肉疼痛伴有血清CK值上升到参考值上限5倍以上[11]。血清中ALT、AST水平常常升高,MYO会超过血清球蛋白的结合能力,被转运至肾小球最终随着尿液排出。本研究通过检测CK、MYO、ALT、AST的水平来衡量RM的发生情况。结果表明,20 mg/kgSMV和600 mg/kgGF 联合给药,Wistar大鼠灌胃10 d后,可以引起大鼠血清CK、ALT、AST水平明显升高,与给药前及同时间点对照组相比差异具有统计学意义(P<0.05);CK水平超过50日龄Wistar大鼠CK值参考值[17],但未达到临床RM诊断标准。造成这一结果的原因可能是啮齿类动物与人类之间对药物的敏感性不同,且动物的个体差异较大,临床上CK的参考值为18.0~198.0 U/L,而Wistar大鼠CK参考值为443.22~942.28 U/L,C57/BL6小鼠CK 97.5%置信区间值为377 U/L,啮齿类动物的CK值比人类高且波动范围更大。RM临床诊断标准可能并不能完全适用于实验动物,在实验中阴性对照组及基线CK水平的参考十分重要。在给药6 d后血清CK、ALT、AST与对照组相比有所升高,但在第8天有所下降,可能自给药第6天起就发生了肌肉损伤,但由于机体自适应及血清肌酶的半衰期,被机体代偿清除[18]。单一给予SMV组的大鼠给药3 d后血清CK、ALT、AST出现了一过性升高,在给药前血清CK(969.34±602.29 U/L)高于参考值上限,对给药后的CK造成了一定影响。单一给予GF的大鼠给药3 d后血清CK、ALT、AST出现了一过性升高,也未能引起大鼠出现稳定的肌肉损伤改变,这与既往GF对SD大鼠未造成明显肌肉毒性的研究结果是一致的[19-20]。与大鼠相比,小鼠在SMV、GF联合给药后,CK值并未普遍升高,单独给药也未引起CK升高,小鼠对肌肉毒性药物不敏感。本研究CK水平并未发现有剂量效应相关性,与流行病学研究发现西立伐他汀临床用药肌肉毒性与剂量有相关性[21]这一结论不一致。
本研究中各组MYO值与给药前相比差异均无统计学意义,与对照组同期相比,甚至有降低的情况,可能是由于血清MYO值受以下因素的影响:一是血清MYO清除速率快于CK,通常在CK值升高前就有所升高并在CK值下降前降至正常[22]。二是本研究中MYO值的测定采用酶联免疫分析法,溶血可能会造成结果误差。因此,检测血清MYO对RM的诊断敏感性不高。
肌肉活检是确诊RM的金标准,但在临床中并非必须的检查[23]。本研究中对2只SMV&GF组大鼠骨骼肌进行病理检查,RM表现检出率为50%,且CK值高的大鼠并未发现病理改变,说明CK水平与病理损伤程度并非呈正比关系。但值得注意的是,出现行为学改变的大鼠在给药第4天时观察到胸口处有鼓包现象,判断可能是灌胃造成食管损伤所致,后鼓包有所吸收,与同组其他大鼠相比,这只大鼠明显精神差、毛发乱、活动度降低。灌胃损伤可能加剧了药物导致的RM症状,具体原因还需要进一步的研究。
因为本研究未对所有动物进行统一评分的肌肉病理检查,不能明确RM的组织学确诊情况,因此不能评判SMV、GF联合给药在Wistar大鼠中是否成功建立了具有可重复性的药物相关RM动物模型。但本研究结果显示Wistar大鼠是建立模型的良好选择,对药物表现较为敏感。
综上所述,本研究通过对两种性别的Wistar大鼠、ICR小鼠进行药物因素相关动物实验研究,大鼠在SMV、GF的联合作用下,出现了肌酸激酶升高的RM症状,在进行哈夫病动物实验研究时,可考虑使用Wistar大鼠。ICR小鼠对SMV和GF的联合及单独给药作用表现不敏感。
