探究左旋甲状腺素治疗孕期母鼠亚临床甲减的最佳时期
2020-03-23罗才全李小兰
王 鑫 罗才全 李小兰 唐 雪
(1. 重庆市黔江中心医院产科,重庆 409000)(2. 重庆市黔江中心医院消化内科,重庆 409000)
甲状腺疾病是仅次于育龄妇女妊娠糖尿病的第二大妊娠期内分泌疾病,与胎儿有着紧密联系。因此,甲状腺疾病直接导致不良妊娠结局,严重影响胎儿的远期认知发育。妊娠期合并甲状腺功能减退症发生率为0.5%~0.6%,且呈逐年递升趋势[1],其中临床甲状腺功能减退症为0.3%~0.5%,亚临床甲状腺功能减退症为2.0%~3.0%[2],占甲减患者90%以上。亚临床甲减(subclinical hypothyroidism,SCH)是一种由于甲状腺激素(TH)合成和生理效应不足引起的全身性疾病,因其临床表现不明显而易被忽略。文献报道[3]SCH可增加孕妇抑郁症的发病率,也有相关研究表明[4]SCH可增加妊娠不良结局风险、降低后代智力商数(Intelligence quotient,IQ)评分,说明SCH与妊娠结局以及胎儿健康之间存在一定的相关性。但因SCH具体作用机制不清,因此本研究主要通过建立孕期母鼠亚临床甲减模型,在不同孕期进行左旋甲状腺素(L-T4)替代治疗,监测孕期母鼠亚临床甲减对仔鼠脑部发育的影响,从而获取孕期母鼠治疗的最佳时期。
1 材料与方法
1.1 实验动物
选取150只SPF级Wistar雌鼠,体质量为180~200 g,购买于重庆医科大学动物实验室,饲养于该大学实验动物部SPF级动物饲养中心,温度为(23±4)℃,相对湿度50%,自由摄取食物和水,合格证号:SCXK(渝)2020-023。2周后按数字表法随机分为6组(n=25):①对照组;②甲减组;③亚甲减组;④亚甲减治疗A组;⑤亚甲减治疗B组;⑥亚甲减治疗C组。
1.2 动物模型制备
对照组(n=25):大鼠称质量后,10%水合氯醛腹腔注射麻醉后行甲状腺切除术,术后1个月,皮下以每日0.95 μg/100 g体质量剂量注射血清白蛋白(BSA)的PBS溶液,作为阴性对照液。
甲减组(n=25):大鼠称质量后,10%水合氯醛腹腔注射麻醉后行甲状腺切除术,术后1个月皮下注射等量BSA的PBS溶液,采取眶后静脉血检测甲状腺功能,当促甲状腺激素(Thyrotropin,TSH)高于正常,总甲状腺素(Total thyroxine,TT4)低于最低值(<1 μg/dL),提示甲状腺完全切除,成功建立完全甲减模型,若甲状腺切除不完全则淘汰。
亚甲减组(n=25):大鼠称重后,开始皮下注射L-T4,将L-T4装入泵中,以每日0.95 μg/100 g体质量剂量持续泵入,根据体质量相应调整剂量。10 d后采取眶后静脉血,检测甲状腺功能,当TSH高于正常,而TT4在正常范围内,提示亚临床甲减模型建立成功。作为阳性对照组。
亚甲减治疗A组(n=25):在亚临床甲减模型基础上,于孕10 d时每日以1.25 μg/100 g体质量剂量持续泵入L-T4,使孕10 d后血清TSH水平正常。
亚甲减治疗B组(n=25):在亚临床甲减模型基础上,于孕13 d时每日以1.25 μg/100 g体质量剂量持续泵入L-T4,使孕13 d后血清TSH水平正常。
亚甲减治疗C组(n=25):在亚临床甲减模型基础上,于孕17 d时每日以1.25 μg/100 g体质量剂量持续泵入L-T4,使孕17 d后血清TSH水平正常。
将成功创建各模型的150只SPF级Wistar雌鼠按2∶1与正常雄鼠交配,把发现阴道栓的时间确定为妊娠0天,标记为E0。亚甲减组模型选其中25只孕鼠继续以每日0.95 μg/100 g体质量剂量持续泵入L-T4至产后21 d,标记为P21;剩余100只孕鼠在妊娠第10、13、17天开始以每日1.25μg/100 g体质量剂量持续泵入L-T4至产后21 d,分别标记为E10、E13、E17。
1.3 孕期母鼠妊娠血清指标检测
所有模型母鼠孕前、E10、E13、E17抽取眶后静脉丛血,测定孕鼠血清中TSH、TT4水平含量。在孕鼠孕后标记存活仔鼠数,出生第3天时择优选取16只,并于出生第3、7、40天(分别标记为P3、P7、P40)时对仔鼠称其质量,并检测与脑发育的相关指标。
采用酶联免疫法测定孕鼠血清TSH、TT4水平含量;采用Nissl染色法观察大脑皮质和海马形态学变化;采用Morris水迷宫实验法检测仔鼠学习记忆能力。
1.4 统计方法
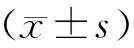
2 结果
2.1 孕期母鼠血清TSH、TT4水平比较
结果见表1、图1和图2。各孕龄甲减组孕期母鼠血清TSH明显高于同时间对照组(P<0.05);亚甲减组孕前及E10时孕期母鼠血清TSH水平高于同时间对照组(P<0.05);亚甲减治疗B组、C组E13时孕期母鼠血清TSH水平高于同时间对照组(P<0.05),且亚甲减治疗C组E17时孕期母鼠血清TSH水平高于同时间对照组(P<0.05)。各孕龄对照组、甲减组、亚甲减组孕期母鼠血清TT4水平无差异(P>0.05)。

表1 孕期母鼠血清TSH、TT4水平比较Table 1 Comparison of serum TSH and TT4 levels in pregnant mothers

图1 不同组别血清TSH水平变化Fig.1 Changes of serum TSH levels in different groups
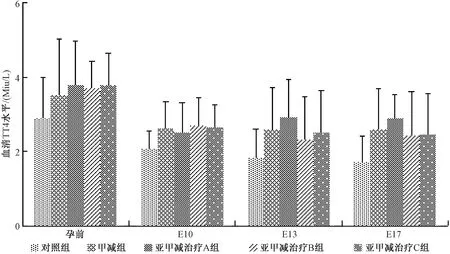
图2 不同组别血清TT4水平变化Fig.2 Changes of serum TT4 levels in different groups
2.2 发育期各组仔鼠的体质量水平比较
结果见图3~图5。P3、P7时亚甲减组仔鼠体质量低于对照组(P<0.05);P7、P40时甲减组仔鼠体质量明显低于对照组(P<0.05)。P3时甲减组仔鼠体质量低于亚甲减组(P<0.05);P7时甲减组仔鼠体质量显著低于亚甲减治疗A组、B组(P<0.05);P40时甲减组仔鼠体质量低于亚甲减治疗B组、C组(P<0.05)。
2.3 不同组别仔鼠逃避潜伏期时间变化
在Morris水迷宫实验中,如图6所示,亚甲减治疗A、B组仔鼠在各时间段逃避潜伏时间与对照组相比无明显差别(P>0.05),但亚甲减治疗C组在各时间段逃避潜伏时间与对照组相比明显延长(P<0.05)。
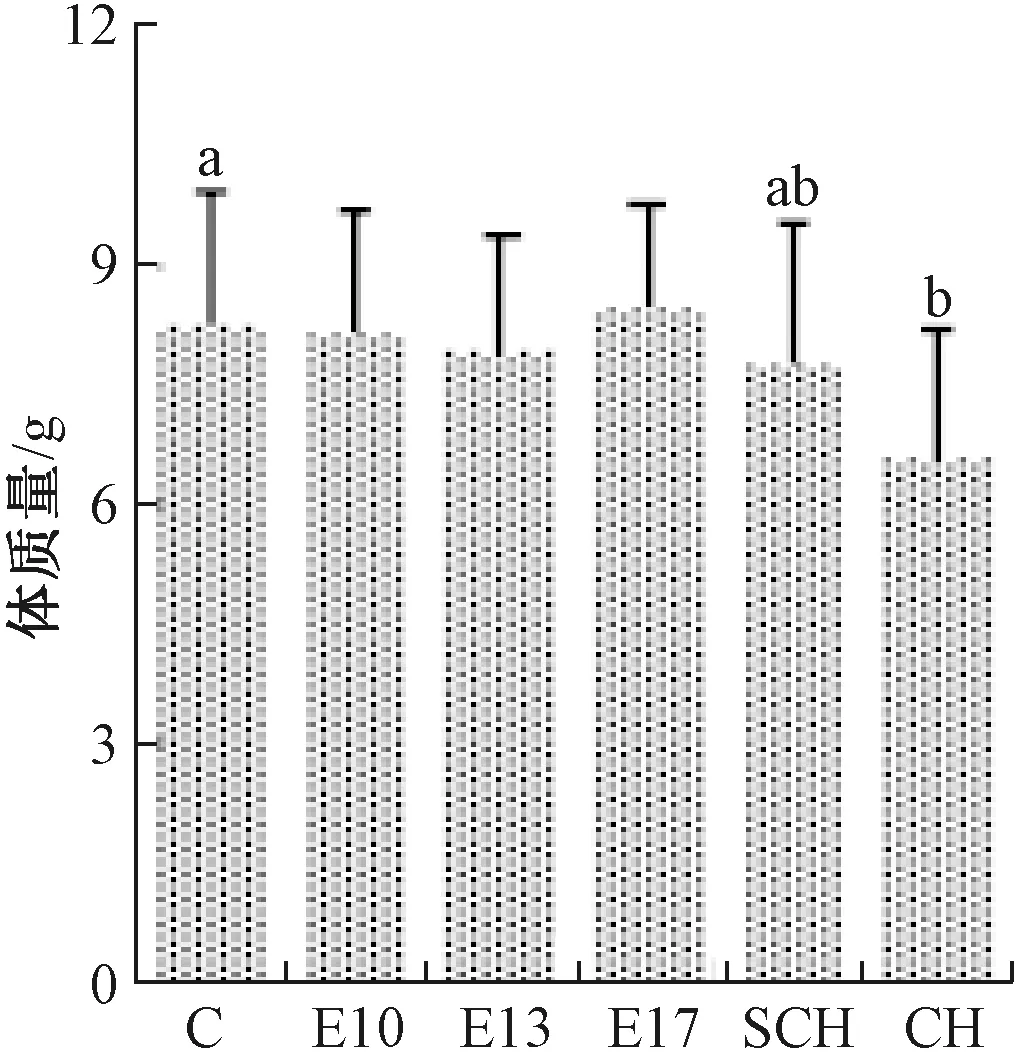
图3 出生第3天(P3)注:与对照组比较,aP<0.05;与临床甲减组比较,bP<0.05Fig.3 Day 3 of birth (P3)Note: compared with control group, aP<0.05; compared with clinical hypothyroidism,bP<0.05

图4 出生第7天(P7)Fig.4 Day 7 of birth (P7)

图5 出生第40天(P40)Fig.5 Day 40 of birth (P40)

图6 不同组别仔鼠逃避潜伏期时间变化Fig.6 Temporal variation of escape latencyin offspring of different groups
2.4 各组仔鼠皮质及海马形态学变化
皮质形态学变化(图7):P7、P40时对照组与亚甲减治疗A组、B组仔鼠皮质各层神经细胞排列整齐,有典型桶状结构,界限清晰;亚甲减组、亚甲减治疗C组与甲减组仔鼠皮质各层神经细胞排列紊乱,且锥体细胞较小。

图7 各组仔鼠皮质形态学变化注:A:对照组;B:亚临床甲减治疗A组;C:亚临床甲减治疗B组;D:亚临床甲减治疗C组;E:亚临床甲减组;F:甲减组Fig.7 Morphological changes of cortex in offspring of each groupNote:A:control group; B:Subclinical hypothyroidism treatment group A; C:Subclinical hypothyroidism treatment group B; D:Subclinical hypothyroidism treatment group C; E: Subclinical hypothyroidism group; F:Hypothyroidism group
海马形态学变化(图8):P7、P40时对照组与亚甲减治疗A、B组仔鼠海马锥体神经细胞排列整齐,界限清晰,可见多层细胞;亚甲减组、亚甲减治疗C组与甲减组仔鼠皮质各层神经细胞排列紊乱、稀疏,无明显界限。

图8 各组仔鼠海马形态学变化注:A:对照组;B:亚临床甲减治疗A组;C:亚临床甲减治疗B组;D:亚临床甲减治疗C组;E:亚临床甲减组;F:甲减组Fig.8 Morphological changes of hippocampus in offspring of each groupNote:A:control group; B:Subclinical hypothyroidism treatment group A; C:Subclinical hypothyroidism treatment group B; D:Subclinical hypothyroidism treatment group C; E: Subclinical hypothyroidism group; F:Hypothyroidism group
3 讨论
TSH可促进甲状腺分泌TH,而TH可促进胎儿大脑成熟发育。妊娠前期TH主要来源母体,妊娠12周胎儿自行分泌,但胎儿直至妊娠中期甲状腺功能才完全建立,因此母体的TH对胎儿脑部发育至关重要[5-6]。而SCH是以血液中TSH水平升高、血清甲状腺激素(FT3、FT4)正常为基本特征的内分泌代谢疾病[7-8]。SCH治疗不及时极易转化为典型甲减。目前,临床应用甲状腺素替代治疗甲减方式较为普遍。研究发现[9-10]L-T4能降低SCH孕妇血清中促甲状腺激素水平,对改善妊娠结局有积极意义。其用药原则为每日注射最小剂量的L-T4,以便获得最佳效果[11]。
本研究结果显示各孕龄甲减组孕期母鼠血清TSH明显高于同时间对照组(P<0.05),亚甲减组孕前及E10时孕期母鼠血清TSH水平高于同时间对照组(P<0.05);各孕龄对照组、甲减组、亚甲减组孕期母鼠血清TT4水平无差异(P>0.05)。与亚临床甲减血清TSH、TT4改变相符合,说明模型建立成功。观察仔鼠体质量变化发现P3、P7、P40时亚甲减组仔鼠体质量低于对照组(P<0.05),其中P3时甲减组仔鼠体质量低于亚甲减组(P<0.05);P7时甲减组仔鼠体质量显著低于亚甲减治疗A组、B组(P<0.05);P40时甲减组仔鼠体质量低于亚甲减治疗B组、C组(P<0.05)。与田利民等[12]关于左旋甲状腺素替代治疗对孕期亚临床甲状腺功能减退大鼠的影响一致,说明亚临床甲减激素血清学发生改变,且对亚甲减组治疗后可影响仔鼠体质量正常发育。Morris水迷宫实验为一种空间辨别的学习记忆模型,其机制与海马大脑皮质相关[13]。研究发现亚甲减治疗A、B组仔鼠在各时间段逃避潜伏时间与对照组相比无明显差别(P>0.05),但亚甲减治疗C组在各时间段逃避潜伏时间与对照组相比明显延长(P<0.05),说明亚甲减组仔鼠学习记忆能力受损。进一步观察仔鼠皮质及海马形态学变化发现:P7、P40时对照组与亚甲减治疗A组、B组仔鼠皮质各层神经细胞排列整齐,有典型桶状结构,界限清晰;亚甲减组、亚甲减治疗C组与甲减组仔鼠皮质各层神经细胞排列紊乱,且锥体细胞较小;P7、P40时对照组与亚甲减治疗A组、B组仔鼠海马锥体神经细胞排列整齐,界限清晰,可见多层细胞;亚甲减组、亚甲减治疗C组与甲减组仔鼠海马锥体神经细胞排列紊乱、稀疏,无明显界限,与康苏娅和汪云[14]关于左旋甲状腺素对亚临床甲状腺功能减退对子代神经发育的影响一致,表明亚临床甲减导致仔鼠海马与皮质神经细胞排列紊乱,可能与仔鼠学习记忆能力受损有关。若在E13前给予L-T4治疗,可纠正神经细胞紊乱状态,E17后对已经排列紊乱的神经细胞无作用。
综上所述,亚临床加减可明显影响体质量正常发育,降低后代学习记忆能力,若在E13之前给予L-T4治疗可逆转该损害,改善妊娠不良结局。
