多肽螯合钙的研究进展
2020-03-23赵梓月王思远廖森泰穆利霞邹宇晓
赵梓月,王思远,廖森泰,*,穆利霞,邹宇晓
(1.广东省农业科学院蚕业与农产品加工研究所,广东广州510610;2.广东省农产品加工重点实验室,广东广州510610;3.农业农村部功能食品重点实验室,广东广州510610)
钙是人体中最丰富的无机元素,在人体生命活动中起着极为重要的作用。若钙摄入量不足,会导致骨质疏松、佝偻病、骨质软化等疾病[1]。随着全球老龄化的加剧,骨质疏松患者逐年递增,中老年人骨质疏松已成为一个重要的公共健康问题,被世界卫生组织称为“无声无息的流行病”。女性更年期后,高龄骨折直接或间接的致死率已持平于乳腺癌[2]。因此,补钙对人体非常重要,婴幼儿、老人及孕妇等人群对补钙的需求则更高。
目前,补钙主要以补充离子钙为主,如碳酸钙、乳酸钙、葡萄糖酸钙等。这些离子钙溶解性较差,吸收时需消耗大量胃酸,吸收率和生物利用率低,在肠道中易形成钙沉淀[3],对肠胃有一定刺激性,过量摄入甚至有可能引发动脉粥样硬化痉挛,血管钙化及软组织钙化、肾结石等疾病。而氨基酸、多肽分子可与钙离子发生螯合反应,所形成的肽钙复合物结构稳定,在消化过程pH 值变化时仍保持可溶且不易发生化学变化,可在肠道内通过特定通道直接被吸收,吸收速度快且吸收量大。与氨基酸相比,小肽的吸收具有耗能少,运输速度快,不易饱和等优点[4]。目前市场上已开发有钙酪蛋白磷酸肽咀嚼片、可溶性海藻钙肽粉、胶原蛋白钙肽粉等产品,肽钙螯合物作为新一代钙补充剂,开发前景广阔。
1 肽钙结合机制研究
目前关于肽钙结合机制的研究发现有磷酸基团-钙、羧基-钙、氨基酸-钙等模式,其结合模式如图1所示。
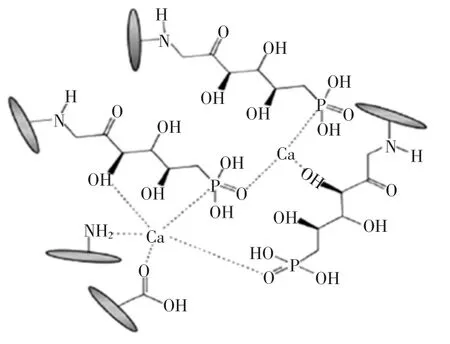
图1 肽钙结合模式Fig.1 Peptide calcium binding mode
1.1 磷酸基-钙结合模式
酪蛋白磷酸肽(casein phosphopeptides,CPPs)和卵黄磷蛋白磷酸肽(phosvitin phosphopeptides,PPPs)是磷酸基-钙结合模式的代表。CPPs 是目前为止发现的促钙吸收效果最好的短肽,已作为钙强化剂广泛应用于婴幼儿食品及其它补钙类功能食品当中。牛乳中含有约80%的酪蛋白,酪蛋白经胃蛋白酶消化后生成酪蛋白多肽衍生物并被磷酸化,即生成CPPs,实际上是一系列含有磷酸丝氨酸簇的短肽-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-。Ferraretto 等发现,该核心序列上的磷酸丝氨酸残基可与钙结合可形成Ca3(PO4)2纳米团簇,从而聚集钙离子并引起细胞对钙的摄取[5]。CPPs 在动物和人体小肠内能与钙结合,防止钙沉淀产生,使肠内溶解性钙的浓度大大增加,从而促进钙的吸收和利用,同时还可促进锌、镁、铁等的吸收,并防止龋齿[6]。
磷酸基-钙结合模式的钙结合能力与磷酸化水平有关。与酪蛋白相似,卵黄高磷蛋白也是高度磷酸化蛋白,磷含量高达8.2%,其相对分子量约为35 000 Da,由216 个氨基酸残基组成,其中丝氨酸残基更为丰富,有124 个,占总氨基酸含量的56%,并且90%以上被磷酸化。研究表明,当对CPPs 和PPPs 进行脱磷处理后,其结合钙活性基本丧失,这充分说明这些肽是依靠磷酸基团与钙结合。另外,Jiang 等利用胰蛋白酶水解卵黄高磷蛋白后,用碱法脱磷将PPPs 处理成17.5%~96.3%不同磷酸化程度的多肽,研究其与钙结合能力后发现,含35%磷酸化的PPPs 对增强钙结合能力和抑制不溶性磷酸钙的形成是最有效的[7]。
对于磷酸肽来说,钙结合性能也与分子大小有关。Jiang 等通过胰蛋白酶消化制备了两种不同分子量的磷酸肽(PPPs)片段,结果表明,小于1 kDa 的片段不可与Ca2+结合,而1 kDa~3 kDa 的片段显示出比CPPs更好的可溶性钙结合能力[8]。
钙结合性能力可能还与磷酸丝氨酸残基的数量和位置有关。Zong 等研究了磷酸肽的分子结构与钙结合性能之间的关系,基于酪蛋白磷酸肽的核心结构,分别用0~3 个连续或不连续的磷酸化丝氨酸合成了6 种磷酸肽,发现磷酸丝氨酸含量越高,钙结合活性越强,磷酸丝氨酸之间相隔一个氨基酸排列比连续排列活性强[9]。Choi 等从蛋黄中提取出纯化的卵黄高磷蛋白肽,研究发现,卵黄高磷蛋白肽与钙的质量分数比高于1.0 时,钙溶解能力远高于商业酪蛋白磷酸肽(CPPs)[10]。
1.2 羧基-钙结合模式
除磷酸基-钙结合外,Ca2+还可与肽中特定的基团结合,研究发现最多的是羧基-钙结合模式,这类肽分子中天冬氨酸(Asp)或谷氨酸(Glu)含量较高,可提供易与Ca2+结合的羧基位点。Bao 等研究发现大豆蛋白肽(soybean protein hydrolysates,SPHs)的钙结合能力与羧基基团呈线性相关,并且最可能的钙结合位点是Asp 和Glu 的羧基[11]。目前研究制备出的具有促进钙吸收作用的非磷酸化肽,如乳清蛋白衍生肽(-Glu-Gly-、-Phe-Asp-)[12-13]、牛血清蛋白衍生肽(-Asp-Asn-Leu-Pro-Asn-Pro-Glu-Asp-Arg-Lys-Asn-Tyr-Glu-)[14]、猪血浆蛋白衍生肽(-Val-Ser-Gly-Val-Glu-Asp-Val-Asn-)[15]、太平洋鳕鱼骨胶原肽(Gly-Pro-Glu-Gly,Gly-Glu-Lys)[16]和大豆蛋白肽(-Asp-Glu-Gly-Glu-Gln-Pro-Phe-Pro-Phe-Pro-)等[17],结构中都含有谷氨酸或天冬氨酸,可通过羧基与钙结合。
1.3 其他模式
有研究发现一些其他的氨基酸和基团也能参与钙的结合。如从虾废弃物中得到的钙离子结合活性肽由3 个氨基酸组成,且不带有负电基团,只含有组氨酸和半胱氨酸[18]。Zhao 等从乳清蛋白水解物中分离出可与钙结合的特异性肽,鉴定出其序列为-Phe-Asp-,并发现其酰胺基和羧基参与了螯合作用,羧基的氧原子和酰氨基的氮原子通过供给电子与钙形成配位键[13]。
同时,分子量大小也可能对钙结合特性产生影响。Lv 等的研究表明当大豆蛋白多肽复合钙(soybean protein hydrolysates-calcium,SPH-Ca) 分子量达到10 kDa~30 kDa 时可促进钙的吸收[19]。Liu 等研究了小麦胚芽蛋白肽(wheat germ protein hydrolysates,WGPHs)结合钙的能力,分离出分子量<2 000 Da 的肽段钙结合能力较高,该肽段主要由Glu、Arg、Asp 和Gly 组成,并发现钙结合能力与WGPHs 中的疏水氨基酸含量有关[20]。
2 肽钙螯合物的制备、分离纯化及检测方法
2.1 肽钙螯合物的制备
2.1.1 直接法
目前,肽钙螯合物的制备方法主要先将蛋白水解为多肽,再与CaCl2等钙源反应而成,其螯合效率与蛋白水解度、反应时间、pH 值、温度、肽钙比等因素有关。Charoenphun 等采用不同蛋白酶对罗非鱼蛋白进行酶解后发现,钙结合能力与蛋白酶的种类和水解度有关,选用Alcalase 酶水解,底物浓度65 mg/g,当水解度为27.7%时,所制多肽的钙结合能力最强,序列为Trp-Glu-Trp-Leu-His-Tyr-Trp,其分子量约为1.2 kDa[21]。此外,Chen 等用胃蛋白酶(pH1.8、40 ℃、5 h),胰蛋白酶(pH8.0、40 ℃、5 h)和风味蛋白酶(pH7.0、50 ℃、5 h)分段水解罗非鱼鱼鳞获得鱼鳞多肽-Asp-Gly-Asp-Asp-Gly-Glu-Ala-Gly-Lys-Ile-Gly-(tilapia scale protein hydrolysate,TSPH),然后向 10 %TSPHs 中添加Ca2+至 1.3 mol/L,50 ℃条件下反应 30 min 制得肽钙复合物TSPH-Ca。进一步通过动物实验发现,该肽钙复合物TSPH-Ca 可显著改善缺钙大鼠股骨的物理和生物力学性能,在预防钙缺乏和提高钙生物利用度方面效果良好[22]。
与酶解法不同,Wang 等利用枯草芽孢杆菌HYT液态发酵黄瓜籽粕,接种量8%,28 ℃发酵2 d 制得黄瓜籽多肽(cucumber seed peptide,CSP),再用超滤方式筛选出其中多肽组分CSP3(<6 KDa)与钙结合能力最佳,并发现CSP3 和CSP3-Ca 二级结构有很大差异,钙离子与CSP3 中的金属结合位点羧基氧、羟基氧、氨基氮等发生了反应,影响了其构象[23]。
2.1.2 修饰改性
修饰改性是蛋白及多肽加工中常用的技术手段,包括物理、化学、酶法、基因工程改性等方法。通过改性可改变多肽结构进而提高其钙结合能力,目前的研究中有利用磷酸化和脱酰胺化等化学法对金属多肽进行改性研究。温庆辉对珠蚌肽进行磷酸化改性后与钙螯合,珠蚌肽经磷酸化改性后钙质量分数由3.3%增加到7.3%,这可能是由于多肽经过磷酸化改性后电负性增加,进而使其持钙能力增强[24]。Zhu 等利用加热法在人造胶原(human-like collagen,HLC)中引入活性磷酸基团后与钙结合制备出了磷酸化人造胶原钙复合物(phosphorylated human-like collagen calcium,PHLC-Ca)。用PHLC-Ca 饲喂缺钙小鼠后发现,骨密度、骨钙含量等均优于CaCl2、葡萄糖酸钙,是一种良好的补钙制剂[5]。崔宇等利用酸法和酶法对大豆肽进行脱酰胺改性,结果显示,酸法和酶法脱酰胺均可改善大豆肽螯合钙的能力,但酸法脱酰胺效果更佳,且发现先酶解再脱酰胺的方式在产物得率、螯合率、钙结合量上均优于先脱酰胺再酶解的方式[25]。
2.2 肽螯合钙分离纯化方法
通常情况下,制备肽螯合钙首先将原料制成多肽,后与钙源进行螯合形成肽螯合钙。为了能够提高利用度,将与钙离子亲和能力强的多肽分离出来,可以在一定程度上得到纯度更高的肽螯合钙。目前,应用于纯化多肽的方法主要有凝胶过滤色谱法,离子交换色谱法,反相高效液相色谱法和固定金属亲和色谱法。
固定金属亲和层析色谱法是目前广泛使用的分离纯化方法,通过利用固定相的结合特性分离分子,具有高结合能力和高回收率的优点。凝胶过滤色谱法一般用于不同分子量多肽的分离和鉴定。离子交换色谱法一般用于分离离子或可离解的多肽。反相液相色谱是目前液相色谱分离中使用最为广泛的一种模式,它的特点是固定相的极性比流动相弱。由于反相液相色谱固相载体的疏水性,它可以根据流动相中被分离物质分子疏水性的不同而发生强弱不同的相互作用,从而使不同分子在反相柱中彼此分离。Liu 等使用固定金属离子色谱法、凝胶过滤色谱法和反相高效液相色谱法分离纯化出大豆蛋白水解物(SPHs)的两种可与钙结合的肽段F1、F2,研究了疏水性对肽钙结合性能的影响[26]。Hou 等以羟基磷灰石作为固定相,从南极磷虾肽获得了3 个具有高钙螯合活性的级分H1、H2和H3,其中H3 钙结合能力最好。将H3 通过凝胶过滤色谱及反相高效液相色谱进一步纯化后得到了具有高钙螯合活性的肽段VLGYIQIR[27]。Zhao 等使用DEAE阴离子交换色谱,Sephadex G-25 凝胶过滤和反相高效液相色谱从乳清蛋白中分离纯化出肽段Phe-Asp,该肽段具有较高的钙结合能力[13]。
2.3 肽钙螯合物中钙含量的检测方法
测定钙含量的方法主要有滴定法、分光光度法、火焰原子吸收分光光度法、离子选择电极法、电感耦合等离子光谱发射法等,其中使用最广泛的有滴定法、火焰原子吸收分光光度法以及比色法。滴定法操作简便,成本低,但滴定时颜色变化受到样品的影响,存在个体误差。Wang 通过乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)滴定法评估钙螯合能力,以螯合率为指标,添加钙指示剂后,用合适浓度的EDTA 滴定溶液使其变色,以消耗的EDTA 体积计算螯合率[28]。Sun 等在进行海参卵子肽螯合钙体外模拟消化试验中也使用EDTA 滴定法进行钙含量的测定[29]。分光光度法即比色法也是测定钙离子的一种手段,其操作简单,成本较低,同时也不受人为因素的影响。李桂伶比较了测定钙常用的3 种方法:高锰酸钾滴定法、EDTA 滴定法和分光光度法,通过数据得出,分光光度法误差最小[30]。Wu 等采用邻甲酚酞络合酮试剂法测定章鱼肽的钙结合活性,即通过比色法在570 nm 处测定钙含量[31]。Sun 等也使用比色法测定了海参卵子水解物(sea cucumber ovum hydrolysates,SCOH)的钙螯合活性,通过离心去除不溶性钙盐后,通过比色法进行钙含量测定[30]。火焰原子吸收分光光度法是利用被测元素基态原子蒸气对其共振辐射线的吸收特性进行元素定量分析的方法,因其具有较高的灵敏度、精密度、应用范围广等而受到欢迎,但其价格昂贵,成本较高。Hou 等通过火焰原子吸收光谱法测定南极磷虾蛋白水解物螯合钙的钙含量[26]。Guo 也利用同样的方法测定了鳕鱼鱼皮蛋白水解物肽螯合钙中的可溶性钙含量[32]。
3 稳定性
稳定性是研究肽螯合钙生物利用性能的重要指标,包括在胃肠道中的消化稳定性和受植酸、纤维等食物的影响。
Sun 等将海参卵子水解肽螯合钙(SCOH-Ca),酪蛋白磷酸肽结合钙(CPP-Ca)和CaCl2水溶液在37 ℃下将pH 值调节至2.0,加入胃液后模拟胃消化过程。90 min 后,将pH 值调节至7.5,然后将肠液加入溶液中模拟肠道消化150 min,离心后的上清液钙含量即为溶解度。结果显示,模拟胃消化阶段SCOH-Ca 与CPP-Ca 钙溶解度无显著差异,且显著高于CaCl2。肠道中,在草酸盐共存的情况下,SCOH-Ca 溶解度显著高于 CaCl2,但低于 CPP-Ca[30]。
Lin 等比较了SPH-Ca 螯合物和CaCl2在不同pH范围内的钙溶解度。结果发现,在pH 值范围为2.0~8.0范围时,SPH-Ca 螯合物钙溶解度无显著差异,但CaCl2随着pH 值的增加钙溶解度呈逐渐下降趋势[33]。刘凤茹也研究了麦胚蛋白肽螯合钙的稳定性,研究发现,麦胚蛋白肽螯合钙与CaCO3和葡萄糖酸钙相比有较高的溶解度,且对pH 值耐受性较高,溶解度相对稳定。在肠中,随着消化时间不断延长,3 种钙制剂溶解度均逐渐降低,但麦胚蛋白肽螯合钙溶解度仍高于CaCO3、葡萄糖酸钙。且在食物共存成分如植酸、草酸、膳食纤维的影响下,麦胚蛋白肽螯合与CaCO3、葡萄糖酸钙酸钙相比,溶解度较高。其中,3 种钙源的透过率均随植酸含量的增加的而降低,但是CaCO3一直处于较低的透过率水平(24%~26%),P-Ca 的钙透过率相对最高,维持在35%水平。溶液中加入草酸以后,P-Ca 的钙溶解度保持在75%~95 %之间,而葡萄糖酸钙和CaCO3的钙溶解度则低于70 %;P-Ca 的钙透析率在24 %~38 %之间,CaCO3的钙透析率在22 %~29 %之间。模拟胃肠道环境消化试验中,粗纤维对P-Ca、CaCO3和葡萄糖酸钙3 种钙源的溶解度和透过率副作用影响均显著,呈现线性相关性。由此可得出,肽螯合钙具有较好的稳定性,生物利用度高[34]。
Mi 等将PHLC-Ca 进行微囊化处理后,通过体外模拟消化试验证明了微囊化可以有效减少强酸性胃环境对PHLC-Ca 的破坏。同时动物试验也证明了将PHLC-Ca 进行微囊化处理后对骨质疏松症有更好的治疗效果[35]。
4 肽钙螯合物的生物活性
4.1 细胞吸收模型研究
近些年,人肠腺癌细胞Caco-2 和HT-29 被广泛应用于金属离子的体外吸收研究。Caco-2 与十二指肠的肠细胞相似[36],在发生主动运输的十二指肠内,TRPV6 通道占主导地位[37]。而HT-29 细胞类似于回肠区的细胞,钙吸收主要通过L-型钙通道发生。Cosentino等通过研究证明,用维生素D 代谢物1,25-(OH)2D3分别预处理Caco-2 细胞和HT-29 细胞后添加CPPs,发现Caco-2 细胞中钙吸收量增加,而在HT-29 细胞中,未发现HT-29 有相关应答[38]。
CPPs 作为典型的肽螯合钙,对肽类钙在肠道内吸收机制方面的研究发挥了重要作用。Cosentino 等证实了添加CPPs 后,HT-29 和Caco-2 吸收细胞外钙离子的能力仅在细胞分化时表现出来[38]。Ferraretto 等指出,CPPs 可能将自身插入质膜形成其自身的钙选择性通道或通过内吞作用实现细胞对钙的吸收。以HT-29细胞为模型,发现CPPs 通过直接与质膜相互作用而增强细胞中的钙摄取,但不影响其中存在的受体或离子通道[39]。另外,通过研究证明,引起HT-29 细胞内钙流入似乎取决于CPPs 磷酸化的“酸性基序”和前面的N 末端区域。并且在分化的HT-29 细胞中,封闭在CPPs 聚集体中的钙离子直接参与矿物质吸收[6]。
除CPPs 外,大豆蛋白水解物(SPHs)、干酪乳清蛋白消化物(cheese whey protein digest,CWP-D)等衍生的肽也可促进钙的吸收。Lv 等以Caco-2 细胞为模型评估了不同分子量的SPH-钙复合物对体外钙摄取的影响。结果证明,10 kDa~30 kDa 的 SPH-Ca 复合物对Ca2+的吸收有重要作用,Ca2+的增加在0.5 mg/mL~4 mg/mL 范围内具有浓度依赖性[19]。Takano 等表明,CWP-D 可增强人类肠道Caco-2 细胞中的钙摄取,并且CWP-D 可以抑制小鼠肠道内钙浓度下降[40]。Hou 等以Caco-2 细胞和外翻肠囊为模型研究了脱盐鸭蛋清肽(duck egg white peptides,DPs)对钙吸收的影响,发现DPs 可以增强钙转运,可以通过充当钙载体并与细胞膜相互作用以打开特定的Ca2+通道来实现,而旁细胞途径可能仅作出少量贡献[41]。
综上所述,钙在体内的吸收可能受多种因素的影响,如转运通道、肽的磷酸化及一级结构、分子量等。
4.2 动物模型试验研究
为了研究肽螯合钙在体内的生物利用度,动物模型在其中起着关键作用。我国保健食品检验与评价技术规范中指出,确定某种物质是否具有补钙功能,需使受试组骨钙含量或骨密度显著高于低钙受试组且不低于相应剂量CaCO3对照组,同时,钙的吸收率也不得低于对照组[42]。Tsuchita 等利用雄性生长大鼠研究CPPs 的Ca 和P 可用性,通过制备含有9.6%的CPPCa 或9.0%无钙CPPs 的实验饮食,作为Ca 或P 的唯一来源。实验发现,用CPPs 喂养的大鼠肾小管重吸收率、股骨和肱骨重量显著高于对照组大鼠,其中用CPPs-Ca 喂养的大鼠与对照组相比股骨磷含量、股骨密度显着升高,同时也显示出高血清骨钙素和低尿cAMP 值,表明了骨形成增加和骨吸收减少[43]。Lv 等利用生长期大鼠探索了SPH-Ca 复合物对骨量的作用。用乳酸钙,SPH-Ca 复合物和酪蛋白磷酸肽钙饲喂大鼠4 周后,与对照组和乳酸钙组相比,口服SPH-Ca 显着增加了大鼠股骨密度,同时SPH-Ca 与CPP-Ca 组之间股骨和腰椎骨密度无明显差异[44]。除此之外,Zhao等研究了脱盐鸭蛋清肽(DPs),磷酸化 DPs(PDPs)和脱盐鸭蛋清肽-钙复合物(DPs-Ca)对体内钙吸收的影响,试验结果表明PDPs 比DPs 更有效地提高钙吸收和骨强度,并且DPs-Ca 复合物比DPs 和CaCO3混合物更有利于骨的累积[45]。
绝经后女性早期骨量下降较为明显,钙流失严重,容易引起骨质疏松的发生。雌性成年大鼠卵巢切除后,体内雌激素的缺乏,骨质量也会逐渐下降并出现骨质疏松性改变,类似于绝经后妇女会产生的一些特征。因此,有研究利用卵巢切除大鼠作为研究绝经后钙流失和钙在体内吸收利用的模型。Yamaguchi 等使用去卵巢大鼠研究了CPPs 对Ca 生物利用度的影响,指出补充CPPs 的膳食补充剂可以改善OVX 大鼠对Ca 的利用,且对OVX 诱导的骨损失具有预防作用[46]。Liu 等发现,联合口服牛胶原肽和柠檬酸钙可以抑制OVX 大鼠的骨质流失[47]。
另外,缺钙大鼠也是研究钙生物利用度的模型,黄海等通过饲喂缺钙饲料构造缺钙大鼠模型,研究鱼卵肽钙复合物(EPP-Ca)对缺钙大鼠的补钙效果。结果表明EPP-Ca 的补钙效果显著优于无机钙,且与酪蛋白磷酸肽钙复合物(CPPs-Ca)效果相当[48]。韩樱等也利用缺钙大鼠模型研究了蛋清肽-钙配合物(egg white peptide binding with calcium,EWP-Ca)在动物体内的补钙效果,试验结果证明与缺钙模型组相比,高剂量EWP-Ca 组能极显著增加大鼠股骨直径、干质量、骨钙含量及股骨密度等,与钙含量相同的CaCO3组相比,EWP-Ca 高剂量组股骨直径、骨钙含量极显著和显著增加[49]。Chen 等人发现,罗非鱼水解蛋白水解钙复合物(TSPH-Ca)也可显著改善缺钙大鼠股骨的物理和生物力学特性[22]。
肽的磷酸部分对钙的利用是必不可少的,Tsuchita等的发现说明CPPs 可以提供P 来促进骨形成[43]。Zhao、Choi 等也证明了磷酸部分的重要性。同时,肽螯合钙与无机钙相比,具有较好的生物利用度,可作为良好的钙补充剂[45,10]。
5 结论与展望
本文概述了肽钙复合物在结合机制、制备方法、吸收途径、生物利用度等方面的相关研究内容。肽钙复合物作为新一代钙制剂,其多肽来源十分丰富,同时不同的多肽还具有不同的生理活性,这类生物钙稳定性好、利用度高,可作为食品功能成分或钙补充剂,对促进国民健康具有极大的意义。
近年来,随着生活水平的不断提高,国民缺钙问题有所改善,但仍然存在摄入量不足的问题,《2017 年中国居民食品营养健康关注度大数据》显示,钙、铁、钾是最受关注的儿童营养素前三甲。目前,市场上补钙制剂的品种和剂型都日益丰富,但大多还集中在无机钙和有机钙,螯合钙商业产品还主要是酪蛋白磷酸肽螯合钙、乳清蛋白肽螯合钙,且价格较高,如何发掘优质原料、改进生产工艺、提升产品质量,推进螯合钙的商业化进程是亟需解决的问题,其中也包含一些科学问题需进一步深入探索和明确。一是除磷酸基团-钙、羧基-钙结合模式外,还有些哪些基团可与钙结合,哪种结合模式的效率更高;二是酪蛋白磷酸肽和卵黄磷蛋白磷酸肽等磷酸化肽被发现对钙的促进吸收效果较好,是否与其磷酸化结构有关,可否通过对多肽进行磷酸化改性进一步提高多肽螯合钙的生物利用度;三是食物中的植酸、草酸、单宁以及纤维等会影响钙的吸收,如何通过包埋等技术手段提高钙在肠道中的可溶性和生物有效性。
