NaCl含量测定实验中含银废液的回收和再利用研究
2020-03-21李芳蓉田永峰孙彦坪刘凤霞李宏伟
李芳蓉,田永峰,牛 娟,孙彦坪,刘凤霞,童 丹,李宏伟
(甘肃中医药大学 药学部,甘肃 定西 743000)
随着我国高校招生规模扩大和在校生人数和实验比例的不断提高,实验室废弃物急剧增加,其对环境的污染和生态平衡破坏日益严重[1-2]。必须加强实验室管理和有毒有害物质的回收和综合利用[3]。为了减少对环境的污染,必须加强对实验室的废水排放管理,促进对学生科学精神、科学素养和职业素质的培养,强化其环保意识和资源节约意识,实施绿色化学教学,研究实验室废水处理的防治对策,回收其中的有用物质,变废为宝,尤显其重要性和紧迫性[4]。在高校分析化学实验中NaCl含量测定是一个必做实验,是以荧光黄为指示剂,用AgNO3标准溶液进行滴定。该法操作简便,效果明显、准确度高,但却要消耗大量的AgNO3(AR)。AgNO3是贵金属盐类,故实验成本较高。最终转化为AgCl乳白色沉淀形成大量悬浊液废液。实验废液中含有大量贵金属银的盐类,直接丢弃,既污染环境又浪费资源。因为银盐通过食物链进入人体,会对人造成永久性的伤害甚至致人死亡[5]。同时贵金属银蕴藏量及产量很有限,价格昂贵,应用却非常广泛。随着银消耗量增大和矿产资源日渐衰减,银冶炼成本不断提高,人们已认为由含银废液中回收银是银的第二资源,可补充银耗的不足部分[6-7],银废液作为二次资源加以回收利用[8],具有显著的社会效益和经济效益[9],日益受到重视。无论从资源持续性还是从环保的角度,贵金属“二次资源”的回收利用都具有极其重要的意义[10]。从实验室含银废液中回收银的方法有很多种,如,贱金属置换法、沉淀法、电沉积法、结晶法、离子交换法、氯化钠沉淀银法、吸附法及各种方法联用等[11-12]。主要存在的问题是回收率较低且纯度不高,操作环境差,技术复杂、耗电量大、可能产生二次污染,推广应用比较困难等[13]。如沉淀法,银回收过程中会产生大量有毒气体H2S;电解法回收银电能耗用量大;而吸附法和离子交换法对仪器设备的要求很高,实验条件也很苛刻,实际应用受到限制[14]。将氯化银沉淀跟炭粉、碳酸钠粉末充分混合均匀并转移于坩埚内于1000 ℃马福炉加热5~6 h,在高温下反应,制得单质银[15]。氯化银高温下会产生有毒气体Cl2伤害实验者,并且同时加入炭粉和碳酸钠使用药品种类偏多。为了培养学生环保意识,强化节约思想,回收实验废液中的银,减少污染,循环使用银,降低实验成本,作者指导学生收集了“氯离子含量测定”实验的含银废液,并通过文献查阅和初步试验,筛选出三种方法进行银的回收,制成完全符合容量分析标准的纯度高,杂质含量低的AgNO3[16]。总结比较了三种方法的回收率的高低和所得AgNO3的纯度,为实验室含银废液处理提供理论指导和技术依据。作者采用NaCl沉淀、氨水溶解的常规方法,先将废液回收,再进行预处理,分离出其中的AgCl,再进一步回收银:(1)直接从AgCl用水合肼还原回收其中的银;(2)先将AgCl制成银氨络合物,再分别①用抗坏血酸,②单质锌粒,将银氨络合物还原为单质银;(3)用HNO3溶解被还原的单质银制成AgNO3溶液,将制成的AgNO3溶液浓缩、重结晶,烘干制成固体AgNO3。此三种方法均具有操作简便,步骤少,所用试剂价格低廉,回收所得AgNO3完全符合容量分析标准,纯度高,杂质含量低的特点。
1 实验材料
1.1 试剂与材料
NaCl、HNO3(浓)、AgNO3、HCl(浓)、Na2S、N2H4·H2O、锌粒、荧光黄、抗坏血酸、浓氨水等。所用试剂均为国产分析纯试剂,所用水均为自制纯化水。
1.2 主要仪器
FA2204N型全自动电子天平(精度0.0001 g),立式电热恒温干燥箱(天津市津北真空仪器厂),SHZ-D(III)循环水式真空泵,101-1A型电热恒温鼓风干燥箱(北京科伟仪器有限公司),MH-1000型电热套,25 mL棕色酸式滴定管,移液管,棕色容量瓶,酒精灯,抽滤瓶、布氏漏斗、三角架、泥三角和蒸发皿等。
2 实验步骤
2.1 实验废液的收集
实验废液来自于采用沉淀滴定法的法扬斯法,即以荧光黄为指示剂,以AgNO3为滴定剂进行样品中NaCl含量的测定。收集学生实验中产生的含银废液,包括学生润洗滴定管所用的AgNO3溶液、滴定操作过程中生成的AgCl混悬液,以及剩余的AgNO3溶液。
2.2 废液的前期处理
取已收集的含银废液250 mL,边搅拌边逐滴加入1.0 mol/L NaCl溶液至银离子全部转化为白色乳状的AgCl沉淀,待沉淀完全沉降后,直接倾出大部分的上层清液,得AgCl白色沉淀。用0.01 mol/L稀硝酸洗涤沉淀2~3次,以除去其中的杂质。将已除杂的沉淀先用热纯化水洗涤数次,减压过滤即抽滤。再反复用冷纯化水充分洗涤,至洗涤后滤出液与1.0 mol/L AgNO3溶液无沉淀产生为止,即无Cl-。将沉淀继续抽滤至接近干燥的纯AgCl,100 ℃烘干2 h,备用。称量所得沉淀AgCl的质量,并粗略计算其物质的量。
2.3 回收方法比较
2.3.1AgCl水合肼直接提银
水合肼(N2H4·H2O)又称水合联氨,为强碱性物质,其还原性极强,能还原许多金属盐制备金属单质,使金属呈粉末状析出。水合肼对皮肤有刺激性,其液体或蒸气对眼有刺激作用,故操作时要做好防护。N2H4·H2O可将AgCl还原生成银单质,因此以N2H4·H2O沉淀银是于水中直接注入液体N2H4·H2O,使之与AgCl反应溶解并析出单质银[17]。
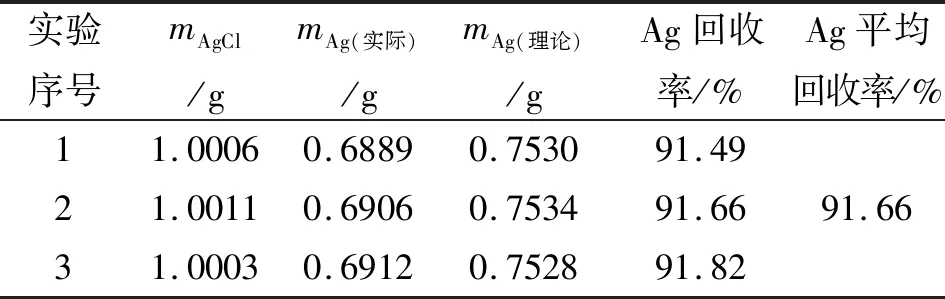
精密称取AgCl约1g三份(编号分别为1、2和3),然后按理论量的1.2~1.5倍直接边搅拌边缓缓加入N2H4·H2O,并随时检查反应程度,因该反应放热,故无需加热。随着N2H4·H2O的加入,白色AgCl沉淀逐渐变成灰色的银单质,再加入过量的N2H4·H2O至白色沉淀完全变成灰色的银粉为止。反应过程中,起始时反应较缓慢,当温度升高至50℃~60℃时,其速度加快很明显,此时为了防止反应液溢流,应随时控制N2H4·H2O 的加入速度,继续加入N2H4·H2O直至溶液澄清透明,不再有气泡逸出,则表明AgCl已反应完。将加入N2H4·H2O后沉淀出的灰色疏松的银粉过滤,洗涤,干燥,即得灰黑色的银粉。100 ℃烘干2 h。称量银粉质量,计算回收率。结果见表1。
相关反应方程式见式(1):
2AgCl + 2N2H4·H2O= 2Ag + 2NH4Cl + N2↑+ 2H2O
(1)
2.3.2氯化银氨浸提银
根据AgCl极易溶于氨水而生成[Ag(NH3)2]+配离子的原理,AgCl氨浸提银。精密称取AgCl约1 g 六份(编号分别为4、5、6、7、8和9),加入适当过量的浓氨水至其完全溶解,滤除不溶物。滤液即为[Ag(NH3)2]Cl溶液。相关反应式见式(2)和(3)[18]:
Ag++ Cl-= AgCl↓
(2)
AgCl+2NH3·H2O=[Ag(NH3)2]Cl+2H2O
(3)
2.3.2.1将银还原为单质银
[Ag(NH3)2]Cl中的Ag(+I)有较弱的氧化性,可以被较强的还原剂还原,如与抗坏血酸、金属锌、铁、铝等还原剂反应,可以将[Ag(NH3)2] Cl中的Ag(+I)还原为单质银。经过查阅文献和初步试验比较,最终选定分别用抗坏血酸和金属锌粒为还原剂进行还原回收试验。
(1)以抗坏血酸还原回收银
向2.3.2中由4、5、6号AgCl制得的[Ag(NH3)2]Cl溶液中各加入适当过量的1.0 mol/L抗坏血酸溶液,放置并间歇性搅拌至银沉淀。过程中随时取上层清液与0.1 mol/L Na2S溶液在白色点滴板上反应,若无黑色沉淀生成则证明银已沉淀完全。待沉淀完全后,抽滤,沉淀依次用热和冷纯化水反复洗涤数次,并继续抽滤,至接近干燥,100 ℃烘干2 h。称量银粉质量,计算回收率。结果见表2。相关反应式见式(4)和(5)[19-20]:
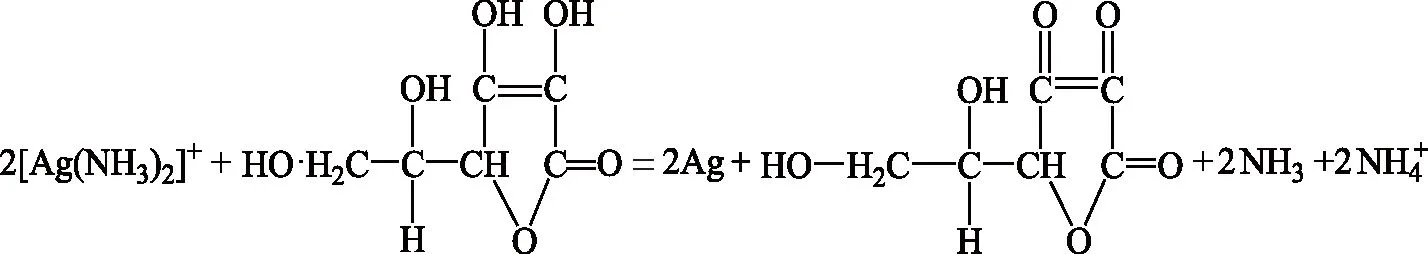
2Ag++ S2-= Ag2S↓
(5)

表2 氯化银氨浸提银法-抗坏血酸还原银的回收率Tab.2 Recovery of silver from the AgCl ammonia extraction ascorbic acid method
(2) 以单质锌粒还原回收银
向2.3.2中由7、8、9号AgCl制得的银氨溶液中加入适当过量的锌粒,待反应完全后,捡出剩余的锌粒(清洗、干燥、回收,备后用),向溶液中加入0.5 mol/L的HCl溶解残存锌,直至溶液中不再产生气泡为止,静置,沉于底部的暗灰色粉末即为置换所得金属银,直接倾出上层清液,沉淀依次用热、冷纯化水洗涤2~3次,至上层清液呈中性(pH=7.0)。在100 ℃烘干2 h,即得回收单质银,称重,计算回收率。结果见表3。相关反应式如式(6)和(7):
2[Ag(NH3)2]Cl + Zn= [Zn(NH3)4]Cl2+ 2Ag↓
(6)
Zn+ 2HCl = ZnCl2+ H2↑
(7)

表3 氯化银氨浸提-金属锌还原法银的回收率Tab.3 Recovery of silver from AgCl ammonia extraction metal zinc method
2.4 制备回收AgNO3
2.4.1溶解金属银所需HNO3的浓度的选择[20]
由回收银制备回收AgNO3需要将银溶解于HNO3中,理论上银与浓、稀HNO3反应,银均能转化为AgNO3,但不同浓度的HNO3,其反应速度不同,且HNO3被还原的产物也不同。浓、稀HNO3与银反应,其被还原产物分别为NO2和NO。反应方程式分别如式(8)和(9):
Ag+2HNO3(浓)=AgNO3+NO2↑+H2O
(8)
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
(9)
由上述反应式可见,采用浓HNO3溶解时,每生成1 mol AgNO3消耗2 mol浓HNO3,产生1 mol废气NO2。采用稀HNO3溶解,每生成1 mol AgNO3消耗4/3 mol稀HNO3,产生1/3 mol废气NO;故采用稀HNO3溶解Ag单质,消耗HNO3的量小且产废气量少。因此,本实验选用稀HNO3溶解回收银来制备回收AgNO3。
2.4.2制备回收AgNO3
将2.3的三种方法所得的各自的三份粗单质银合并,在通风橱内分别分次加入适当过量的1.0 mol/L的稀HNO3溶解,因溶解反应会有无色有毒气体NO产生,NO遇O2生成同样有毒的红棕色气体NO2,故待反应趋缓时再加入第二批HNO3,待银粉快要溶解完时,置于电热套中边搅拌边加热煮沸至银溶解完全且溶液变澄清为止。将所制得AgNO3用纯化水稀释到约1~1.5倍后过滤,再用纯化水少量多次地充分洗涤烧杯及滤纸,并将洗液与滤液合并,转入同一蒸发皿中。滤液在酒精灯上小心蒸发至表面有晶膜出现,冷却、固体再加入无水乙醇继续加热使其溶解后,重结晶,待结晶完全后,抽滤,结晶用少量无水乙醇洗涤2~3次,用酒精灯小火加热蒸干,然后在110 ℃下烘干2 h,即得白色晶体AgNO3产品。相关反应式如式(10)和(11):
3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O
(10)
2NO + O2=2NO2
(11)
2.5 回收AgNO3质量测定
2.5.1回收AgNO3的含量测定
精密称取2.4三种方法所得的回收AgNO3各约1.7 g(依次编号分别为水合肼法10,抗坏血酸还原法11,单质铁还原法12),分别用纯化水溶解并在100 mL的棕色容量瓶中定容。以荧光黄为指示剂,用AgNO3溶液滴定NaCl标准溶液对回收AgNO3的准确浓度进行对比滴定测定,从消耗的AgNO3溶液的体积计算出其中AgNO3的含量即纯度[14]。结果见表4。
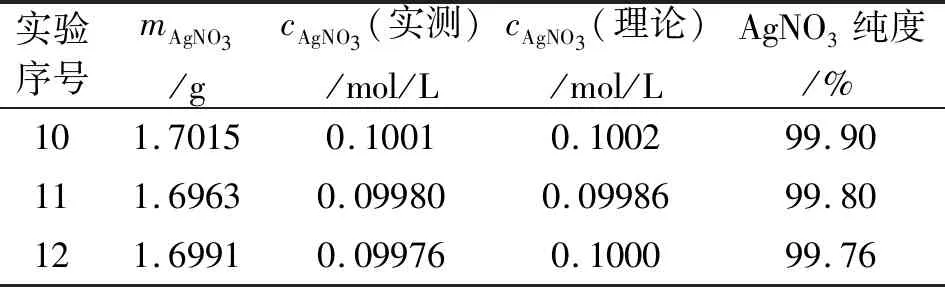
表4 三种方法所得AgNO3的含量Tab.4 Content of AgNO3 from three methods
2.5.2回收与市售AgNO3(AR) 对比测定氯化物中Cl-含量
精密称取2.4三种方法所得的回收AgNO3(依次编号分别为水合肼法13,抗坏血酸还原法14,单质铁还原法15),和市售的AgNO3(AR)(编号为16)各约3.4 g,分别用纯化水溶解并在200 mL的棕色容量瓶中定容。配制成0.1 mol/L的溶液,以NaCl为基准物质标定其浓度。以荧光黄为指示剂,用上述已标定好的回收的和市售的AgNO3溶液滴定测定市售NaCl(AR)中Cl-的含量。测定结果见表5。

表5 回收的和市售的AgNO3溶液滴定测定市售NaCl(AR)中Cl-的含量结果Tab.5 The results of content of Cl- in commercially available NaCl (AR) that measured by using titration method with recovered and commercially available AgNO3 solution
3 结果讨论
3.1 三种方法回收方法和回收结果比较分析
3.1.1三种方法回收银的回收方法对比分析
(1)AgCl水合肼直接提银法、AgCl氨浸提-抗坏血酸还原法和AgCl氨浸提-金属锌还原法三种方法是本实验组查阅了大量文献,经过多次初步试验后精心筛选的方法,三种方法回收含银废液,均具有操作简单,所用仪器常见和试剂常用价格相对较低,实验条件温和,回收率高的特点,一般实验室内就能实现。
(2)AgCl直接水合肼提银法与AgCl氨浸提-抗坏血酸还原法及AgCl氨浸提-金属锌还原法相比,AgCl直接水合肼提银法操作更简单,步骤更少,无需加温,污水量少;反应速度快;无需加入氨水溶解,试剂加入种类减少,不会对生产的银再造成污染,反应终点易于判断;银的回收率高;同时AgCl直接水合肼提银,回收过程产生的气体为无毒、无害、无污染环境友好的N2。
(3)AgCl氨浸提-抗坏血酸还原法与AgCl氨浸提-金属锌还原法相比,后者还需加盐酸去除过量的锌,既要多加试剂,还要挑拣多余的锌粒,操作复杂,反应耗费时间也相对较长。
3.1.2三种方法回收银的回收率对比分析
就回收率而言,三种方法回收含银废液,作为本实验组优选的研究者较多采用的方法,由AgCl到金属银转化的平均回收率都超过了90.14%,整体都比较理想。但相比来说,AgCl氨浸提-抗坏血酸还原法的平均回收率(91.08%)比AgCl氨浸提-金属锌还原法(90.14%)更高,三种方法中AgCl直接水合肼提银法的平均回收率最高(91.66%)。
3.2 三种方法回收所得AgNO3质量分析比较
回收的AgNO3质量分析结果表明,用三种方法回收的AgNO3的含量均达到了99.76% 以上,对NaCl中Cl-含量测定的结果也与市售分析纯试剂的基本一致,测定结果的相对相差分别为0.15%、0.13%和0.18%,且所有测定值都与理论值很接近。因此,用此三种方法回收含银废液还原得到金属银,并进一步溶解于稀硝酸最后制得的AgNO3完全可以替代市售分析纯试剂AgNO3。
3.3 结论
此三种方法用于实验室回收银废液,都可达到消除实验废液中银的排放,保护实验室周边环境,既可节约资源和降低实验经费,还能创建一个绿色的化学实验室环境,且本回收方法简单,易行。同时回收的单质银或硝酸银可以重新用于学生实验中,进行定性、定量或重结晶的操作实验中,实现实验室含银废液中银的回收和循环利用。但三者还是有细微的差别,AgCl直接水合肼提银法,步骤最少,所得AgNO3纯度最高(99.90%),AgCl氨浸提-金属锌还原法步骤最多,所得AgNO3纯度最低(99.76%),AgCl氨浸提-抗坏血酸还原法,步骤比数介于前二者之间,所得AgNO3纯度也居中(99.80%),因此,三者都可以直接用于实验室含银废液中银的回收再利用,但建议一般首选用氯化银直接水合肼提银法提取,其次选AgCl氨浸提-抗坏血酸还原法,再次选用AgCl氨浸提-金属锌还原法。在由单质银转化成AgNO3时优先选用稀硝酸作为溶剂和氧化剂相对较好。
4 结束语
综上所述,课题组通过指导学生进行实验废水的收集并处理,进而回收NaCl含量测定学生实验废液中的银,进行绿色教育,培养其科学精神和科学素养及良好的职业素养。强化其环保意识和资源节约意识,训练学生的实践操作能力,更重要的是让学生知道了处理“三废”之不易及重要性。采用三种方法处理NaCl含量测定学生实验废液,通过回收率和所得回收硝酸银的纯度的分析得到三种方法银的回收率都超过了91%,所得AgNO3的含量都超过了99.76%,故三种方法都可以作为实验室含银废液处理的方法。但对于AgCl水合肼直接提银法步骤最少,银的回收率和所得AgNO3纯度最高,使用时可首选,其次可选AgCl氨浸提-抗坏血酸还原法,再次选用AgCl氨浸提-金属锌还原法。在由单质银转化成AgNO3时优先选用稀硝酸作为溶剂和氧化剂相对较好。通过近三年的实际应用,用此三种方法从实验废液中回收了大量的银,既可以变废为宝,避免直接排放造成的污染,又提高了药品的使用率,降低实验经费,让学生树立起牢固的环保意识和坚定的节约信念,为化学实验室废水的处理与实验室含银废液回收处理提供理论指导和技术依据,同时为回收利用实验废液中的其它化学成份提供了有价值的参考。
