神经节苷脂联合高压氧治疗对缺血缺氧性脑病新生儿炎性因子及血清BDNF、NSE、Bcl-2、β-EP水平的影响
2020-03-21刘静
刘 静
(河南省南阳市中心医院 预防保健科,河南 南阳 473000)
缺血缺氧性脑病(hypoxic-ischemic encephalopatly,HIE)是新生儿围生期常见危重疾病表现为惊厥、肌张力、原始反射不良等反应,处理不当或治疗不及时,将诱发患儿智力、听力障碍、脑瘫、永久性神经功能损伤。因此,尽早开展积极有效的治疗,对改善脑组织缺氧状态,预防因神经元不可逆损伤导致的各类神经系统后遗症,具有重要意义。高压氧可有效改善机体缺氧状态,延缓脑细胞因缺血缺氧性病变,为治疗提供时间;神经节苷脂(monosialotetrahexosylganglioside,GM-1)可降低血液粘稠度,改善脑部血供,促进脑神经轴突与突触的生长发育,具有良好的脑神经修复功能[1]。有研究表明[2],高压氧联合 GM-1 对 HIE患儿具有良好效果,但对于两者联合应用的作用机制研究较少。本研究将分析高压氧联合GM-1对HIE患儿炎性因子及血清脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白、β-内啡肽(β-endorphin,β-EP)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年5月本院收治的118例HIE患儿为研究对象。纳入标准:①符合中华医学会2005年修订的HIE诊断标准和分级标准;②胎龄>37周;③出生体重≥3 000 g;④未接受过其他治疗的初诊新生儿;⑤家属在治疗知情同意书上签字。排除标准:①存在先天感染或全身炎症反应综合征;②先天畸形;③合并颅内出血;④对GM-1药物反应或不耐受高压氧者。随机将其分为观察组和对照组,每组59例,两组患儿孕周、出生体重、窒息程度、分娩方式等一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医学伦理委员会批准。
1.2 治疗方法
两组患者均接受降颅压、维持水电解质平衡、吸氧、脑营养支持、控制惊厥等常规治疗。对照组在常规治疗基础上给予注射用单唾液酸四己糖神经节苷酯钠注射液(北京赛升药业股份有限公司。国药准字:H200939809)20 mg,加入20 mL生理盐水中静滴,1次/d,连续用药4周。观察组在对照组治疗基础上,给予高压氧治疗,患者无惊厥,且生命体征平稳,将其置入婴儿透明高压氧舱,设置氧仓压力为0.03~0.04 MPa,氧气浓度70%~85%,温度 22°C~28°C,加压 20 min稳定在设置压力,维持20min,减压20min,共吸氧60min,1次/d,7 d为一个疗程,共治疗4个疗程。

表1 两组患儿一般资料比较
1.3 观察指标
分别在治疗前和治疗2周后抽血送检,采用酶联免疫吸附法(试剂雷杜RT-6000,监测仪器为酶标仪),检测新生儿超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)炎性因子;同时采用反射免疫分析法(试剂为上海恒远)测定BDNF、NSE、Bcl-2及 β-EP。
1.4 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较行t检验,计数资料用百分率(%)表示,以χ2检验,检验水准0.05,双侧检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿治疗前后炎性因子水平比较
治疗前,两组患儿hs-CRP、IL-6、TNF-α炎性因子水平比较差异无统计学意义(P>0.05),治疗28 d后,两组炎性因子水平均下降,组内治疗前后比较差异有统计学意义(P<0.05),且观察组低于对照组,组间比较差异有统计学意义(P<0.05),见表 2。
表2 两组患儿治疗前后炎性因子水平比较 (±s)
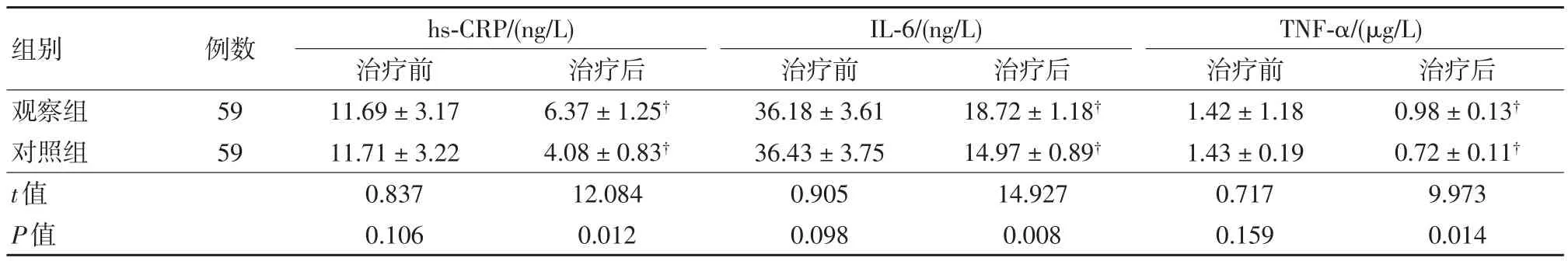
表2 两组患儿治疗前后炎性因子水平比较 (±s)
注:†与治疗前比较,P<0.05。
组别观察组对照组t值P值治疗后0.98±0.13†0.72±0.11†9.973 0.014例数59 59 hs-CRP/(ng/L)治疗前11.69±3.17 11.71±3.22 0.837 0.106治疗后6.37±1.25†4.08±0.83†12.084 0.012 IL-6/(ng/L)治疗前36.18±3.61 36.43±3.75 0.905 0.098治疗后18.72±1.18†14.97±0.89†14.927 0.008 TNF-α/(μg/L)治疗前1.42±1.18 1.43±0.19 0.717 0.159
2.2 两组患儿治疗前后血清BDNF、NSE、Bcl-2、β-EP水平比较
治疗前,两组患儿血清BDNY、NSE、Bcl-2、β-EP水平比较差异无统计学意义(P>0.05),治疗28 d后,两组上述指标均下降,组内治疗前后比较差异有统计学意义(P<0.05),且观察组低于对照组,组间比较差异有统计学意义(P<0.05),见表3。
表3 两组患儿治疗前后血清BDNY、NSE、Bcl-2、β-EP水平比较 (±s)
注:†与治疗前比较,P<0.05。
组别观察组对照组t值P值治疗后77.38±8.42†64.95±7.86†10.728 0.013例数59 59 BDNF/(pg/mL)治疗前1 275.43±218.72 1 293.80±219.04 1.083 0.098治疗后648.57±115.83†842.64±127.47†13.868 0.009 NSE/(μg/L)治疗前13.52±0.16 13.49±0.17 0.858 0.203治疗后6.91±1.08†8.67±1.52†7.185 0.021 Bcl-2/(u/mL)治疗前15.93±2.31 15.89±2.29 0.891 0.188治疗后2.27±0.41†7.35±0.76†8.846 0.019 β-EP/(ng/L)治疗前123.62±11.68 122.97±12.08 0.917 0.112
3 讨论
HIE发生后,脑组织缺血缺氧状态使血脑屏障损伤,出现炎性反应,hs-CRP作为机体炎性反应的免疫调节蛋白,其水平会明显上升并参与炎性反应,而存在于神经元中的TNF-α水平也随脑神经损伤而升高,并激活IL-6等炎性因子等途径发挥其神经毒性。钱庆燕等[3]研究指出,通过检测炎性因子水平可间接评估HIE病情程度,指导治疗方案的制定,并预测其预后;本研究结果显示,经治疗后,患儿炎性因子水平均明显下降,水平与病情呈正相关。BDNF能够调节自由基代谢,减少体内自由基聚集,从而保护神经元免于遭受自由基攻击;广泛存在于神经元细胞中的NSE可特异性地反映神经元受损的状况,是反映脑组织损伤最敏感的指标;Bcl-2具有抗凋亡功能,其表达与细胞存活密切相关,可能是神经细胞自我保护的机制之一;β-EP是在脑神经受损后被释放的内源性阿片肽,可导致钙代谢紊乱,从而加重脑水肿;这些指标可作为评估HIE患儿脑神经受损程度和病情变化依据[4],对临床具有较高的指导价值。
GM-1是广泛存在于细胞膜中的糖鞘脂,在神经系统分布最丰富。GM-1可拮抗兴奋性氨基酸神经毒性,稳定细胞膜结构和功能,保护神经细胞,促进中枢神经系统的恢复目前是临床治疗HIE的主要药物之一。赵庭鉴等[5]运用GM-1联合还原型谷胱甘肽有效改善临床症状,降低炎性因子水平,与本研究结论一致。高压氧可提高动脉血氧分压和组织储氧量提高血氧弥散率改善组织缺氧,增加组织内氧的有效弥散距离,促进缺氧边缘部位组织的供氧恢复;有研究显示[6]高压氧可有效提升缺血缺氧性脑病患儿生活质量,加速脑神经生长和修改功能。本研究结果显示,GM-1联合高压氧治疗的观察组HIE患儿的血清BDNF、NSE、Bcl-2、β-EP水平及炎性因子水平均明显低于对照组,提升其脑神经恢复更优,与朱娟等[7]研究结论一致。
综上所述,神经节苷脂联合高压氧治疗缺血缺氧性脑病新生儿,可加速脑神经修复,降低机体血清BDNF、NSE、Bcl-2、β-EP水平及炎性因子水平,改善病情,促进康复。
