留置针的细胞毒性和遗传毒性研究
2020-03-20河南省医疗器械检验所河南郑州450018
河南省医疗器械检验所 (河南 郑州 450018)
内容提要: 目的:评价留置针的生物安全性。方法:采用GB/T16886.5和YY0870.2中的方法对4种留置针进行细胞毒性和遗传毒性的检测。结果:细胞毒性试验中,4种留置针的细胞增殖率均大于70%,符合无细胞毒性的判定;遗传毒性试验中,4种留置针检测结果均与阴性对照组无显著性差异。结论:4种留置针均具有良好的生物安全性。
静脉留置针主要由可以保留在患者血管内的柔软套管和进行穿刺的不锈钢穿刺针组成。使用时将套管和穿刺针一起穿刺入血管内,当留置针全部进入患者的血管后,医院人员回撤出穿刺针,仅将柔软的导管留置在血管内从而进行输液治疗,能减少患者尤其是幼儿和老年人因反复静脉穿刺而造成的痛苦[1]。在手术和麻醉中,留置针的使用更加不可缺少,因其不仅能够减少局部炎性等反应的发生,还具有易固定、不易脱落、输液快速、用药方便及时等优点[2]。20世纪80年代,留置针进入亚洲的发达国家,90年代,开放式留置针率先进入中国手术室,其后应用越来越广泛,首先在儿科受到广泛的应用,并逐渐地在其他科室推广开来。
由于留置针直接与血液进行接触,其新产品的生物安全性显得十分的重要,因此笔者选取了4种留置针对其细胞毒性和遗传毒性进行评价,为其临床使用提供安全性参考。
1.材料与方法
1.1 一般材料
试验样品:试样样品为4个不同厂商的留置针,浸提比例选用0.2g/mL,细胞毒性的浸提介质为含血清的MEM培养基,遗传毒性的浸提介质为含血清的MEM培养基和生理盐水。
仪器:培养箱(Thermo Fisher公司4131型),显微成像系统(莱卡DM6000B)显微镜(Nikon公司T-DH型),细胞计数仪(Millipore公司Scepter型),全波长扫描读数仪(Thermo Scientific公司Varioskan Flasg型)。
试剂:L-929小鼠成纤维细胞株(中科院上海细胞所),CHL仓鼠肺细胞细胞株(中科院上海细胞所),胎牛血清(Gibco;1912660C),MEM培养基(Gibco;1897268),胰酶(Gibco;1869828),异丙醇(国药集团化学试剂有限公司;20160217),MTT(Sigma;MKBN7264V),DMSO(Sigma;RNBD8359)S9(Moltox;1830857),秋水仙素(北京百灵威科技有限公司;LT20Q33),环磷酰胺(Sigma;43H0269),丝裂霉素(西亚试剂;I5216)。
1.2 方法
1.2.1 细胞毒性试验
用0.25%胰酶将L929细胞从培养瓶中消化后移出,细胞悬液在1000r/min离心5min。用培养基重悬细胞悬液,调整细胞密度为1×105/mL。将配制好的细胞悬液每孔接种100μL,接种于96孔培养板。置于5%CO2培养箱37℃培养24h。
24h后弃去原培养液。每孔加入100μL样品浸提液、或阴性对照液、或阳性对照液或空白的处理培养基,置CO2培养箱继续培养24h。
之后将培养板置显微镜下观察并记录细胞的形态。弃去原孔内溶液后,每孔加入50μL质量浓度为1g/L的MTT溶液,继续培养2h后弃去96孔板内的液体,加入100μL异丙醇。匀速震荡平板10min,在全波长扫描读数仪的570nm(测定波长)和650nm波长(参照波长)下测定吸光度。
96孔板中活细胞的减少会导致样品中代谢活性降低,这与生成的蓝紫色甲臜量有关,在570nm测量吸光度,按下式计算存活率(公式(1)):

注:OD570e——试样样品100%浸提液光密度平均值;OD570b—空白光密度平均值。
空白OD570平均值如≥0.2,则试验符合接受标准,如试验样品细胞存活率≥空白的70%,则认为试验样品无细胞毒性[3]。
1.2.2 遗传毒性试验
将一定数量的细胞接种于培养皿内,置于CO2培养箱内培养24h。
24h后吸去培养皿中的培养液,加入试验或对照样品、S9混合液(不加S9混合液时,用培养液补足)和细胞培养液,置于培养箱中。有活化系统的接触4h,无活化系统的接触20h;吸去培养皿中的液体,用PBS缓冲液洗细胞3次,加入新鲜细胞培养液继续培养,并在接触开始后的24h收获细胞。于收获前4h加入秋水仙素,终浓度1μg/mL。阴性对照组和阳性对照组同法制备。无S9混合液活化系统采用丝裂霉素,新鲜配制,终浓度为0.5μg/mL;有S9混合液活化系统采用环磷酰胺,终浓度为80μg/mL。
消化细胞后加入含血清细胞培养液,以200g,离心10min,弃去上清溶液。加入0.075mol/L氯化钾溶液5mL,用一次性吹管将细胞吹打均匀,置于37℃水浴中低渗处理20min,然后加入1mL甲醇:冰醋酸=3:1的固定液,吹打均匀。1500r/min离心10min,弃去上清液。再加入5mL固定液,混匀后固定20min,以1500r/min离心10min,弃去上清液。同法固定2次,弃掉上清液。加入新鲜固定液,混合均匀。将混悬液滴于预冷过的载玻片上,干燥。将滴片用吉姆萨染液染色,晾干后在光学显微镜下每一试验组选择200个分散良好的中期分裂相进行染色体畸变分析[4]。
2.结果
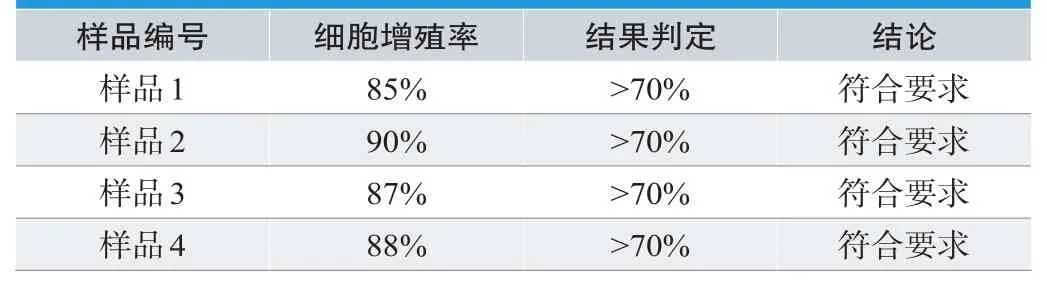
表1.细胞毒性试验结果
2.1 细胞毒性试验结果
试验结果表明,4种留置针均表现出良好的生物安全性。显微镜下观察可见,试验样品组细胞形态正常,贴壁生长良好,胞浆内有离散颗粒,极少见细胞溶解。使用MTT法检测其吸光度,经计算得出试验样品组细胞增殖率均>70%,并且它们的细胞增殖率均在80%以上,表现出良好的生物相容性。根据GB/T16886.5-2017中MTT试验方法的判断标准,4种留置针均为无潜在的细胞毒性。4种留置针细胞毒性具体结果见表1。
2.2 遗传毒性试验结果
在光学显微镜下每一试验组选择200个分散良好的中期分裂相进行染色体畸变分析。用χ2检验对试验结果进行统计分析,试验结果表明,阴性对照组染色体畸变率在正常范围内(均<4.9%),阳性对照组丝裂霉素C(0.25μg/mL)/环磷酰胺(80 μg/mL)在相同实验条件下中出现多倍体等数目的改变,也出现断裂、裂隙灯染色体结构的改变,染色体畸变率较阴性对照组显著增加(P<0.01),表明所采用实验系统可靠。在显微镜下观察各试验样品组,各组染色体形态正常。经统计各试验样品组的畸变率均<5%,与阴性对照组相比没有显著性差异,表明4种留置针的染色体畸变试验均为阴性。遗传毒性试验结果详见表2。

表2.染色体畸变试验结果
3.讨论
留置针在穿刺的过程中会和循环血路接触,留置在体内的部分与人体血路直接接触的时间更长,使用过程中可能会导致一些炎症等不良反应,对护理人员的操作也提出一定的要求,以避免出现脱管、堵管等现象[5]。但是由于其能够减少穿刺次数,便于护理等优点,这些年的应用越来越广泛,正因如此,其生物安全性一定要得到保证,笔者选取了四种留置针,对其进行了细胞毒性和染色体畸变试验的研究,其中细胞毒性可以判断其短期的毒性,遗传毒性可以判断其较长期的毒性。试验结果表明,四种留置针其细胞增殖率与阴性对照相比均大于80%,根据GB/T16886.5-2017的判定标准,均无细胞毒性;四种留置针的染色体畸变试验结果均与阴性对照相比无显著性差异,显示出良好的生物安全性。随着科学技术的不断进步,留置针产品的不断更新,许多新型的材质和型号也都出现,因此对于其毒性的研究也要随着技术的进步不断进行。
