不良IVF结局患者NK细胞信号通路调节FoxP3细胞表达的研究
2020-03-19梁雨曾彬于婉莹李翠
梁雨,曾彬,于婉莹,李翠
(唐山市妇幼保健院生殖医学中心,唐山 063000)
不孕不育症是继恶性肿瘤、心血管疾病之后第三大危害人类健康的疾病。资料显示,全世界范围内约15%的已婚夫妇受到生殖健康问题的困扰,而我国已婚夫妇中不能生育率占比约为12.5%[1-2]。体外受精(IVF)是辅助生殖技术的核心部分,亦是近代医学进程中治疗不孕症的最重要方式之一。但该种方式治疗现状并不乐观,据欧洲IVF检测协会(EIM)公布的数据显示,IVF周期妊娠率低于20%[3]。绝大多数接受治疗的患者需要承受反复受精失败、生化妊娠等不良结局,不仅对其造成巨大的经济压力还会影响身心健康。目前,人们致力于研究IVF不良结局致病原因,期望通过早期干预来防治不良结局的发生。有研究表明,孕妇外周血液中NK细胞、调节性T细胞(Regulatory T cell,Treg)细胞数目和功能上调能够帮助维持妊娠活动的正常进展[4]。而最新的观点表示,NK细胞数目和功能变化不仅与辅助生殖技术不良治疗结局相关,还会参与到生殖失败的发病机制。资料显示,随着外周血NK细胞数目和活性的增加IVF周期胚胎植入率明显下降,而Treg细胞特征标志物叉头样转录因子P3(forkhead box P3,FoxP3)表达也显著减少[5]。基于此,本研究分析外周血中NK细胞通路调节Foxp3表达对IVF的影响,为IVF不良结局预防和治疗提供指导。
资料与方法
一、研究对象
选取我院自2018年1月至2019年1月间收治的75例IVF不良结局患者。
纳入/排除标准:婚后同居时间≥1年,行IVF失败者;对研究知情且自愿参与临床研究者,经医院伦理委员会批准实施;排除合并染色体核型异常、多囊卵巢综合征、性激素异常和抗心磷脂综合征等自身免疫系统疾病者。
依据IVF失败类型分成3组:实施IVF≥3次均未获得妊娠者(反复失败组,25例);实施IVF后仅生化妊娠患者(生化妊娠组,25例);实施IVF后妊娠12周内胚胎停止发育/自然流产者(流产胚停组,25例)。选取同期生育1次的健康未孕女性25例作为对照组。
二、研究方法
1.试剂与仪器:人淋巴细胞分离液购自天津灏洋生物制品公司;CD3-APC、CD4-PerCP、CD16-FITC、CD25-FITC、CD56-PE流式抗体和CFSE细胞膜染料均购自美国eBioscience公司;人CD4+CD25+Treg分选试剂盒、T细胞活化/扩增试剂盒以及人NK细胞磁珠分选试剂盒购自美国Miltenyi Biotec公司;牛血清白蛋白、胎牛血清(FBS)和RPMI1640均购自美国Gibco公司;无菌EDTA抗凝采血管、96孔培养板均购自美国BD公司;磷酸盐缓冲液购自美国SAB公司;EasySep Direct Human Totallymphocyte kit 购自美国Stemcell公司。
变温冰箱购自韩国SAMSUNG公司,BX51型正立式显微镜购自日本Olympus公司;分析天平购自瑞士Mettler Toledo公司,低速离心机购自美国Thermos公司,流式细胞检测仪购自美国BD公司。
2.样本采集:负压针采集IVF不良结局患者、对照组受检者外周静脉血样3 ml,注入6 ml无菌EDTA抗凝管中颠倒2~3次。离心机预冷至20℃,配置染色缓冲液、破膜/固定液等,置于4℃冰箱待用。采用密度梯度离心法分离外周血单个核细胞(PBMC)[6]。
3.测定方法:采用免疫磁珠分选法从PBMC中分离NK细胞、CD4+CD25-Treg细胞。
NK细胞分选、扩增培养及活性检测:依据人NK细胞分选试剂盒说明获得纯化的NK细胞。染色计数后采用流式细胞术测定纯度。取4支试管,依据表1的方式加入流式抗体和NK细胞悬液,注意不要碰到管壁,涡旋混匀后室温避光保存20 min。使用三色流式细胞检测仪测定外周血NK细胞亚群(图1),用Cell quest软件分析换算CD3-、CD56+CD16-和CD56+CD16+细胞比例。

表1 流式抗体和NK细胞悬液加入方式
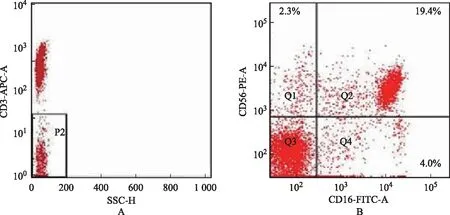
A:CD3-细胞群分布在P2门内;B:CD56+CD16+分布于Q2象限,CD56+CD16-分布于Q1象限,Q1、Q2象限之和为CD56+图1 流式细胞检测仪测定外周血NK细胞亚群
FoxP3 mRNA表达测定:将CD4+CD25-Treg细胞与TNF-α活化的NK细胞共培养,采用抗CD3/CD28微珠刺激培养3 d。采用实时定量PCR(qPCR)技术以Trizol提取总RNA逆转录合成cDNA,然后进行PCR扩增。(1)引物:目的基因FoxP3引物序列:上游5’-GAGAAGGAGAAGCTGAGTGCCAT-3’,下游5’-AGCAGGAGCCCTTGTCGGAT-3’,扩增片段154 bp[6]。内参基因β-actin引物:上游5’-TGACGTGGACATCCGCAAAG-3’,下游5’-CTGGAAGGTGGACAGCGAGG-3’,扩增片段长度为205 bp。(2)反应条件:95℃ 5 min;95℃ 40 s、58℃ 40 s、72℃ 40 s,22个循环;最后72℃ 7 min。(3)扩增产物:qPCR产物进行1%琼脂糖凝胶电泳,在凝胶成像系统中拍照。(4)荧光定量检测:使用图像分析软件分析各条带平均灰度值,β-actin为内参照,用FoxP3/β-actin的CT比值表示。
NK细胞对FoxP3表达的调节:将免疫磁珠分离纯化的CD4+CD25-Treg细胞以每孔1×105个加入到96孔板中,均饥饿24 h后同步化,按照不同处理进行分组:M0组(空白组)加3%FBS培养液培养,M1组加含20 ng/ml的TNF-α,M2组加TNF-α活化的NK细胞,培养3 d,流式检测FoxP3的表达情况。
三、统计学方法
结 果
一、患者一般资料比较
3组IVF不良结局患者及对照组间年龄、月经周期比较均无统计学差异(P>0.05);3组IVF不良结局患者间不育原因构成比较亦无统计学差异(P>0.05)(表2)。
二、各组受检者外周血NK细胞各亚群水平差异
与对照组比较,3组IVF不良结局患者CD56+CD16-NK细胞水平略下降,但4组间比较无统计学差异(P>0.05)。相较于对照组,3组IVF不良结局患者CD56+NK细胞、CD56+CD16+NK细胞水平均显著升高(P<0.05);3组IVF不良结局患者中流产胚停组CD56+NK细胞水平显著高于其他两组(P<0.05)(表3)。
表2 各组患者一般资料比较[(±s),n(%)]
表3 4组受检者NK亚群活性百分比(%)比较 (±s)
注:与对照组比较,*P<0.05;与其他各组比较,#P<0.05
三、各组受检者中CD4+CD25-Treg细胞中FoxP3 mRNA的表达情况
qPCR检测结果显示,3组IVF不良结局患者CD4+CD25-Treg细胞的FoxP3 mRNA表达量存在明显差异,流产胚停组显著高于其他两组(P<0.05)。反复失败组和生化妊娠组Treg细胞中FoxP3 mRNA表达量最低,流产胚停组次之,与健康对照组比较均有统计学意义(P<0.05)(图2)。
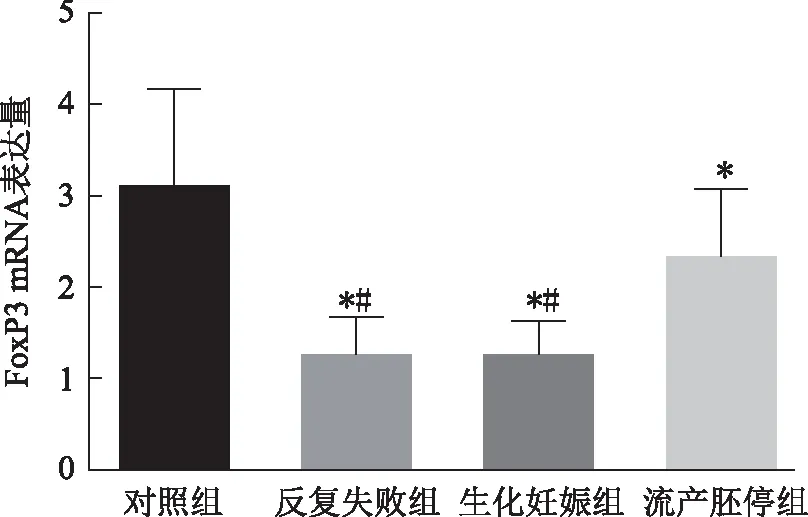
与对照组比较,*P<0.05;与流产胚停组比较,#P<0.05图2 qPCR检测4组间Treg细胞中FoxP3 mRNA表达情况
四、TNF-α诱导NK细胞影响CD4+CD25-Treg细胞中FoxP3表达
取流产胚停组CD4+CD25-Treg细胞,添加TNF-α培养3 d后(M1组),FoxP3表达略降低,但与M0组差异无统计学意义(P>0.05);而CD4+CD25-Treg细胞与TNF-α活化的NK细胞共培养3 d后(M2组),FoxP3表达显著下降,显著低于M0组(P<0.05)(图3)。分析NK细胞与CD4+CD25-Treg细胞中FoxP3表达的关系,显示两种细胞呈负相关,相关系数r=-0.51(P<0.05)。

M0:空白组;M1:TNF-α组;M2:TNF-α活化NK细胞组图3 TNF-α诱导的NK细胞对FoxP3表达的影响
讨 论
NK细胞是一群具有独特杀伤、免疫调节功能的大颗粒淋巴细胞,健康人的外周血中含量仅为淋巴细胞的5%~10%间。在以往的研究中,人们发现NK细胞所介导的天然免疫应答在宿主抵抗病原菌感染、恶性肿瘤中发挥了巨大的作用[7]。近年来,人们发现外周血NK细胞数目增加或毒性表型活性升高,Treg细胞数目下降或功能下调与原发性不孕、习惯性流产等密切相关[8-9],该两种细胞数目和功能对IVF结局的预测价值已得到证实,而作为Treg特征性标记物的FoxP3的表达也直接关系IVF的结局。本研究分析IVF不良结局是否与NK细胞调节FoxP3的表达有关,为改善IVF结局提供一定参考。
研究中将IVF不良结局患者依据失败类型分成3组,并且与已育健康女性进行对比分析,结果显示病例组患者NK细胞中CD56+、CD56+CD16+活性均显著高于健康对照组,但3组间CD56+CD16+数目无明显差异,而流产胚停组CD56+活性显著高于其他两组,可能与检测操作不当形成误差有关,亦或者存在某种内在联系需要进一步验证;与此同时,4组受检者细胞分泌型CD56+CD16-NK细胞数目无显著差异,与路岳超[10]的研究结果大致吻合,提示IVF不良结局仅与CD56+、CD56+CD16+NK细胞数目增多有关。NK细胞中CD56+CD16+细胞亚群约占NK细胞亚群的90%以上,其可通过非特异性溶细胞、抗体Fc段结合介导抗体依赖的细胞介导的细胞毒性作用(Antibody dependent cell mediated cytotoxicity,ADCC),起到杀灭细胞的作用,因此也被称之为NK细胞毒性表型;而起免疫调节作用的CD56+CD16-NK细胞占比约为10%[11-12]。外周血NK毒性表型上调导致IVF不良结局的机制可能有以下几点:首先,NK毒性表型细胞上调会影响子宫内NK细胞活性变化,而子宫内NK细胞均由外周血分化而来,子宫内NK细胞增殖会在母胎界面分泌硫酸软骨素蛋白聚糖、穿孔素等分子继而发挥非特异性溶胚胎细胞作用,导致胚胎细胞损伤引发流产[13];其次,外周血NK毒性表型细胞数目增加会促使NK细胞毒性增强,继而影响循环系统的免疫耐受,导致着床失败。
qPCR检测结果显示不同类型IVF不良结局患者中FoxP3 mRNA表达存在明显差异,推测FoxP3参与到了IVF的整个活动中,且对IVF可能起到保护作用。本研究的不足是未开展免疫组化实验进一步证实FoxP3在血液细胞中的表达情况,而相关研究显示,癌症细胞中内源性FoxP3多表达于细胞核中,激光共聚焦结果显示多表达于细胞浆中,主要因为肿瘤组织、细胞微环境差异所致,推测在IVF不良结局中FoxP3表达的不同也对其微环境起到调节作用[14]。
以往的研究和本实验结果,均提示外周血NK细胞毒性表型、Treg细胞功能表型都参与了IVF不良结局的过程。有资料显示,CD56+CD16+NK细胞活性>12%、CD4+CD25+FoxP3+Treg细胞<2%对IVF不良结局有预测价值[15]。NK细胞可表达免疫激活型、抑制型受体,并通过这些受体行使其生理功能[16-17]。若相应配体和激活型受体发生结合,NK细胞活化后会分泌大量的效应分子以发挥其作用。本研究结果显示,经TNF-α活化的NK细胞刺激CD4+CD25-Treg细胞后,FoxP3表达量显著低于空白组(M0组),虽然经单纯TNF-α刺激后FoxP3表达也有下降,但差异无显著性,提示活化的CD56+CD16+NK对FoxP3表达有抑制下调作用,从而导致Treg细胞数目和活性下降。
综上所述,NK细胞可通过抑制Treg细胞中FoxP3的表达来产生非特异性溶胚胎细胞作用,且可通过抗体Fc段结合产生ADCC效应损伤胚胎细胞,影响正常的妊娠活动,导致反复受精失败、生化妊娠以及流产胚胎停育等不良妊娠结局发生。
