对具有一个共同亲本的杂种F1育性差异的初步研究
2020-03-19兰秀锦
陶 军,兰秀锦
(1.四川农业大学小麦研究所,成都 611130;2.绵阳市农业科学研究院,四川绵阳 621023)
对于小麦这种自花授粉作物,获得雄性不育是杂种优势利用的基础,而可遗传的雄性不育又最为经济有效。最早于1951 年就报道用核替换的方法得到了不同种的核质互作形成的小麦不育系[1],这也成为后来创造不育的一种方法,这种不育系具有异源细胞质。在没有异源细胞质存在的情况下,1959年就已经在小麦种间杂交后代中发现了不育材料[2]。至今人们已经在小麦中发现了很多种不育。众所周知,在远缘杂交中F1常表现为不育,不育的原因是F1的两个亲本之间的亲缘关系太远,来自两个亲本的两套染色体不能够很好地配对,减数分裂时同源染色体不能正常地配对并分离到两个子细胞中去,只能随机地分离,因此理论上很难有包含正常染色体数目的配子,这些不具有完整染色体的配子通常不能形成有功能的花粉粒。现在在常规育种中发现了一种F1不育现象,首先是育成了一个带有一对中间偃麦草外源染色体的小麦材料(2n=42,后定名为014-459),2006 年用 014-459 与另一普通小麦杂交,2007 年种植成的F1在开花期表现为不育,套袋结实率为0。连续几年重新配制这一组合及其反交组合,种植成的正反交组合F1套袋结实率均为0,用亲本回交得到的F1群体出现育性分离。用014-459与参加四川省区域试验的材料进行杂交测配,发现014-459 与川麦 55 正反交 F1均为不育,014-459 与绵08-9 正反交F1均为可育。用014-459 与不同亲本杂交,得到的F1育性出现根本性的差异,说明这种不育现象与远缘杂交F1不育不同。
1 材料和方法
1.1 试验材料
自育高代材料014-459,四川省审定品种川麦55,区域试验参试品系绵08-9,审定品种川麦107。
1.2 试验方法
1.2.1 F1育性分析
用014-459 分别与川麦55 和品系绵08-9 配制F1。不同年份分别种植014-459 和F1,抽穗后开花前对主穗套袋,灌浆后成熟收获前调查结实率,用套袋结实率代表育性。套袋结实率分为国内法和国际法两种,以国内法统计的结实率为主,只是在进行群体分群时以国内法结果结合国际法结果作为依据,两者均为零的才作为不育。结实率国内法=[(每小穗基部两小花结实粒数/(每穗小穗数×2)]×100%,结实率国际法=[(每穗基部小花结实粒数+每穗中部小花结实粒数)/(每穗小穗数×2)]×100%[3]。
1.2.2 F1染色体配对情况分析
在小麦孕穗期分别取不育F1和可育F1的幼穗,立即放入固定液Ⅱ溶液中,处理24 小时后,将其移入75%乙醇液中,置于4 ℃冰箱长期保存。观察染色体配对情况时将保存在75%乙醇液中的幼穗取出,用水冲洗,取小穗基部小花花药,滴加一滴改良苯酚品红,将花药压碎,显微镜下检查,寻找合适的花药,如果处于减数分裂中期,则压片,用Olympus BX-51 配备的SenSys Olympus DP70 CCD SenSys Olympus DP70 CCD 成像系统照相,保存文件。固定液Ⅱ配方:无水乙醇∶氯仿∶冰醋酸=6∶3∶1。
1.2.3 育性关联分析方法
2015 年配制杂交组合川麦 55×绵 08-9,2016年种植组合(川麦55×绵08-9)F1,并配制复合杂交014-459×(川麦 55×绵 08-9)F1,2016 年秋种植复合杂交F1,2017 年抽穗期至开花前于田间对复合杂交F1群体每一单株主穗进行套袋,灌浆后成熟前调查结实率。苗期取复合杂交F1群体每一单株幼嫩叶片,-20 ℃冰箱保存,待调查结实率后根据结实率数据选取极端表型的单株,将复合杂交F1群体分群,取结实率高和完全不育的单株(套袋结实率国内法及国际法均为0)各20 株分别组成可育群和不育群,加上亲本 014-459 及(川麦 55×绵 08-9)F1,由北京百迈克公司进行SLAF 分析。
1.2.4 转录组分析方法
于小麦抽穗后开花前分别取3 种材料014-459、川麦55 以及014-459 与川麦55 配制的F1的花药,未设重复,对转录组进行分析,RNA 提取及分析由北京百迈克公司完成。
2 结果与分析
2.1 F1染色体配对结果
不育F1(014-459/川麦55)与可育F1(014-459/绵08-9)减数分裂中期同源染色体配对情况比较相似,没有明显的差异,在减数分裂中期Ⅰ,大多数细胞的42 条染色体配对形成20 个二价体和2 个单价体,不育F1和可育F1在减数分裂末期少量细胞出现微核,但比例小,绝大多数细胞不出现微核。不育F1及可育F1减数分裂中期同源染色体配对观察结果分别如图1 和图2。
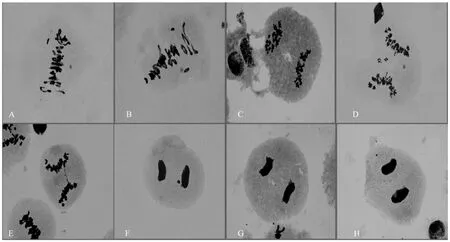
图1 不育F1 的减数分裂图Figure 1 Meiosis map of male sterility F1
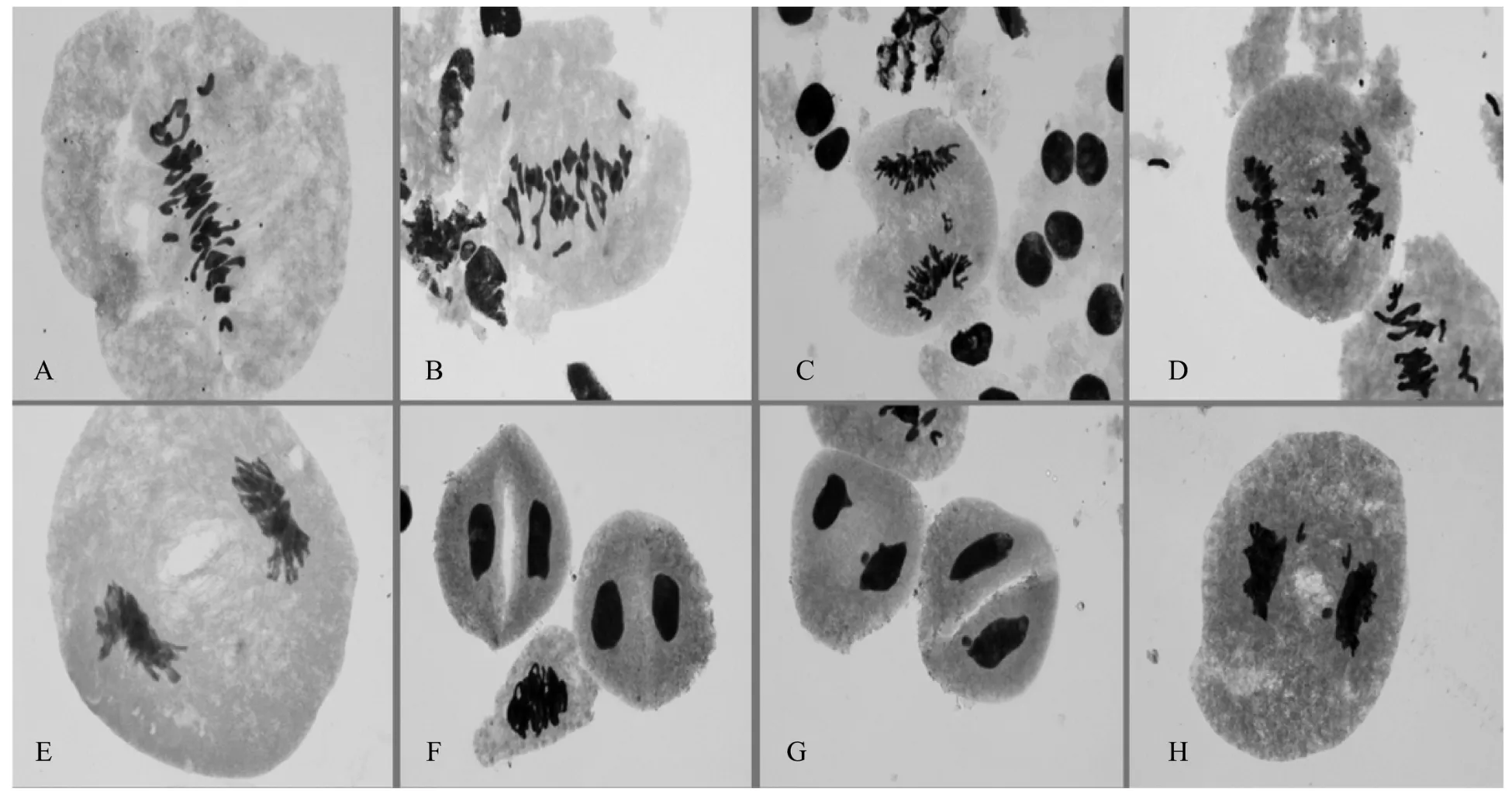
图2 可育F1 减数分裂图Figure 2 Meiosis of male fertility F1
2.2 试验材料及F1代育性结果
对亲本014-459 及其F1不同年份的育性作了观察,2014 年田间调查正反交不育F1,因所有调查穗都未结实,故未调查每穗小穗数,这不影响计算结实率,其结实率均为0,014-459 及可育F1套袋结有部分种子。2017 年调查014-459、F1及对照川麦104 自交结实率,结果如下表1。
不育F1正反交在几个播种时期播种,均较稳定地表现为不育,有个别播种期在个别植株上偶尔结有几粒种子,平均算下来就是某一播期的结实率不到0.5%(国内法)。对照栽培种川麦107 从早播到晚播结实率都比较高,也较稳定,而亲本014-459自交结实率在不同年份间变化范围为42.74%~58.70%,其套袋自交结实率不高,原因有待研究。不育F1与可育F1染色体配对情况相似,但不育F1套袋自交结实率为0,虽然可育F1结实率也不高,但两者明显不同,从染色体配对情况来考虑,不能找到育性差异的原因。不育组合F1之反交组合仍为不育,说明了这种F1不育不是由于细胞质效应引起的。对照品种在不同播种期的结实率有一些变动,但总体还是较稳定的,也说明作为育性指标的结实率易受到各种因素的影响,即使材料本身正常可育,也可能因为开花时的偶然因素如当时的温度、湿度、风,或植株受到病虫等的影响而不能达到100%。
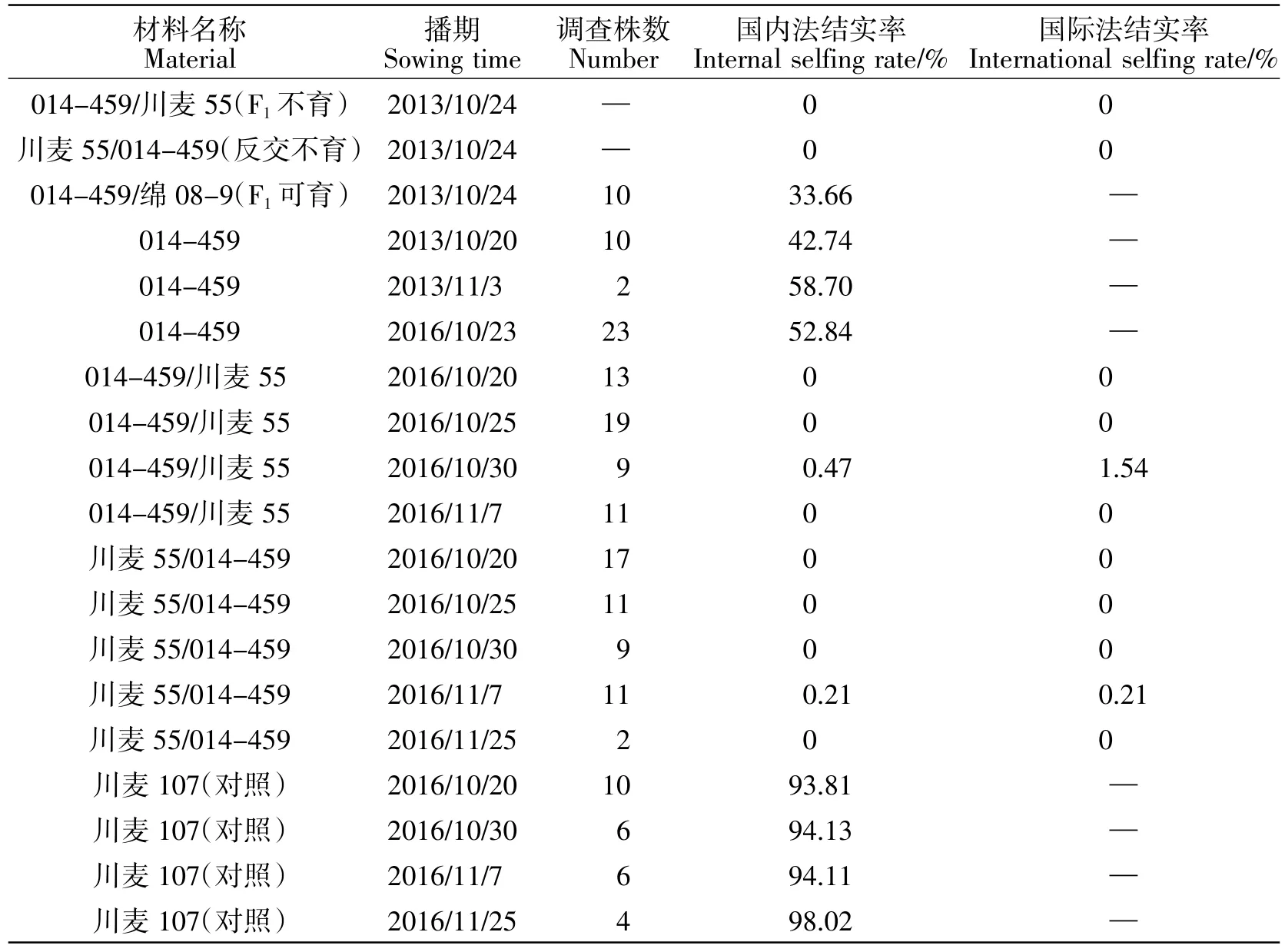
表1 不同时期结实率Table 1 Selfing seed rate in different sowing time
2.3 关联分析结果
对欧式距离(euclidean distance,ED)算法和SNP-index 方法这两种关联分析方法得到的结果取交集,得到与目标性状相关联的区域在染色体上的位置,共3 个区段。欧氏距离是利用测序数据寻找混池间存在的显著差异标记,并以此评估与性状关联区域的方法。混池间除了目标性状相关位点存在差异,其他位点均趋向于一致。欧氏距离取所有位点拟合值的平均+3SD 作为分析的关联阈值,计算得其值为0.41,根据关联阈值判定,得到关联区域。SNP-index 寻找混池之间基因型频率的显著差异进行标记关联分析,用ΔSNP-index 统计。3 个关联区段的位置,大小和其上的基因数列于下表2。

表2 关联区域信息统计表Table 2 Information of associated region
2.4 差异表达基因数目统计
差异表达基因集基因数目统计如下表3。
将材料两两间差异基因绘成维恩图(图3),以方便了解材料间差异情况。
2.5 对候选基因的分析
目标基因在014-459 或川麦55 中存在,或者是不同的基因分别存在二者中,都使亲本表现为可育性状,然而在014-459 与川麦55 配制的正反交F1中,目标基因仍然存在,但却使F1表现为不育,因此最大的可能不是目标基因的有无而是目标基因的表达或者是两个不同基因相互作用使基因表达发生变化而使育性发生了变化,否则目标基因从材料014-459 到F1时不会变为不育。因此目标基因应该存在于不育F1中,不论是来自014-459 还是川麦55,或是分别存在二者中,而014-459 和川麦55 均为可育,因此可能是目标基因的表达发生了变化;同样,从川麦55 到不育F1也应是同样的目标基因表达发生了差异,才可能使可育发生变化,成为不育,也就是说目标基因应该是在两个过程中都发生了相同的表达差异的变化,而且应该是差异表达作用方向一致,才能使亲本从可育转变为F1不育。为此,为了缩小寻找范围,将差异表达的基因限定到014-459与F1不育之间的差异中和川麦55 与F1不育之间的差异中的共同部分,就是图3 中差异基因数目为1 369 和1 234 的两部分,对这两部分组成的合并部分的差异表达基因进行分析。为进一步缩小范围,结合SLAF 结果,选取差异表达的基因位置落在SLAF 分析所得到的3 个区段上的基因,共9 个,列于下表,对这些基因进行分析结果如表4。
基因9 从014-459 到不育F1时其表达量是下降的,但在从川麦55 到不育F1时其表达量是上升的,即它表达量上升或下降都能形成不育,因此基因9 与F1出现不育无关,它不是造成不育的原因,不是目标基因的候选者。对这些候选基因的注释进行检查,发现一些基因在可育亲本与不育F1中虽然表达差异大,但在有些数据库中没有注释。为了便于称呼与区分,将这选出的9 个表达有差异的基因称为候选基因。
在对候选基因进行的注释中发现编号为8 的基因名为 2D01G027900,GO 注释号是 0009753,功能是对茉莉酸起响应,而茉莉酸在调控花药开裂方面有作用,在拟南芥中发现了很多不育与茉莉酸代谢有关,因此基因2D01G027900 很有可能就是与F1不育有关的基因。

表3 差异表达基因数目统计表Table 3 Number of differential expression genes

图3 差异表达基因维恩图Figure 3 Venn diagram of differential expression genes

表4 候选差异基因的表达Table 4 Differential expression of candidated genes
3 讨论与结论
014-459 与川麦55 及绵08-9 分别配制杂交组合,外源染色体均难与普通小麦染色体配对,在F1中42 条染色体中的大多数能形成二价体,不育F1与可育F1相比较,染色体配对情况没有太大差异,而育性却出现了显著差异,配对行为不是育性表现出差异的原因。因此由014-459 得到的F1不育性应该与远缘杂交F1不育有所不同。小麦的不育类型大致分为3 类:核基因不育、细胞质不育和环境条件影响的不育。核基因不育包括隐性核基因不育和显性核基因不育,ms1 的几个等位基因[2,4-8]、潍型不育、普通小麦的一对染色体被长穗偃麦草染色体代换造成的不育(VE 型不育)[9-10]和 DSV 型不育[11]均属于隐性核基因不育;太谷核不育 ms2[12-14]、ms3[15]和 ms4[16],M1376[17]属于显性核基因不育。细胞质不育包括异源细胞质不育,如T[18]、K 和V[19]型细胞质不育、通北野燕麦细胞质(黔型)不育[20]、智利野生大麦细胞质不育[21],以及普通小麦细胞质不育或由普通小麦细胞质经过变异得到的不育,如AL 型[22]、92-18A[23]不育、F 型不育[24-25]、Primepi 细胞质不育[26]、85EA[27-28]、89AR[27]不育等。环境条件影响的不育主要是温光敏或光温敏型不育。包括由细胞质作用导致的温或光敏型不育以及非细胞质作用的温或光敏型不育。细胞质作用导致的温或光敏型不育包括D2类细胞质[29]、KM 型两系杂交小麦[30]、YM[31]、YS[31]型不育和四川南充T 型细胞质两用系[32]不育等;非细胞质作用导致的温或光敏型不育,包括重庆温光型不育C49S 类[33]、河南BNS[34]以及两极不育类94-337s[35](极端早播与极端晚播时不育,正常播种期播种表现为可育)、湖南 ES 类[36]、北京市农科院的 BS20[37]和 BS366[38]等。014-459 有一对来自中间偃麦草的外源染色体,是小麦一对染色体被一对中间偃麦草染色体代换,其本身可育,014-459 分别与川麦55 及绵08-9 配制的杂交组合F1育性出现显著差异,与普通小麦的一对染色体被一对长穗偃麦草染色体代换得到的代换系VE 型不育不同。由014-459 得到的这种不育现象与细胞质不育及已知的显性或隐性核不育不同,也不同于环境条件影响形成的不育。通过研究不育基因在染色体上的位置,发现不育基因存在于多条染色体上,如4BS[6-8,39,40](主要是ms1 的几个等位 基 因)、4DS(ms2[14,41],ms4[16])、5AS(ms3)[42]、3AL(ms5[7])、7B(VE 型不育)[10]、1BS[19,31]、3A(农大3338)[43]、2B[44-46]、5B[44]和 7DS[46]。根据 SLAF 分析得知 014-459导致的不育的育性关联区域在2D 染色体上,与以往发现的不育基因位置不同;另外014-459 F1不育是在一条中间偃麦草染色体存在的情况下表现不育,因此2D 染色体上与育性有关系的基因可能不是单独起作用,而是与中间偃麦草染色体共同起作用才产生不育。茉莉酸(Jasmonates,JA)是植物应答刺激以及调控生长发育过程的一种植物激素,能诱导开花习性,使颖花开放,在调控花药开裂方面起重要作用,很多拟南芥不育与茉莉酸代谢途径有很大关系。一般认为亚麻酸是JA 合成的基础,JA 生物合成的主要通路[47]:膜脂-亚麻酸-13HPOT-OPDA-JA,其中膜脂经磷脂酶作用释放亚麻酸,亚麻酸被LOX酶氧化为 13HPOT,13HPOT 由 AOS 和 AOC 酶转化成OPDA,OPDA 被酶OPR 经一步还原反应和3 步β 氧化成为JA。各步所需的酶为磷脂酶PLA,脂加氧酶LOX,丙二烯氧化物合成酶AOS,丙二烯氧化物环化酶AOC,12-氧代-植物二烯酸盐还原酶OPR,每一个酶都对JA 的合成起调控作用,进而影响花药开裂。由小麦材料014-459 导致的F1不育,田间表现为颖壳张开,花丝会伸长,花药露出颖壳,花药颜色也会变黄,但是不开裂,几天后花药干枯萎蔫。结合F1不育的田间表现与基因注释,认为GO注释号是0009753,功能为对茉莉酸起响应的基因2D01G027900 是F1表现出不育的关联基因。
