从真实情境到驱动性问题链的素养为本的教学
2020-03-18王换荣何银华肖中荣
王换荣 何银华 肖中荣
摘要:以“溶液的酸碱性”单元复习课教学为例,从某化工厂排放污水引发危害到高中生如何处理污水作为教学情境贯穿全程。创设了“粗略、精确测定某化工厂排放污水的酸碱性”“比较中和剂生石灰和碳酸钠将酸性污水中和至达到排放标准的性价比”“用滴定法准确测定污水中氢离子浓度”三个探究情境,并设置应景的驱动型问题链和学习活动群,以更好地促成学生的思维结构化和知识网络化,发展学生的化学核心素养。
关键词:真实情境;驱动性;问题链;素养为本;溶液的酸碱性
文章编号:1008-0546(2020)03-0002-05
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2020.03.001
林崇德在《21世纪学生发展核心素养研究》中指出:“化学核心素养是学生在化学认知活动中发展起来的并在解决与化学相关问题中表现出来的科学素养[1]。”杜威曾指出:“从别人那里听来的知识也许能使人产生某种行动,但这种知识不能培养个人的主动性和使他忠于他人的信念。”情境教学的核心就是“知识只有在它们产生及应用的情境中才能产生意义”[2],教学中选择与创设生产、生活、工业等真实情境能激发驱动性问题的产生,推动认知过程的行进,维持实践活动的展开,调整情感体验,强化知识技能的落实,并反映学生从化学视角认识客观事物的方式与结果的水平,对培养和发展学生的核心素养举足轻重。
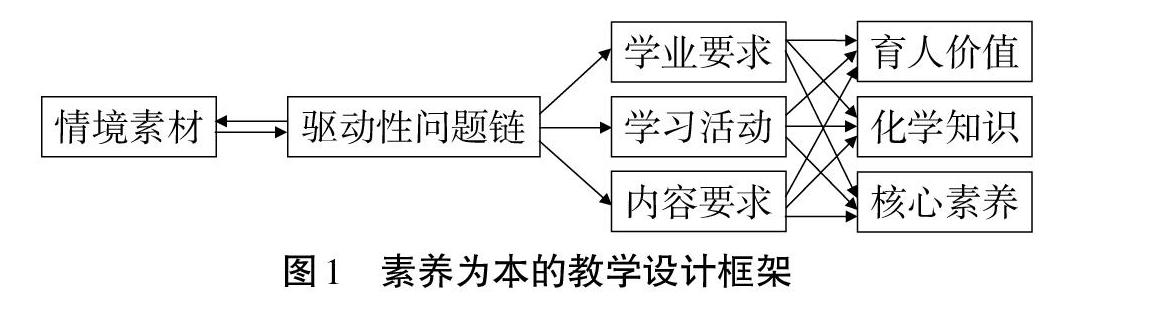
问题驱动教学法是“一种以学生为主体,以问题核心规划学习内容,让学生围绕问题寻求解决方案的一种学习方法”。教学情境作为知识建构的载体,应在教学的全程发挥作用,持续产生驱动性问题,使教学如抽丝剥茧般不断深入,驱动学生层层深入分析问题,解决问题,从而获得知识与方法[3],并在活跃其思维的过程中内化为学生的化学学科核心素养,如图1所示。图2指出,如何巧妙提出高质量、高水平的问题,如何形成一条由情境串产生的问题链,成为促进思维发展的教学的关键点,这样的问题链利于结构性思维的形成[4]。
一、素养为本的教学设计主线
1.创设持续产生问题链的真实情境
教學情境可以围绕主情境分阶段设计,逐步地扩展、深入、充实、明晰,既能成为课题问题产生的源头,又能使整个教学围绕情境产生的问题链展开。以苏教版《化学反应原理》专题3第二单元溶液的酸碱性复习课为例,表1给出相关的情境素材,本节课选择“某化工厂排放污水引发危害到高中生如何处理污水”作为教学主线,将“粗略、精确测定溶液的酸碱性、比较选择中和剂生石灰和碳酸钠将污水中和至达到排放标准的性价比、滴定法测定酸性溶液中氢离子浓度”融人问题情境中,旨在构建由碎片到整体的认知方法,培养灵活、综合、有效地处理复杂问题的迁移能力,发展学生的化学核心素养,使学生能用化学专业的视角面对相关的技术、环境、社会问题。
2.确定素养为本的教学目标
2018年浙江省普通高中学业水平考试导引规定本单元的教学内容包括溶液的酸碱性与c(H+)和c(OH-)的关系,溶液pH的定义,pH与溶液酸碱性的关系,测定溶液酸碱性的方法,酸碱指示剂(石蕊、酚酞、甲基橙等),pH试纸,pH计。高考考试说明中增加了pH的简单计算。结合2017版《普通高中化学课程标准》的教学要求确定本单元复习课的教学目标如表2[5]。
二、素养为本的教学设计
“溶液的酸碱性”教学流程如图3所示[6],具体分四步展开。
1.在真实情境中生成驱动性问题链
[主情境]展示视频及图4。视频中呈现出工业污水排放引起水源污染,破坏人的身体健康,降低河水的自净能力,破坏生物链,使河流中的动植物和微生物无法生存。即使酸碱污水先进入污水处理厂后,也会导致活性污泥中的微生物生长受到抑制,直接影响二级处理出水的水质。
[问题1]你了解去油污的纺织业污水和溶金属的冶金工业污水酸碱性吗?
[问题链1]学情前测——判断以下问题是否正确。
(1)有氢离子的溶液就是酸性溶液。
(2)pH<7的溶液一定是酸性溶液。
(3)c(H+)>c(OH-)的溶液一定是酸性溶液。
[学生活动1]学生回答,小组补充、修正,整理归纳溶液呈酸性的本质原因。
2.在学习活动群中解决问题
[探究任务1]:请设计实验粗略确定某化工厂排放污水的酸碱性。
[投影]:溶液酸碱性粗略分析一指示剂或pH试纸,表3给出常见指示剂变色范围。
[学生活动2]:请同学们规范使用pH试纸测定工业污水的酸碱性。
[问题2]除pH试纸外,你还知道哪些测定pH值的方法?
[问题链2]
(l)pH试纸测定溶液pH时,若先用蒸馏水湿润试纸,一定会对实验结果产生影响吗?
(2)pH试纸估读pH值为2,能确定其中氢离子的精确浓度吗?
(3)溶液酸碱性精确测定仪器—pH计(酸度计)如何使用?
[学生活动3]学生回答,小组补充、修正,整理归纳pH试纸和pH计的使用方法。
[问题3]pH是表示稀溶液中氢离子浓度的简易方法,根据pH=-lgc(H+)可知,常温下pH=2.0的污水中c(H-)=_____,污水中的c(OH-)=____。
[问题链3]在酸碱污水排人污水处理厂之前应处理,以避免对污水处理厂造成损害。你能用化学的视角解决这些问题吗?参考《污水综合排放标准》( GB8978-1996)三级标准:常温下pH在6到9之间的污水可以排人污水处理厂。请思考以下问题:
(1)此化工厂污水能否直接排放?
(2)达到排放标准就是调节pH=_,即调节c(H)从____ mol/L变成___ mol/L。
(3)参考浓度计算公式,如何实现pH从2变成67
[学生活动4]学生回答,小组补充、修正,整理归纳常温下稀的酸性或碱性溶液中pH和pOH的计算。
[情境支链]工业污水处理要根据其性质选用合适的药剂,如絮凝沉淀的有机高分子絮凝剂、脱水剂、脱色剂、消泡剂、消毒剂、混凝剂等。处理酸性污水时,首先考虑以废治废的原则,将酸碱性污水互相中和,或者利用废碱渣中和酸性污水。条件不具备时,才使用中和剂处理。酸性污水中和处理经常采用的中和剂有生石灰、石灰石、白云石、碳酸钠等。
[问题4]假如你是污水处理厂的一员,你准备采取什么措施让酸性污水达到排放标准?
[问题链4]
(1)1.0L pH=2.0的污水若直接用水稀释至达排放标准,需要加入水约为____L(忽略体积相加误差)。
(2)若将污水稀释105倍,pH≈____;若将污水稀释106倍,pH≈___。
(3)若加人生石灰0.56g进行中和处理(忽略生石灰与水反应产生的误差),该溶液符合排放标准吗?
[探究任务2]:请选择酸性污水中和处理经常采用的两种中和剂生石灰和碳酸钠,如图5和图6,当pH从2.0调到6.0时,各需要多少克可以中和污水至达到排放标准?两者的性价比哪个高?
[学生活动5]学生回答,小组补充、修正,整理归纳常温下将酸性溶液稀释一定倍数后pH的计算,一定体积的酸、碱溶液混合后pH的计算。
[教师过渡]定性分析用于鉴定物质是由哪些成分组成,定量分析用于测定物质中各组分的含量,酸碱中和滴定是定量分析的一种。
[问题5]工厂排放出的污水,用pH试纸测得pH约为2,请设计一个实验准确测量该污水中H_的浓度。
[探究任务3]取一定体积的污水,用O.lmol·L-1的NaOH溶液与之反应,测出用去NaOH的体积,再计算求得污水中H+的浓度,但如何确保测定结果的精确度值得探讨。
[教师过渡]酸碱中和滴定指用已知浓度的酸(或碱)去滴定一定体积未知浓度的碱(或酸),通过测定反应完全时消耗已知浓度的酸(或碱)的体积,从而推算出未知浓度的碱(或酸)的浓度的方法。酸碱恰好完全反应时即滴定终点。
[问题链5]
(1)当酸和碱恰好完全反应时,n(H+)一定等于n(OH-)吗?,什么情况下n(H+)一定等于n(OH-)?
(2)如何判断酸、碱恰好完全反应?
(3)既然指示剂变色时溶液的pH值不是7,能否用指示剂来判断酸和碱完全反应呢?
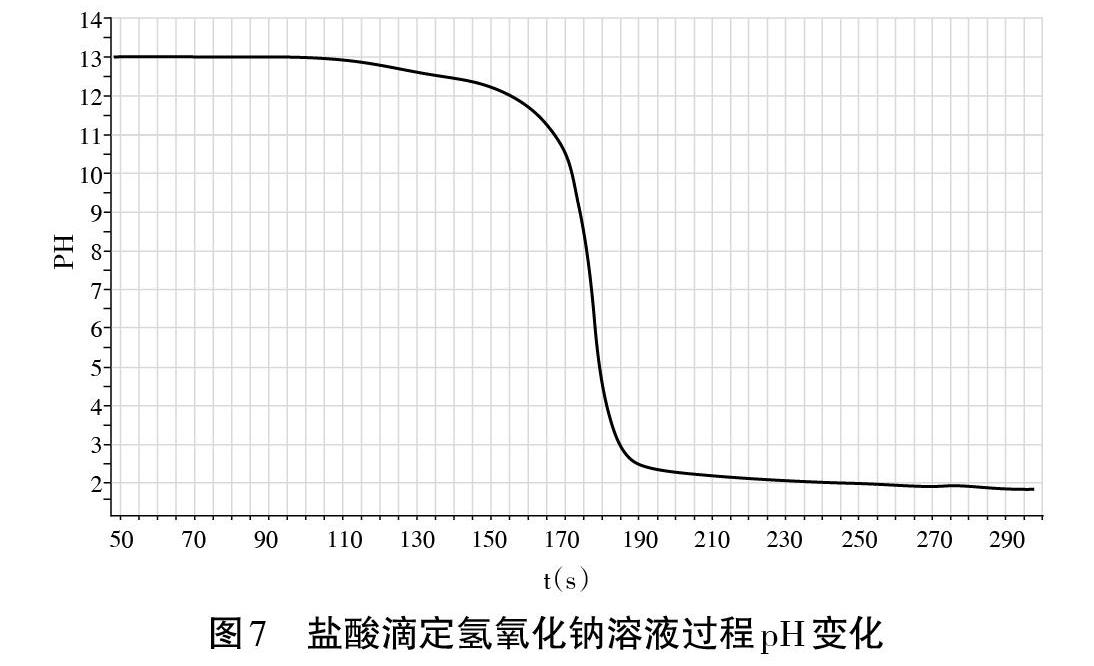
[教师演示]用0. Imol.L-1盐酸滴定20.OOmL未知浓度氢氧化钠溶液,用酚酞作指示剂,用手持技术pH计测量并绘制成图7。
[问题6]从图7看,在盐酸和氢氧化钠溶液反应过程中溶液pH变化分几个阶段?为什么会有这样的变化趋势?
[学生活动6]学生回答,小组补充、修正,整理归纳:三个阶段。第一阶段,溶液中NaOH的量较多,滴加盐酸pH变化不大;第二阶段,溶液中NaOH量较少,滴加盐酸pH变化大;第三阶段,溶液中NaOH消耗完,滴加盐酸pH变化不大。
[问题链6]
(1)通过以上分析,能否用指示剂判断强酸和强碱恰好完全反应,為什么?可以选择什么指示剂?
(2)用标准盐酸溶液滴定一定体积未知浓度的氨水,滴定终点选择什么指示剂?为什么?
(3)用标准氢氧化钠溶液滴定一定体积未知浓度的醋酸溶液,滴定终点选择什么指示剂?为什么?
[教师过渡]下面就用酚酞作为指示剂,用O.lmol.L-1的NaOH溶液测定未知浓度的酸性工厂污水中H+浓度,请同学们注意观察实验过程,并记录有关实验数据,最后计算工厂污水中H+浓度。
[投影]中和滴定操作步骤:酸式滴定管:检漏、洗涤(自来水、蒸馏水)、润洗、装待测液、赶气泡、调液面、记录读数。锥形瓶洗涤:洗涤(自来水、蒸馏水)、装待测液、加指示剂酚酞。碱式滴定管:检漏、洗涤(自来水、蒸馏水)、润洗、装标准液、赶气泡、调液面、记录读数。
[学生活动7]学生做滴定实验:滴加NaOH溶液,边滴边振荡,眼睛始终注视锥形瓶内溶液颜色变化,指示剂颜色变化半分钟内不褪色,达到终点,记录液面刻度,重复操作2-3次。
[问题7]请分析c未知=(c已知×V已知)/v未知,哪一个是关键数据?
[问题链7]
(1)通过以上实验,你认为中和滴定实验的作用是什么?
(2)依据原理是什么?
[学生活动8]学生回答,小组补充、修正,整理归纳中和滴定实验的作用和原理。
3.在思考中促成思维和知识结构化
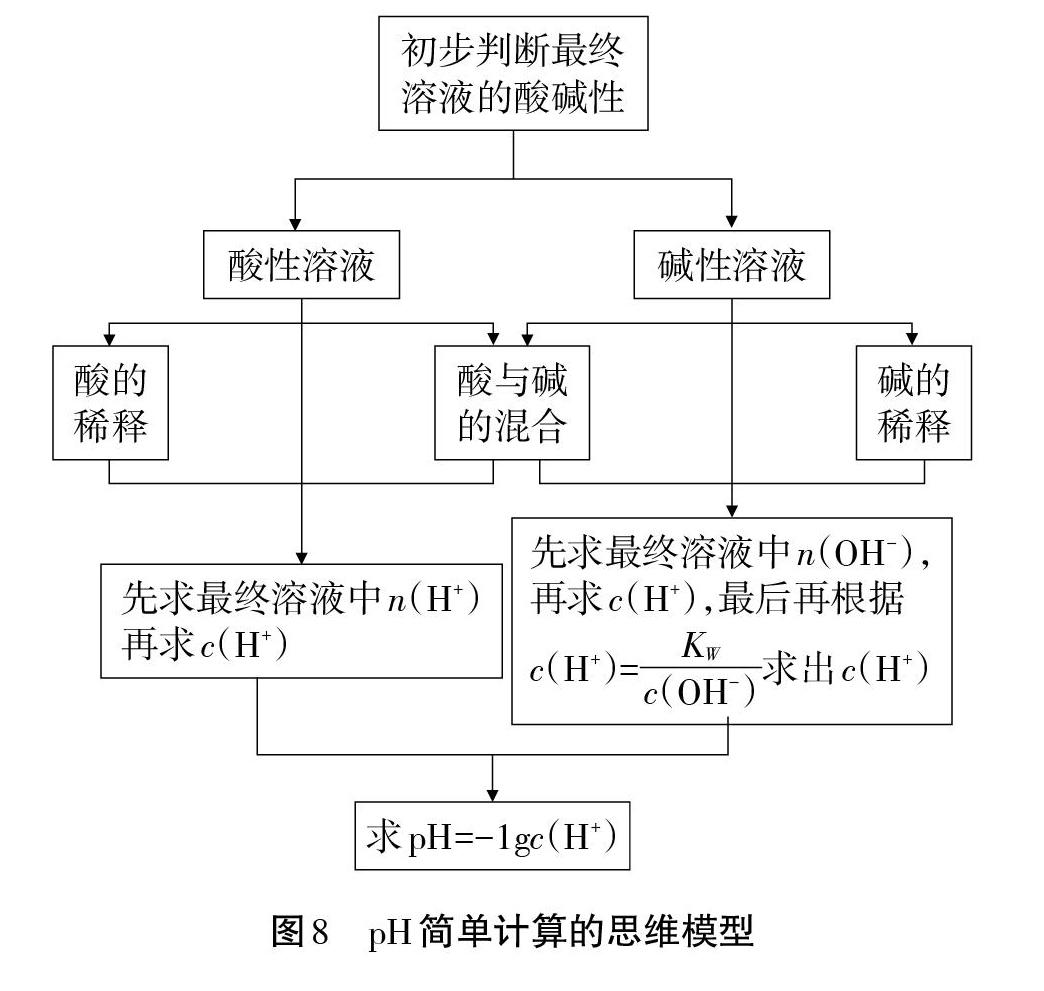
[教师过渡]请同学们总结调节溶液酸碱性的方法,根据c= n/v,可以采用稀释或酸碱中和反应。请同学们建构溶液中pH简单计算的思维模型。
[投影]:学生思考后,展示图8 pH简单计算的思维模型。
4.在学习中培养科学态度和社会责任
[图片展示]从生活、生命的各个领域了解pH的重要应用。
[教师讲解](1)图9中绣球花具有根据土壤酸碱度不同绽放出不同颜色花朵的特性。pH为6.0-7.0的土壤中会绽放出粉红色花朵,pH为5.0-5.8的土壤中会绽放出蓝色花朵。
[教师提问]通过查阅资料,大家发现想要调成蓝紫色,可以在花苞成型之前,给土壤里加什么?想要绣球开粉红色呢?
[学生]加入一些白醋、硫酸铝、钾肥的混合物,将土壤调成偏酸性,同时富含A13+的土壤被绣球花吸收之后,会和花中的花青素相结合,产生变异现象,花朵就会变成蓝紫色。想要绣球开粉红色的花,可以在花蕾形成的时候施用适量的草木灰。等绣球花呈现粉色之后,再施硫酸铝等酸性肥料,则可以呈现蓝紫粉色。
[教师讲解](2)水的酸碱性是由溶解于水的矿物质决定的。《世界卫生组织饮用水标准》规定饮用水的pH为6.5- 8.5。世卫组织的表述为:“低pH值水具有一定腐蚀性,而高pH值水会有滑腻感和异味”。但并未提及饮用水呈弱碱性与健康有多大关系。
[教师提问]农夫山泉的“天然弱碱性水”并不是行业个例。新的《食品安全国家标准包装饮用水》( GB19298-2014)要求除了天然矿泉水有另行的国家标准外,市场上的包装水只分为饮用纯净水和其他饮用水两类。图10为农夫山泉饮用天然水的pH。请大家思考“矿物质如何决定水的酸碱性”?
[学生回答]水的酸碱性是由水中矿物质离子的水解决定的。
[教师过渡]关于“离子的水解”下节课复习。
三、教学反思
(1)创设真实情境展开教学。情境有具体性和原创性的特征,本节课从某化工厂排放污水引发危害这个主情境出发,衍生出多个学科问题,“粗略、精确测定某化工厂排放污水的酸碱性”“比较选择中和剂生石灰和碳酸钠将酸性污水中和至达到排放标准的性价比”“用滴定法准确测定污水中氢离子浓度”,将化学知识通过情境活动与核心素养对接,帮助学生形成知识网络。
(2)设置结构性问题链推动教学。教师从真实情境中提炼出丝丝人扣的结构性问题链,学生攀沿着问题链上的关键词不断地进行思考,逐步深化思维[4]。根据素材“常温下pH在6到9之间的污水可以排入污水处理厂”设置三个问题,pH约为2的工厂污水能否直接排放?达到排放标准就是调节pH=___,即调节c(H+)从____mol/L变成___mol/L。参考浓度计算公式,如何实现pH从2变成67其中,知识性问题要依据事实性知识回答.解决问题的过程和方法要依据事物间或事物各部分间的关系或结构进行论证推理,并在此过程中学会应用知识解决实际问题的策略,帮助学生形成结构化思维。
(3)倡导有理有据的辩论调整教学。皮亚杰的两种学习方式同化和顺应发生的前提是先辨认,这就需要批判、反问、辩论。本节课的设计摒弃一味接受、缺少辨认的教学过程,设置“强酸和强碱恰好完全、盐酸滴定氨水终点、氢氧化钠滴定醋酸终点选择的指示剂一致吗?选择依据是什么?”等问题链,让学生在辩驳中产生同化或顺应,帮助学生做到真正的学习。
(4)关注素养达成情况诊断教学。教师是问题的提出者、课程的设计者以及结果的评估者。素养为本的教学要求关注教、学、评一体,本节课设置了与教学目标相对应的教学评价任务,选择“绣球花具有根据土壤酸碱度不同绽放出不同颜色花朵的特性”“农夫山泉的天然弱碱性水与健康有多大关系”两个pH的重要应用,采取教师点评、学生互评等评价方式诊断学生所达到的素养水平,进而更好地指导教学。
参考文献
[1]林崇德.21世纪学生发展核心素养研究[M].北京:北京师范大学出版社,2016
[2] Brown J S,Collin A, Duguid P.Educational Researcher,1989,18(1):32-42
[3]胡久华,乔敏,例谈化学课堂上教学情景的创设[J].化学教育,2008,29(5):12-14,27
[4] 杜秀红,崔节虎.基于结构性思维的生物化学实验教学探索[J].化学教育,2019,40(8):78-82
[5]耿亚萍,基于生活问题情境的化学核心素养的培養研究一以铁及其化合物复习为例[J].化学教育,2019,40(7):38-41
[6]刘妍,王秀红,张冬华.基于化学学科核心素养的“铁盐和亚铁盐”教学设计[J].化学教育,2019,40(7):33-37
