联合VEGF-165和PDGF-BB促进骨髓间充质干细胞血管化的体内研究
2020-03-18毕翔宇何惠宇
毕翔宇,孙 安,何惠宇
面对肿瘤、颌骨囊肿及外伤等造成的大范围骨组织缺损,自体骨移植由于骨量不足不能完成对大块组织缺损的修复[1]。目前人工合成的组织工程骨虽然不受骨量不足的限制,但许多研究均发现由于缺乏有效的血液供应,来自组织液的氧气和营养物质只能满足人工骨支架外层100~200 μm范围内的细胞代谢,而位于支架中心部位的细胞则由于缺乏氧气和营养供给出现坏死,不能形成新骨[2-3]。近年来血管化在组织工程研究中的地位逐渐上升,血管化的组织工程骨能够为缺损区带来充足的氧气、营养物质、干细胞和相关信号分子[3]。因此,利用血管化的方法使移植部位形成新生血管并长入人工骨支架内部,使支架表层及内部均能获得充足的血液供给,从而提高组织工程骨的成活率,将有助于大范围骨缺损的修复。
血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)是生理性血管生成过程中重要的调控因子[3],在血管生成早期即可发挥作用并持续到血管生成的各个时期[4],能够提高组织的血流量[5]。VEGF能与内皮细胞的表面受体特异性结合,从而促进血管内皮细胞增殖并聚集形成血管管腔结构[3-4]。在血管形成过程中血小板源性生长因子(platelet derived growth factor, PDGF)与血管平滑肌细胞和周细胞表面的受体结合能够促进血管平滑肌细胞和周细胞聚集并包裹血管内皮细胞,维持血管结构的完整和稳定[3],敲除PDGF及其受体的基因会导致血管平滑肌细胞和周细胞的缺失[5-7]。因此联合应用VEGF与PDGF将有望促进新血管的形成,同时有利于形成完整而稳定的血管。
骨髓间充质干细胞(bone marrow steam cell,BMSCs)是组织工程研究中常用的种子细胞,具有多向分化潜能,能够向骨、软骨、神经、脂肪及血管等方向分化[8]。由日本学者Elloumi-Hannachi等[9]发明的细胞膜片技术无需胰酶消化,完整地保留了细胞间连接及细胞自身分泌的细胞间基质。细胞间连接的保留有利于细胞间的信号传导和细胞的增殖和分化。细胞间基质能储存生长因子并缓慢释放到周围环境当中,对生长因子起到了一定程度的缓释作用。因此本实验以细胞膜片作为VEGF与PDGF的载体来研究其对血管化的作用。
本课题组前期体外实验已证实VEGF-165和PDGF-BB两种细胞因子促进骨髓干细胞增殖及成血管分化的最佳浓度均为80 ng/mL。本实验以此为前提联合应用VEGF-165及PDGF-BB两种生长因子作用于大鼠骨髓干细胞膜片并植入大鼠体内,通过比较单独与联合应用VEGF-165与PDGF-BB对成血管相关基因表达及新生血管数量、管腔面积和管腔形态的影响来验证联合VEGF-165与PDGF-BB对血管生成是否具有协同作用,为其在骨组织工程血管化的应用提供参考。
1 材料和方法
1.1 主要试剂和仪器
250~300 g SD雄性大鼠及40~50 g SD大鼠,雌雄不限,均购自新疆医科大学实验室与动物管理处动物实验中心。α-MEM培养基(Hyclone,美国),L谷氨酰胺(Hyclone,美国),胎牛血清(四季青,中国),RT-PCR仪(BIO-RAD,美国),PCR Kit(QIAGEN,德国),显微镜、切片机、脱水机、包埋机(徕卡,德国)。
1.2 方法
1.2.1 实验动物及分组 40~50 g SD大鼠作为骨髓干细胞供体,250~300 g SD大鼠用于构建动物模型。实验分为对照组(仅加入细胞膜片不加入生长因子)、单纯VEGF组(V组)、单纯PDGF组(P组)和VEGF+PDGF组(V+P组)。分别于2周和4周两个时间点回收标本。
1.2.2 大鼠骨髓干细胞的分离培养 将4周龄SD大鼠脱颈处死,浸泡于75%乙醇中消毒5 min。用眼科剪分离四肢及皮肤。用手术刀片分离肌肉,仅保留四肢长骨。将取下的长骨浸泡于装有PBS溶液的15 mL离心管中,并暂时于冰盒中存放。将取下的四肢长骨在无菌操作台下用眼科剪剪断长骨的干骺端,然后用注射器反复冲洗骨髓直至骨组织表面发白。将所得细胞悬液在1 000 r/min条件下离心5 min,弃上清,用含10%胎牛血清的α-MEM培养基重悬沉淀。将细胞悬液接种到25 cm2的培养皿中。每3天换一次液,细胞长至80%~90%时传代。
1.2.3 细胞膜片的构建 将第三代骨髓间充质干细胞以3×105/孔接种到六孔板中,加入含10%胎牛血清的α-MEM培养基。待细胞长满100%时更换含10%胎牛血清、1%青链霉素和50 μg/mL抗坏血酸的α-MEM培养基,每2天换一次液连续培养6 d,第7天时更换不含抗生素的培养基直至成膜。
1.2.4 构建动物实验模型 根据本课题组前期实验结果证实的80 ng/mL VEGF-165 和80 ng/mL PDGF-BB为促骨髓干细胞成血管分化的最佳浓度。将生长因子以该最适浓度加入细胞膜片培养24 h以备回植。用10%水合氯醛按0.3 mL/100 g腹腔注射对大鼠进行麻醉。麻醉后于腹部正中做一2 cm切口,钝性分离皮下组织形成一盲袋以供细胞膜片植入。实验组分别植入含有80 ng/mL VEGF-165、80 ng/mL PDGF-BB和同时含80 ng/mL VEGF-165和80 ng/mL PDGF-BB的细胞膜片。对照组仅回植膜片。膜片植入后用3-0缝线缝合皮肤,见图1。

A:膜片植入前于六孔板中;B:膜片植入后缝合创口;C:体内标本;D:标本取出后
图1膜片植入前及标本取出后图片
Fig.1Cell sheet and tissue sample
1.2.5 苏木素-伊红染色 分别于造膜后2周和4周取出标本,见图1,分别经4%多聚甲醛固定48 h后梯度乙醇脱水,常规石蜡包埋,5 μm厚度切片。将切片置于60 ℃过夜后行苏木素-伊红染色。最后中性树胶封片,显微镜下放大100倍拍照。
1.2.6 RNA提取、逆转录及RT-PCR 将回收的组织块于液氮中速冻后用研磨仪研磨成碎絮状。研磨后的组织用Trizol法提取总RNA,使用takara逆转录试剂盒将总RNA反转录为cDNA。用RT-PCR法检测成血管相关因子低氧诱导因子-1-α(hypoxia inducible factor-1,HIF-1-α)、血管生成素-1(angiopoietin-1,Ang-1)、肝细胞生长因子(hepatocyte growth factor,HGF)、类胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)的基因表达,此过程重复3次。利用NCBI查找目的基因,通过Primer 5.0软件进行引物设计。引物序列见表1。
1.2.7 新生血管测量 从每组中随机选取5~8张切片,将切片在光镜下放大100倍拍照,根据完整的内皮细胞来确定血管的范围,利用Image Pro软件对每张切片中的所有血管的管腔面积进行测量,同时统计出每张照片的血管数量。
1.3 统计学分析

表1目的基因的引物序列
Tab.1Primer of target genes

基因引物序列HIF-1-α5′-CCGCCACCACCACTGATGAATC-3′(F)5′-CCGACTGTGAGTACCACTGTATGC-3′(R)Ang-15′-TTCTTCGCTGCCATTCTGACTCAC-3′(F)5′-GTTGTACTGCTCTGTCGCACTCTC-3′(R)HGF5′-CAGTCAGCACCATCAAGGCAAGG-3′(F)5′-CCACGACCAGGAACAATGACACC-3′(R)IGF-15′-CTGGTGGACGCTCTTCAGTTCG-3′(F)5′-ACAGTACATCTCCAGCCTCCTCAG-3′(R)
2 结 果
2.1 成血管相关因子表达量
术后2周、4周各组Ang-1、HIF-1-α、HGF和IGF-1基因的表达见表2。术后2周及4周V+P组的基因表达量最高,其次为P组,对照组表达量最低,4组间两两比较差异有统计学意义(P<0.05)。各组的基因相对表达量见表 2。
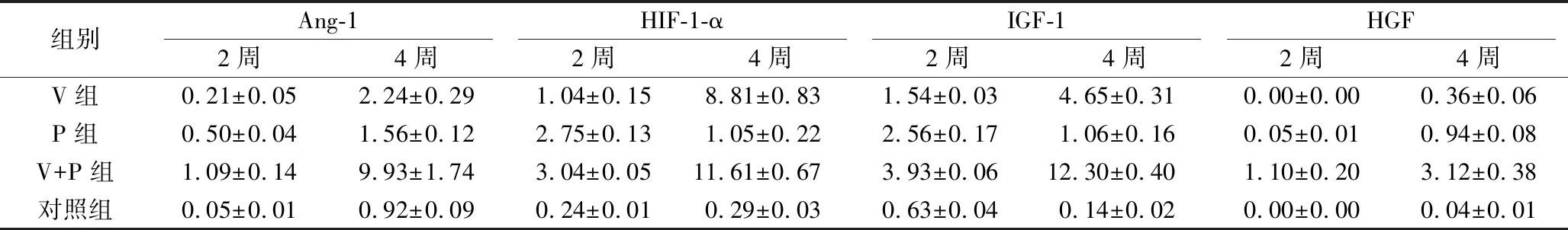
表2 术后2周、4周成血管因子表达量
2.2 血管数量、面积计算结果
术后2周和4周(表3)可见V组血管的管腔面积明显高于对照组(P<0.05)。P组和V+P组的管腔面积与对照组相比差异不大。术后2周和4周均可见V+P组血管数量高于另外三组,约为另外三组的2~3倍(P<0.05)。2周和4周相比,4周各组血管数量均高于2周(P<0.05)。
2.3 HE染色结果
镜下(图2)可见V组血管管腔形态不规则,管腔面积与对照组相比扩张明显。V+P组血管管腔形态及面积与对照组相似。P组管腔面积与对照组相似,但管腔形态不同于对照组的卵圆形结构。
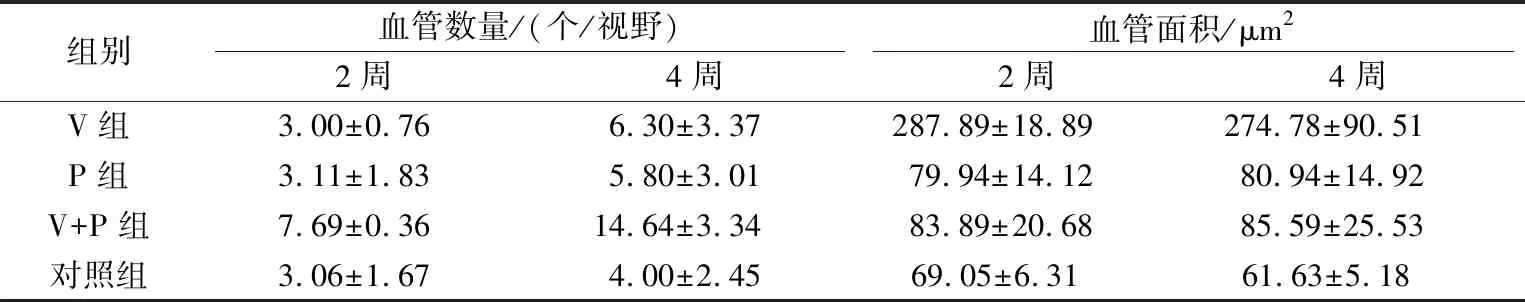
表3 术后2周、4周各组血管面积及数量

A:术后2周V组;B:术后2周P组;C:术后2周V+P组;D:术后2周对照组;E:术后4周V组;F:术后4周P组;G:术后4周V+P组;H:术后4周对照组
图2术后2周和4周HE染色结果
Fig.2HE staining2and4weeks after graft
2.4 细胞膜片大体形态
BNSCs接种于六孔板后连续培养14~20 d可见培养皿底部有白色半透明膜样物质即为所形成的膜片。部分培养皿中可见膜片边缘卷起,与培养皿透明底部形成对比。膜片可以用镊子提起,有一定张力,完全提起后膜片聚缩成一团(图3)。

A:用镊子提起膜片;B:用镊子提起后膜片缩聚成一团;C:去掉培养基后可见膜片呈乳白色半透明状;D:膜片附着在培养皿底部部分边缘卷起
图3骨髓干细胞膜片
Fig.3Bone marrow steam cell sheet
3 讨 论
血管化作为组织工程骨移植的基础,近年来与其相关的研究取得了突出进展,其中生长因子在血管化的过程中扮演着十分重要的角色。本实验以BMSCs为种子细胞研究血管化中最重要的生长因子VEGF-165和PDGF-BB是否对血管化具有协同作用,并比较联合两种生长因子与单独使用一种生长因子对成血管的影响。
VEGF是病理性及生理性血管形成中的重要生长因子[10]。其受体包括VEGFR-1(flt1)、VEGFR-2(flk1)、VEGFR-3(flt4),其中血管内皮细胞(ECs)表面存在VEGFR-2。VEGF-165是VEGF家族促血管生成能力最强的生长因子,与VEGFR-2结合后能促进血管内皮细胞的有丝分裂,同时促进血管内皮细胞向受损的血管部位迁移并聚集形成血管管腔结构[11-12]。但是血管的生成不仅依赖于血管内皮细胞的增殖和聚集,同时也需要周细胞及平滑肌细胞从外侧包裹血管内皮细胞从而形成完整而稳定的血管结构[13]。PDGF是来源于血小板的一种双链二聚体可溶性糖蛋白,其结构包含5种同分异构体分别是PDGF-AA、PDGF-BB、PDGF-CC、PDGF-DD和PDGF-AB,与其相对应的受体有PDGFR-αα、PDGFR-ββ和PDGFR-αβ[14-15]。其中PDGF-BB可以与这3种受体结合,是PDGF家族中活性最强的细胞因子[16]。当PDGF与其受体结合时会激活包括Ras-ERK、c-Src和Rap1-Rac在内的信号通路[17]。通过激活上述信号通路,PDGF能够使血管平滑肌细胞与周细胞增殖并聚集到ECs周围[18-19]。PDGF或PDGFR的基因敲除将导致新生成的ECs管腔由于缺乏周细胞及平滑肌细胞的覆盖而不能形成完整的血管管腔结构[20-21]。本实验中V组的血管管腔结构较对照组扩大明显,且镜下可见其外形不规则,而V+P组的管腔结构与对照组相似为卵圆形,且血管管腔面积也与对照组相似,推测由于PDGF的加入促进了周细胞及平滑肌细胞对血管内皮细胞的包裹,使新形成的血管具备完整的管腔结构,而V组由于缺乏PDGF-BB同时VEGF-165不具备募集周细胞及平滑肌细胞的能力导致新生血管缺乏周细胞及平滑肌细胞层,不能形成正常的血管。说明VEGF-165与PDGF-BB联合作用的成血管效果优于单独使用VEGF-165一种生长因子。单位面积内的血管数量能够反映出组织的血供,血管数量越多说明血供越好。本实验对血管数量的统计结果表明术后2周、4周V+P组血管数量是其他三组的2~3倍,而V组和P组未表现出明显的血管增多,说明联合使用VEGF-165与PDGF-BB能更加促进新血管的形成,有利于提高组织的血液灌注。实验中随着时间的推移,4周各组血管数量要高于2周,推测术后4周时血管的增长并没有达到平台期,因此还需要长期的效果观察。
血管形成过程中除了有VEGF和PDGF发挥作用外还有包括Ang-1、Hif-1-α、HGF和IGF-1等多种生长因子参与,这些生长因子在血管形成过程中表达上调[20-22]。为从基因层面验证联合应用VEGF-165与PDGF-BB对血管化的促进作用优于单独使用VEGF-165或PDGF-BB一种生长因子的效果,本实验通过PT-PCR法检测Ang-1、Hif-1-α、HGF和IGF-1的基因表达。结果表明,术后2周及4周V+P组较V组及P组能更显著地上调Ang-1、Hif-1-α、HGF和IGF-1的基因表达(P<0.05)。说明了联合应用VEGF-165与PDGF-BB对新血管生成的效果优于单一使用一种生长因子,起到了协同促进作用。
综上所述,本实验证明了VEGF-165与PDGF-BB在促进新血管生成方面起到了协同作用。与单独使用一种生长因子相比,联合VEGF-165与PDGF-BB能显著增加新生血管的数量,并有利于维持完整的血管结构,对其进行良好的应用将对组织工程骨的血管化及组织工程骨移植修复大范围骨缺损起到积极作用。本实验的不足之处在于,生长因子的半衰期较短,不能长期在体内维持其有效浓度,因而缺乏长期的效果观察,进一步研究希望能延长生长因子的作用时间。同时VEGF-165与PDGF-BB协同作用的机制仍有待进一步探索。
