灵芝菌丝体富硒条件优化及其硒多糖抗氧化活性研究
2020-03-17黄文丽陈祖琴
金 鑫,熊 川,黄文丽,陈祖琴,李 萍,张 利,朱 宇*
1四川省农业科学院生物技术核技术研究所,成都 610061;2阿坝州林业科学技术研究所,汶川 623000
灵芝是我国一种重要的传统食药用真菌,具有广泛的药理活性,已被大量研究证明其具有调节免疫、降血糖、降血脂、抗氧化、抗衰老等功效[1-6],而发挥这些功效的主要成分为灵芝多糖。硒是人体必需的微量营养元素,能够增强机体的抗氧化能力,抵抗有关疾病的发生,然而硒不能由机体自主合成,只能从体外摄取,人体摄入的有机硒主要是硒蛋白和硒多糖[7]。大量的研究表明灵芝具有较强的富硒能力[8,9],灵芝菌丝体通过富硒发酵培养,将灵芝多糖与人体必需微量元素硒进行一定程度的螯合,进而结合成为灵芝多糖有机硒化合物,从而更容易被人体吸收[10,11],以达到二者共同促进的作用,对人体健康具有重要保健作用。富硒发酵培养是将无机硒转化为有机硒的有效方法之一,从营养学和微生物代谢角度考虑,通过微生物转化作用得到的灵芝富硒多糖,具有生物利用率高、生理药理功效更优、安全、无毒副作用等特点,因此,富硒灵芝的研究具有重要的现实意义。
本研究以美国大灵芝(Ganodermaoregonense)作为载体,无机硒亚硒酸钠作为硒源,通过优化培养基碳源、氮源和亚硒酸钠浓度进行微生物富硒发酵,并在富硒发酵过程中初步探析发酵液胞外酶活性变化,最后提取菌丝体硒多糖,研究其抗氧化活性。本研究获得的硒多糖将灵芝与硒功效融合于一体,发挥了硒和灵芝固有的以及协同的生理作用,具有极大的食用价值,为富硒灵芝产品的开发提供了理论依据。
2 材料方法
1.1 材料
美国大灵芝(G.oregonense)菌株由四川省农业科学院生物技术核技术研究所现代农业研究室保存。马铃薯、玉米粉、麸皮,市购;亚硒酸钠、葡萄糖、琼脂粉、H2SO4、乙二胺四乙酸(EDTA)、乙醇、Tris-HCl、DPPH、过氧化氢、硫酸亚铁铵、Vc、邻苯三酚、磷酸盐缓冲液、NaOH、水杨酸、HCl、MgSO4·7H2O、KH2PO4等均为分析纯试剂。
1.2 试验方法
1.2.1 灵芝菌株的提纯和复壮[12]
灵芝提纯培养基:斜面培养,土豆200 g、葡萄糖20 g、琼脂粉15 g、磷酸二氢钾3 g、硫酸镁1.5 g、玉米粉10 g、麸皮50 g、青冈树皮100 g。水1 000 mL,pH自然。灵芝复壮培养基:土豆200 g、葡萄糖20 g、琼脂粉15 g、磷酸二氢钾3 g、硫酸镁1.5 g、玉米粉10 g、麸皮50 g、青冈树皮100 g、干灵芝子实体50 g。水1 000 mL,pH自然,分别制作斜面试管和平板。
将实验室保存的灵芝菌种用接种钩接入提纯培养基中,28 ℃条件下培养,当斜面菌丝生长到一半后,挑选生长快而健壮的试管,取菌丝的尖端部位菌丝体移接到复壮培养基中,同样28 ℃恒温培养,当复壮培养基中斜面菌丝生长到一半后,挑选生长快而健壮的试管,取菌丝的尖端部位菌丝体移接到复壮培养基的平板中间,28 ℃恒温培养,菌丝长满待用。
1.2.2 发酵条件优化培养正交试验
发酵培养基条件为:温度28 ℃,摇床转速180 rpm[13,14]。分别以葡萄糖、马铃薯、可溶性淀粉为A变量;蛋白胨、玉米粉、麸皮为B变量;5、10、15 mg/L的Na2SeO3为C变量。选定适当水平,设计L9(33)进行正交试验(见表1),进行正交实验,以生物量、硒含量、富硒率为指标,对富硒灵芝液体发酵培养原料进行优化。每组试验设置3个重复,250 mL容量锥形瓶每瓶装培养基150 mL,121 ℃高压灭菌30 min,冷却后,每瓶接种3块直径5 mm的灵芝菌种,然后置于28 ℃恒温振荡箱中,以180 rpm 转速振荡培养15天。

表1 因素水平表
1.2.3 生物量测定
参考Jiang[15],并做适当修改,在培养的第15天,将灵芝菌丝发酵液经5 000 rpm离心10 min,去除上清液,菌丝体用去离子水震荡洗涤后再离心去上清液,重复操作,直至上清液不再带有发酵液颜色为止,收集菌体,置于烘箱内45 ℃烘干至恒重。以菌丝得率代表生物量,计算公式如下:生物量(g/L)=[(菌丝干重/g)/(发酵液体积/mL)]×1 000。
1.2.4 菌丝体硒含量测定
菌丝体硒含量测定参照GB 5009.93-2017中电感耦合等离子体质谱法。富硒率(%)=(菌丝体硒含量×菌丝体干重)/培养基中所添加硒量。
1.2.5 菌丝体胞外酶活性测定
在液体培养开始的第3天开始每隔2天吸取发酵液5 mL,在4 ℃下5 000 rpm离心10 min,得上清液即为粗酶液,连续测定5次。过氧化物酶(POD)和多酚氧化酶(PPO)严格按照试剂盒说明书的方法测定酶活性。试剂盒购自南京建成生物工程研究所。
1.2.6 菌丝体粗多糖含量测定
热水浸提法提取菌丝体粗多糖:称取冷冻干燥粉碎后的灵芝菌丝体样品5 g,加入90 mL的去离子水,置于250 mL锥形瓶中,在90 ℃的水浴锅中恒温水浴180 min,5 000 rpm离心10 min后,留下上清液,残渣重复浸提1次,离心后,合并上清液,用旋转蒸发仪浓缩至20 mL下,加3倍体积的无水乙醇进行醇沉,4 ℃静置过夜,沉淀物用无水乙醇洗2次后,置于45 ℃烘箱中烘至恒重,即得粗多糖。粗多糖得率=(粗多糖质量/菌丝体质量)×100%。将粗多糖用无菌蒸馏水配制成1 mg/mL的样品溶液,采用苯酚-硫酸法测定多糖含量[16]。
1.2.7 粗多糖体外抗氧化活性测定
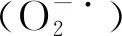
1.3 数据分析
用Microsoft Excel 2007 软件计算平均值和标准偏差。采用SPSS 19.0软件进行单因素方差和相关性分析。
2 结果
2.1 灵芝菌丝体富硒培养条件优化的正交实验
生物量是反映灵芝菌丝生长状况的重要指标,硒含量是反映灵芝菌丝对硒的吸收能力,富硒率是反映灵芝菌丝吸收的硒总量与培养基中添加的亚硒酸钠中的硒总量之比,表2是正交试验的结果,并以富硒率计算极值,从表2中可以看出,在碳源因素水平上分析,其(K2与(K1和(K3之间存在显著差异(P<0.05),(K2最优;从氮源因素水平上看,其(K3与(K1和(K2之间存在显著差异(P<0.05),(K3最优;从Na2SeO3浓度水平因素上看,其(K1与(K2和(K3之间存在明显显著差异(P<0.05),(K1最优。因此,试验优化得到的灵芝菌丝体富硒培养条件方案为:A2B3C1,即培养基中优选20%马铃薯,2%麸皮,浓度为5 mg/L Na2SeO3,该试验组生物量最大为3.86 g/L,硒含量也最高为0.576 mg/g,富硒率同样最高为44.47%。
从图1中可以看出,灵芝菌丝体的生长性状存在一定的差异,第1组、第8组、第6组,其Na2SeO3浓度为5 mg/L时发酵液菌丝球颜色为白色,菌丝球数量较少,但直径较大;第2组、第4组、第9组,其Na2SeO3浓度为10 mg/L时,其菌丝球边缘颜色为白色,里面则带着浅红色,细小菌丝球较多;第3组、第5组、第7组,其Na2SeO3浓度为15 mg/L时,其细小菌丝球边缘颜色为白色,但直径较大点的菌丝球变为深红色,可见,随着Na2SeO3浓度的增加,菌丝球颜色逐渐加深,Na2SeO3对菌丝的影响程度远远大于碳源和氮源的影响。
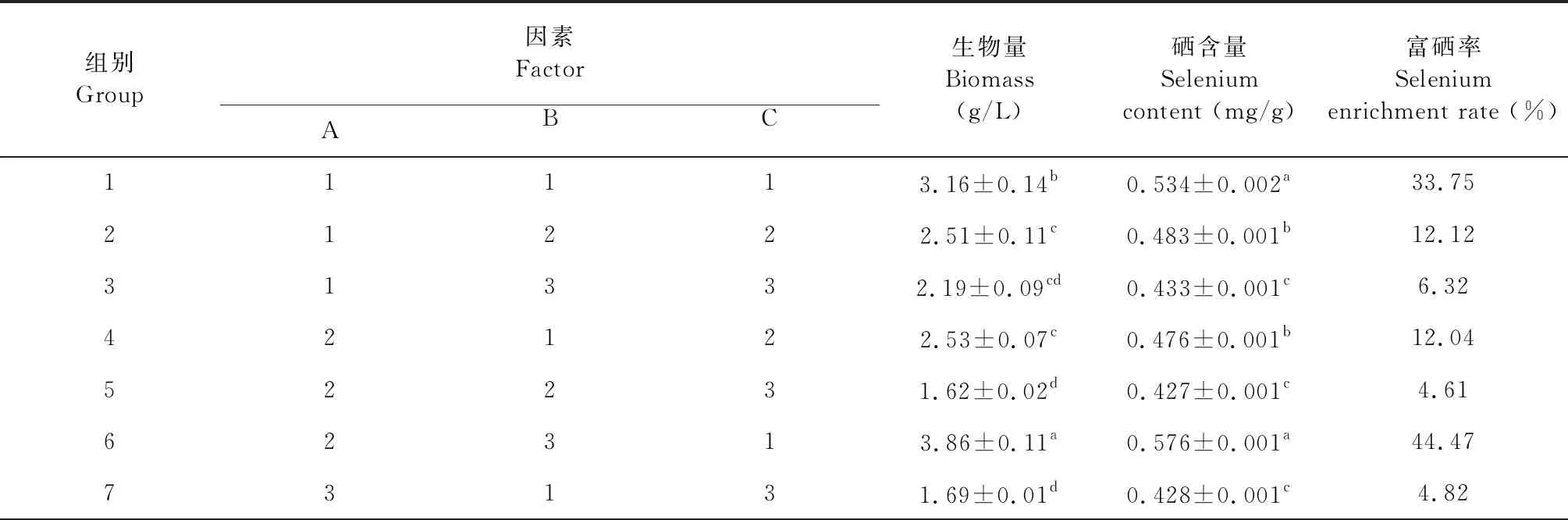
表2 正交试验结果
续表2(Continued Tab.2)
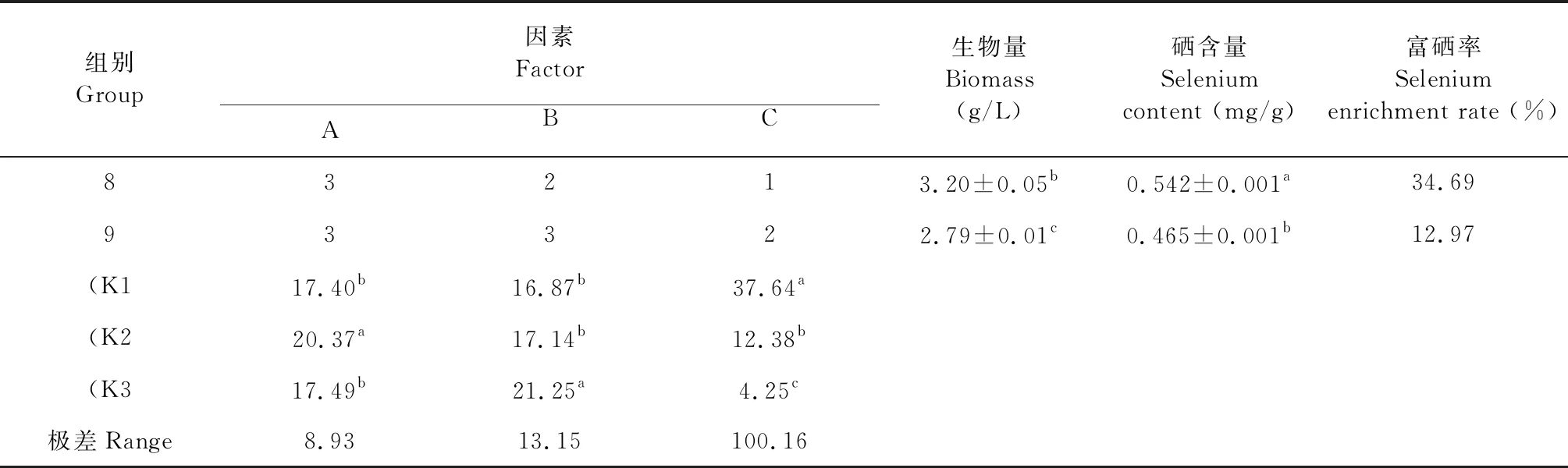
组别Group因素FactorABC生物量Biomass (g/L)硒含量Selenium content (mg/g)富硒率Selenium enrichment rate (%)83213.20±0.05b0.542±0.001a34.6993322.79±0.01c0.465±0.001b12.97(K117.40b16.87b37.64a(K220.37a17.14b12.38b(K317.49b21.25a4.25c极差Range8.9313.15100.16
注:不同小写字母表示不同组间具有显著差异(P<0.05),下同。
Note:Different lowercase letters showed significant differences among different groups (P<0.05),the same below.

图1 灵芝菌丝体生长试验Fig.1 G.oregonense mycelium growth test
2.2 胞外过氧化物酶活性分析
过氧化物酶是灵芝体内重要的呼吸酶类,其活性高低与酚类物质代谢和植物抗性密切相关,测定灵芝发酵液内过氧化物酶活性一定程度上能反映其在特定环境下的适应能力。通过对9组试验进行过氧化物酶活性测定(见图2),发现过氧化物酶活性处在1.26~12.74 U/mL之间,其中第6组、第8组、第1组其酶活性显著高于其他组,在培养9天之前,其酶活性都是处于显著升高态势,第9天到第12天处于缓慢上升中,在第12天到第15天酶活性则处于下降趋势,这三组都为添加5 mg/L浓度的Na2SeO3组。第7组、第2组和第4组,其酶活性在培养第3天到第9天处于缓慢上升中,在第9天到12天其上升趋势则变大,在第12天到第15天,其酶活性又缓慢下降,该三组中,第7组为添加15 mg/L浓度的Na2SeO3组,第2组和第4组为添加10 mg/L浓度的Na2SeO3组;第9组、第3组和第5组在培养第3天到第15天之间其酶活性整体变化趋势不大,呈现小幅度的先上升后降低,酶活性较明显低于其他组,该三组中,第9组为添加10 mg/L浓度的Na2SeO3组,第3组和第5组为添加15 mg/L浓度的Na2SeO3组。通过过氧化物酶活性的测定,发现Na2SeO3浓度对酶活性的影响明显大于碳源和氮源,该酶活性变化趋势同菌丝生长量、富硒率相同。
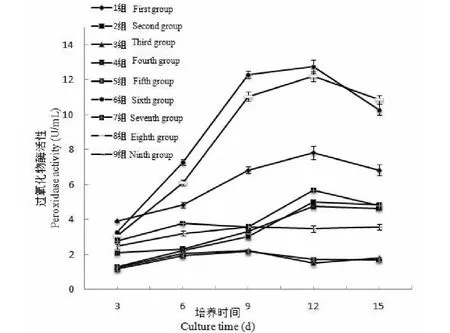
图2 灵芝菌丝体发酵液POD酶活性变化Fig.2 Changes in POD enzyme activity in G.oregonense mycelium fermentation broth
2.3 胞外多酚氧化酶活性分析
PPO是含有铜离子的膜蛋白酶,能导致褐色素的生成,是导致多种食用菌、果蔬损伤后褐变的主要酶类,通过对9组试验进行多酚氧化酶活性测定(见图3),发现多酚氧化酶活性处在1.57~13.06 U/mL之间。第1组、第6组、第8组都为添加5 mg/L浓度的Na2SeO3,其酶活性显著高于其他组,在培养12天之前,其酶活性都是处于显著升高态势,其中第6组呈直线上升,在第12天达到最大值13.06 U/mL,三组试验在第12天到第15天则处于下降趋势,总体变化趋势同过氧化物酶活性变化趋势相同;第2组、第4组、第5组和第3组,其酶活性在培养第3天到第12天都处于缓慢上升中,在第12天到第15天,其酶活性又缓慢下降,该四组中,第4组和第2组为添加10 mg/L浓度的Na2SeO3,第5组和第3组为添加15 mg/L浓度的Na2SeO3,可见Na2SeO3浓度从5 mg/L提高到10 mg/L时,其酶活性变化较大,明显受到抑制,在Na2SeO3浓度从10 mg/L提高到15 mg/L时,其酶活性变化较小;第9组和第7组试验在培养第3天到第9天之间其酶活性整体变化趋势较小,呈现小幅度的上升,从培养第9天到第15天,其酶活性变化则逐渐降低,第9组为添加10 mg/L浓度的Na2SeO3,第7组为添加15 mg/L浓度的Na2SeO3。通过多酚氧化酶活性的测定,同样发现Na2SeO3浓度对酶活性的影响明显大于碳源和氮源,可见,在富硒条件优化正交试验中,Na2SeO3浓度起到了主要的控制作用。
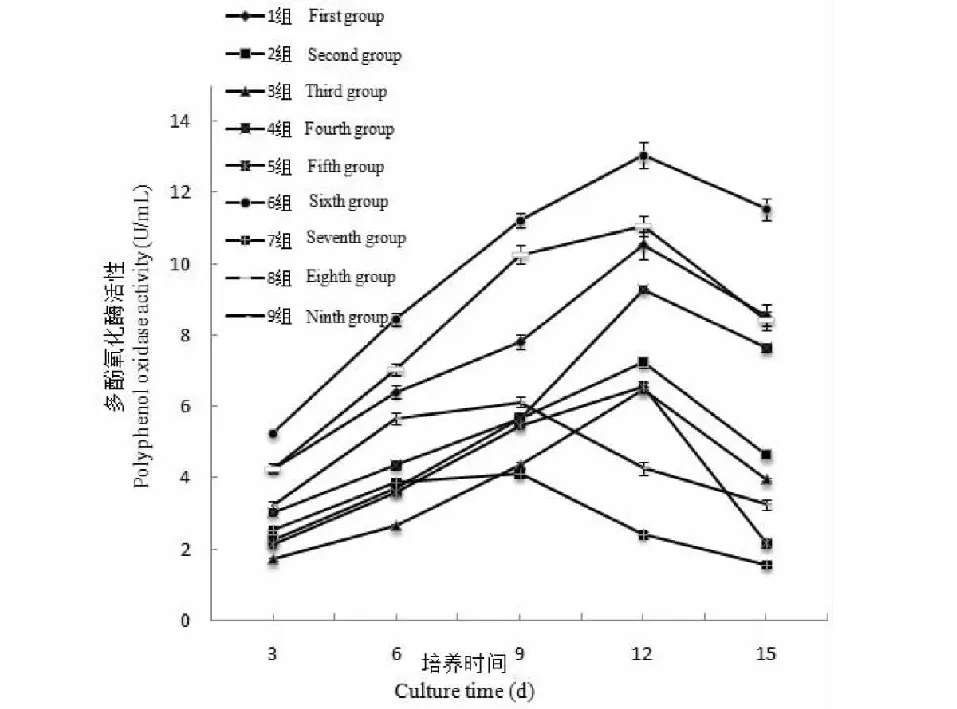
图3 灵芝菌丝体发酵液PPO酶活性变化Fig.3 Changes in PPO enzyme activity in G.oregonense mycelium fermentation broth
2.4 多糖含量分析
对9组试验灵芝菌丝进行粗多糖提取,结果见图4,从图中可以看出9组试验粗多糖含量位于2.29%~2.85%之间,含量最高的为第6组,最低的为9组。第1组、第2组、第6组和第8组之间多糖含量差异不显著(P>0.05),第3组、4组、5组和第7组之间多糖含量差异同样不显著(P>0.05),第1~8组多糖含量同第9组存在显著差异(P<0.05)。可见,在富硒灵芝发酵的条件优化正交试验中,碳源、氮源和Na2SeO3浓度对灵芝菌丝体内的粗多糖含量影响不大,仅从粗多糖含量上难以区分9组试验的优劣,必须对粗多糖进行进一步研究。
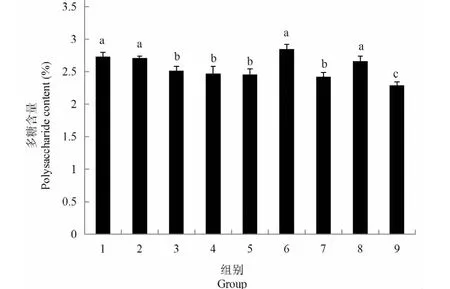
图4 灵芝菌丝体粗多糖含量比较Fig.4 Comparison of crude polysaccharide content in G.oregonense mycelium
2.5 不同组别灵芝菌丝粗多糖对DPPH的清除率
9组试验其粗多糖的DPPH清除率范围在69.57%~87.25%之间,见图5,而Vc的DPPH清除率达到96.93%,Vc阳性对照与9组试验其清除率存在显著差异(P<0.05)。在9组试验的DPPH清除率中,第1组、4组、6组、8组其清除率要高于其他组,且存在显著差异(P<0.05),这4组试验中,第1组、6组、8组分别为不同的碳源和氮源,难以筛选出最优的碳源和氮源,但却存在相同的Na2SeO3浓度,为5 mg/L,第4组Na2SeO3浓度为10 mg/L;第2组、第3组、第5组和第9组粗多糖对DPPH的清除率之间不存在显著差异(P>0.05),这四组中,第2组和第9组Na2SeO3浓度为10 mg/L,第3组和第5组Na2SeO3浓度15 mg/L,第7组的清除率最低,与其他组都存在显著差异(P<0.05),第7组Na2SeO3浓度为15 mg/L。总体上可以看出,Na2SeO3浓度为5 mg/L时,其试验组粗多糖的DPPH清除率明显高于其他组,该结果同发酵液胞外酶活性趋势相同。
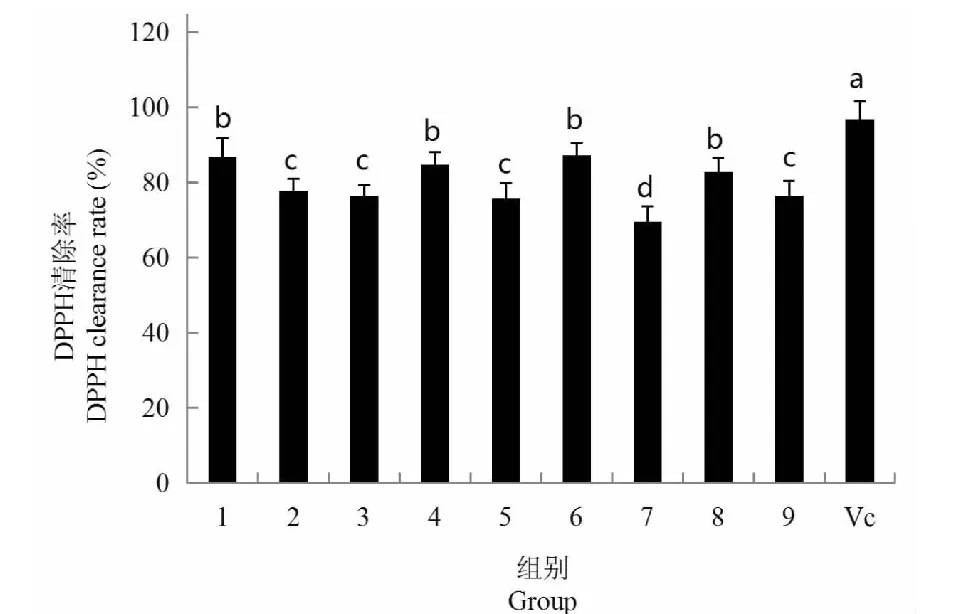
图5 不同组灵芝菌丝体粗多糖对 DPPH 的清除能力Fig.5 DPPH scavenging capacity of crude polysaccharides from different groups of G.oregonense mycelia
2.6 不同组别灵芝菌丝体粗多糖对超氧自由基清除能力比较
9组试验其粗多糖的超氧自由基清除率范围在39.74%~68.58%之间,见图6,最高的组别为第8组,最低组别为第3组,而Vc的超氧自由基清除率达到99.54%,Vc阳性对照与9组试验其清除率存在显著差异(P<0.05)。在9组试验的超氧自由基清除率中,第1组、6组、和8组其清除率要高于其他组,与其他组存在显著差异(P<0.05),这三组试验中,分别为不同的碳源和氮源,其Na2SeO3浓度则相同,均为5 mg/L;第2组、第4组、第5组、第7组和第9组其粗多糖对超氧自由基的清除率,其相互之间不存在显著差异(P>0.05),这五组中,第2组、第4组和第9组其Na2SeO3浓度为10 mg/L,第5组和第7组Na2SeO3浓度15 mg/L。从9组试验中可以看出,Na2SeO3浓度为5 mg/L时,其试验组粗多糖的超氧自由基清除率明显高于其他组,高浓度的Na2SeO3对粗多糖的抗氧化活性起到了抑制作用,该结果同DPPH清除率趋势相同。
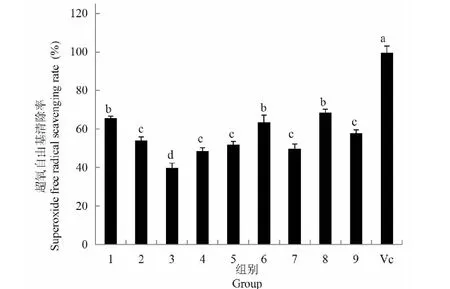
图6 不同组灵芝菌丝体粗多糖对超氧自由基的清除能力Fig.6 Scavenging capacity of crude polysaccharides from different groups of G.oregonense mycelia to superoxide free radicals
2.7 不同组别灵芝菌丝体粗多糖对羟自由基清除能力比较
9组试验其粗多糖的羟自由基清除率范围在22.92%~52.62%之间,见图7,最高的组别为第6组,最低组别为第3组,而Vc的羟自由基清除率达到95.28%,Vc阳性对照与9组试验其清除率存在显著差异(P<0.05)。在9组试验的羟自由基清除率中,第1组、6组、和8组其清除率要高于其他组,与其他组存在显著差异(P<0.05),这三组试验中,分别为不同的碳源和氮源,其Na2SeO3浓度则相同,均为为5 mg/L;第2组、第4组、和第9组其粗多糖对羟自由基的清除率,其相互之间不存在显著差异(P>0.05),这三组中,第2组、第4组和第9组其Na2SeO3浓度为10 mg/L;第5组和第7组羟自由基清除率不存在显著差异(P>0.05),但与第3组存在显著差异(P<0.05),这三组试验其Na2SeO3浓度15 mg/L。从9组试验中同样可以看出,Na2SeO3浓度为5 mg/L时,其试验组粗多糖的羟自由基清除率明显高于其他组,高浓度的Na2SeO3对粗多糖的抗氧化活性起到了抑制作用,该结果同DPPH清除率和超氧自由基清除率趋势相同。综合9组试验其菌丝体粗多糖对DPPH 清除率、超氧自由基清除率和羟自由基清除率结果可得出,Na2SeO3浓度对抗氧化活性的影响远远大于不同的碳源和氮源对其的影响,第6组试验其抗氧化能力表现最好,该结果同菌丝体生物量、富硒率以及胞外酶活性结果相同。
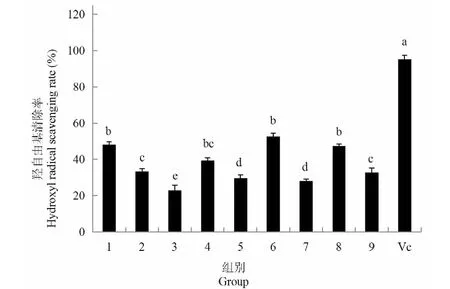
图7 不同组灵芝菌丝体粗多糖对羟自由基的清除能力Fig.7 Scavenging ability of crude polysaccharides from different groups of G.oregonense mycelia to hydroxyl radicals
2.8 线性相关性分析
从表3中可以看出,生物量、硒含量、富硒率、粗多糖、胞外酶活性、以及抗氧化活性之间的相关性均为正向相关。其硒含量与生物量存在显著相关性;富硒率与生物量和硒含量存在极显著相关性,相关系数在0.8以上;粗多糖含量与生物量和硒含量以及富硒率存在极显著相关性,同样相关系数均在0.8以上;胞外酶POD和PPO与硒含量和富硒率存在极显著相关性,相关系均达到0.9以上,与粗多糖在存在显著相关性,POD和PPO相互之间也存在极显著相关性;菌丝粗多糖的抗氧化活性与硒含量、富硒率均存在显著相关性,而与生物量的相关系数较低,可见,硒含量和富硒率越高其粗多糖的抗氧化活性就高,而菌丝生物量多其抗氧化活性则不一定高。
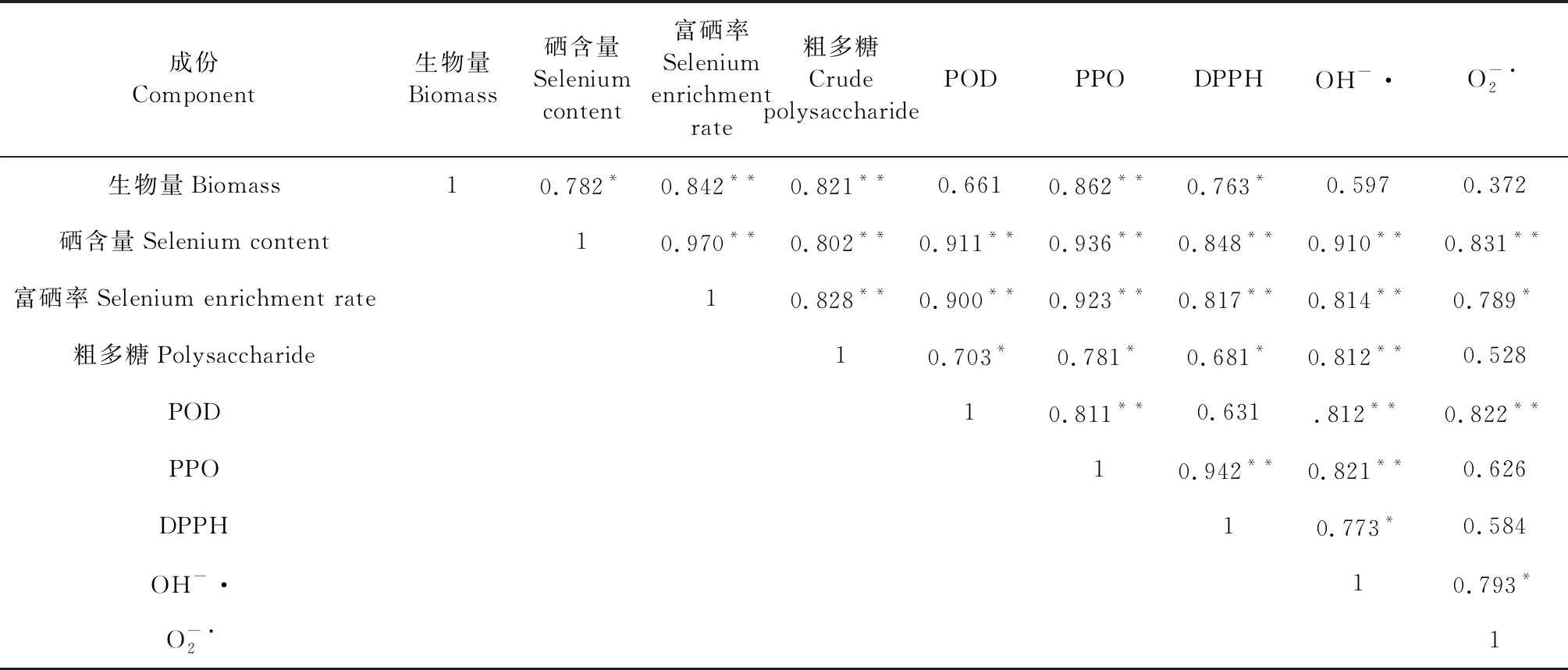
表3 灵芝菌丝胞外酶活性、抗氧化活性与菌丝生长之间的线性相关分析
注:**P<0.01;*P<0.05。
3 讨论
3.1 富硒灵芝发酵条件优化正交试验分析
适合灵芝菌丝体生长的碳源有葡萄糖、乳糖、马铃薯、淀粉等,适合的氮源有硫酸铵、蛋白胨、豆粕粉、玉米粉、麸皮、酵母粉等,富硒源有活化硒矿、亚硒酸钠等。对于富硒灵芝发酵条件筛选,前人做了大量的研究,集中于发酵过程中不同培养条件如温度、pH等和培养基中不同的氮源、碳源以及外源硒等对菌丝体生物量和多糖产量的影响。Guo等[7]对富硒灵芝的碳源、氮源和亚硒酸钠浓度做了筛选,结果表明以4%葡萄糖和20%马铃薯为碳源,以1%蛋白胨为氮源,浓度为0.01%的亚硒酸钠为最优条件;Chen[18]通过响应面分析得出灵芝深层培养的最佳培养基组成为葡萄糖2.13%、麸皮汁3.96%,菌丝体中总硒含量在150 μg/g以上,富硒率最高达到55%。Chen[19]通过正交实验确定两种菌种液态发酵的最佳培养基组成为酒糟80 g/L、麸皮7.5 g/L、豆粕粉10 g/L、葡萄糖5 g/L,该条件下红芝菌生长较快,长势较好;Xu等[20]以灵芝胞内多糖得率为指标,优化了发酵碳源、氮源,结果表明添加20%马铃薯、3.3%葡萄糖、3%麦麸、0.2% KH2PO4、0.1% MgSO4,其胞内多糖的得率最高。本文在富硒灵芝发酵条件筛选中,优选的碳源为20%的马铃薯,氮源为2%的麸皮,该研究结果与前人研究结果较相似,灵芝对碳源的利用较为广泛,不仅能利用单糖、双糖,而且也能利用多糖,葡萄糖是灵芝生长较好的碳源,氮源以谷类有机氮源为主。
在富硒灵芝发酵培养的最适亚硒酸钠浓度研究上,本文研究富硒发酵最适添加Na2SeO3为5 mg/L,这与较多研究者不同,例如Dou[21]和Yang[22]研究认为添加1 000 μg/g的亚硒酸钠灵芝菌丝体富硒率最高;Wang[23]研究认为添加20 mg/L Na2SeO3,其富硒胞外多糖的产量可达到2.84 g/L,生物量为32.26 g/L。研究者得出最适灵芝菌丝生长的不同亚硒酸钠浓度,可能是由于所使用的灵芝菌种以及菌种活性的不同所导致的,另外本研究在Na2SeO3的无菌处理上采用的无菌滤膜过滤,而其他研究者采用的是高压灭菌,这也有可能导致研究得出不同的结论。这些研究结果虽然显示的最适亚硒酸钠浓度不同,但都表明在适宜的亚硒酸钠浓度范围内,低浓度亚硒酸钠可促进灵芝菌丝体的生长,而随着硒浓度的升高,则会抑制灵芝菌丝体的生长,硒是细胞内过氧化氢酶等氧化酶活性中心的组成成分,可能正是由于低浓度亚硒酸钠激活了菌丝体细胞的辅酶而促进菌丝体的发育,高浓度的亚硒酸钠则抑制了菌丝体细胞内部分酶的活性[24,25]。
3.2 富硒灵芝发酵液胞外酶活性分析
灵芝属于木腐性真菌,在菌丝生长阶段和子实体发育阶段,其所需的营养全部由菌丝从外界吸收获得,而菌丝分解到体外的胞外酶对灵芝吸收营养起着至关重要的作用。灵芝可以向培养基中分泌多种胞外酶,这些胞外酶把营养物质分解成简单的小分子物质,从而易被菌丝吸收利用。不同的培养基可以诱导灵芝菌丝分泌不同的胞外酶,其胞外酶活性的大小也不相同。He[26]研究了Na2SeO3对灵芝菌丝生长及菌丝生长期间胞外酶活性的影响,发现一定浓度的Na2SeO3能促进灵芝菌丝生长和胞外酶活性,高浓度的Na2SeO3可抑制菌丝生长和胞外酶活性;Chen[27]研究发现在灵芝发酵过程中胞外酶活力具有较强的阶段性,酶活性显著升高后到平缓到逐渐下降,这些研究与本文的研究结果类似,本研究中发现胞外酶活性在添加浓度为5 mg/L的Na2SeO3时活性最高,当Na2SeO3浓度提高到10和15 mg/L时,其活性则明显降低,同时发现胞外酶活性在从第3天到第9天时逐渐升高,之后则逐渐降低。
3.3 富硒灵芝菌丝粗多糖抗氧化活性分析
灵芝能够从培养基质中吸收20%~30%的无机硒,并将其中的绝大部分转化为有机硒,而且,约有40%的有机硒存在于蛋白质中,硒元素可以显著地提高富硒灵芝中蛋白质组分和硒多糖的抗氧化活性[28]。Du[29]发现灵芝菌丝体蛋白提取物清除自由基的能力较强,且清除能力与硒含量趋势相同,Zhou[30]通过富硒灵芝比较体外灵芝硒多糖和普通多糖对自由基的清除率和还原力,发现灵芝硒多糖对自由基的清除率和还原能力明显优于普通的灵芝多糖,本研究结果同样显示灵芝菌丝粗多糖具有较好的抗氧化活性,且随着Na2SeO3浓度的提高其粗多糖的抗氧化活性逐渐降低。有研究表明硒能提高谷胱甘肽过氧化酶的活性,具有加速分解或去除过氧化脂质作用,保护细胞免遭过氧化作用的损伤,硒与多糖结合后可提高灵芝多糖清除自由基的能力。另有研究表明发酵液中适宜的硒浓度促进了菌丝体的生长,无机硒进入菌丝后,经生物转化为有机硒,一方面可促进氨基酸和蛋白质的合成,促使氨基酸结合更多的硒[31],另一方面硒可取代灵芝多糖中甲氧基上的甲基,并以硒氧双键的方式结合,增强了灵芝多糖的活性[32]。然而对于硒多糖的具体作用机理以及无机硒结合多糖的途径方式还有待进一步研究和探讨。
4 结论