达格列净对2型糖尿病大鼠肾脏葡萄糖转运蛋白2及葡萄糖转运蛋白4基因表达的影响*
2020-03-16陈雪辉白立炜尹清风冯春瑜张清贵
徐 云, 陈雪辉, 白立炜, 尹清风, 冯春瑜, 张清贵△
(1. 新乡医学院第一附属医院内分泌科一病区, 河南 卫辉 453100; 2. 卫辉市人民医院内科, 河南 卫辉 453100)
糖尿病是一种糖脂代谢紊乱的慢性疾病,以2型糖尿病为主。机体血糖持续升高会产生炎症应激反应,造成心血管并发症,威胁患者的生命健康,目前临床治疗糖尿病的药物主要是促进胰岛素分泌,增加胰岛素的敏感性[1]。达格列净是近年来开发的新型降糖药物,是钠-糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT2)的抑制剂,可抑制肾小球对葡萄糖的重吸收,通过促进葡萄糖从尿液中排出,达到降低血糖的目的[2]。葡萄糖转运蛋白2(glucosetransporter 2,GLUT2)与葡萄糖转运蛋白4(glucosetransporter 4,GLUT4)是葡萄糖转运过程中重要的蛋白,在机体葡萄糖动态平衡中扮演十分重要的角色,与2型糖尿病(type 2 diabetes mellitus,T2DM)密切相关[3]。目前尚未见达格列净对2型糖尿病GLUT2及GLUT4的影响,因此,本研究采用高脂饲料和一次性注射40 mg/kg链脲佐菌素(streptozotocin, STZ)建立2型糖尿病大鼠模型,并对糖尿病大鼠灌胃不同剂量的达格列净进行干预,通过检测肾脏组织GLUT2及GLUT4基因表达探讨达格列净对2型糖尿病大鼠肾脏损伤的保护作用,为临床治疗2型糖尿病提供新思路。
1 材料与方法
1.1 实验动物
SD大鼠均为6周龄的成年雄性大鼠,体重约200 g,由第四军医大学动物中心提供,动物生产许可证号:SCXK(军)2007-007。RIPA细胞裂解液由上海申能博彩生物科技有限公司提供;ECL化学发光底物试剂盒由Millipore公司提供;BCA蛋白浓度测定试剂盒由Thermo公司提供;SDS-PAGE凝胶、电泳液、缓冲液均由上海钰森生物技术有限公司提供;兔抗大鼠GLUT2抗体、兔抗大鼠GLUT4抗体由Abcam公司提供;Trizo总RNA 提取试剂及dNTP、rTaq酶均由Tokara公司提供;链脲佐菌素由美国Sigma公司提供;达格列净由阿斯利康制药有限公司提供。引物由上海博亚公司设计并合成。SOD、MDA、GSH-Px等试剂盒均由南京建成生物工程研究所提供。
1.2 实验分组
根据文献[4]建立动物模型,将40只健康的SD大鼠适应性喂养7 d后,随机分为正常对照组(A组,6只)和糖尿病造模组(34只)。A组大鼠进行普通饲料喂养4周,糖尿病造模组进行高脂高糖饲料喂养4周,所有大鼠均进食不禁水。喂养4周后,糖尿病造模组腹腔内一次性注射40 mg/kg链脲佐菌素(STZ),STZ的浓度为1%,A组大鼠腹腔注射等剂量的生理盐水。3 d后尾静脉采血检测空腹血糖(fasting blood glucose, FBG),造模大鼠以FBG含量≥16.7 mmol/L时视为造模成功;剔除空腹血糖<16.7 mmol/L的大鼠共7只,共造模成功27只大鼠。随机选取24只糖尿病造模成功的大鼠将其随机分为模型组(B组,生理盐水)、达格列净低剂量组(C组,0.75 mg/kg)、达格列净中剂量组(D组,1.5 mg/kg)、达格列净高剂量组(E组,3.0 mg/kg)。各组大鼠按上述剂量,每天灌胃1次,连续7周。
灌胃7周后,测定各组大鼠的体重,并将各组大鼠麻醉后,心脏取血,3 000 r/min离心15 min后取上清,检测各组大鼠血糖含量、血清中糖化血红蛋白及各生化指标;取新鲜肾脏,一半放入4%多聚甲醛中固定,用于HE检测肾脏病理变化;剩余肾脏置液氮中,并于-80℃保存,用于RT-qPCR和Western blot检测。
1.3 肾脏组织HE染色
将固定好的大鼠肾脏组织制作石蜡切片,切片脱蜡后进行苏木精染色,然后再进行伊红染色,脱水封片后显微镜下观察各组糖尿病大鼠肾组织的病理改变。
1.4 肾功能各指标的检测
使用全自动生化分析仪测定各组大鼠血清尿素氮(blood urea nitrogen, BUN)和血清肌酐(serum creatinine,Scr)水平。
1.5 氧化应激指标的检测
取各组大鼠血清及肾脏组织,按照试剂盒说明书进行操作,使用紫外可见分光光度计测定吸光值,计算超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平。
1.6 RT-qPCR检测肾脏组织中GLUT2、GLUT4 mRNA的相对表达量
使用胰蛋白酶对肾脏组织进行消化,洗涤后加入Trizol试剂提取肾脏组织的总RNA。将总RNA的浓度调节为1 μg/ml后反转录为cDNA,采用PCR扩增目的基因,以β-actin 作为参照,使用2-△△Ct对GLUT2、GLUT4的mRNA进行定量。PCR扩增条件:94℃,5 min;94℃,45 s,55℃,45 s,72℃,1 min,35个循环;72℃延伸10 min。PCR扩增引物序列见表1。

Tab. 1 PCR amplification primer sequences
1.7 Westren blot检测GLUT2、GLUT4蛋白的相对表达量
将按1.2.5方法消化的肾脏组织离心弃上清,并加入RIPA裂解液,提取肾脏组织的总蛋白。使用蛋白定量试剂盒测定总提取蛋白的浓度,SDS-PAGE凝胶电泳后转至NC膜上并使用脱脂奶粉将其封闭,然后加入一抗孵育过夜,洗膜后加入二抗,室温振荡孵育1 h,洗涤后进行ECL显色,曝光后进行灰度值分析。使用GLUT2、GLUT4蛋白的光密度积分值与GAPDH的比值来表示。
1.8 统计学处理
2 结果
2.1 各组大鼠的体重、FBG、HbA1c水平的变化
与A组比较,各组大鼠的体重明显降低,FBG和HbA1c水平明显升高(P均<0.05);与B组比较,C组、D组和E组大鼠的体重明显升高(P< 0.05),FBG和HbA1c水平明显降低(P<0.05);与C组比较,D组和E组大鼠的体重明显升高(P< 0.05),FBG和HbA1c水平明显降低(P<0.05,表2)。提示:本研究2型糖尿病大鼠均造模成功,而达格列净可明显降低2型糖尿病大鼠的FBG和HbA1c水平,并缓解大鼠因糖尿病造成的体重减轻,中剂量及高剂量的达格列净治疗2型糖尿病大鼠的疗效较好。
Tab. 2 Changes of body weight, FBG and HbA1c levels of rats in each n=6)
2.2 各组糖尿病大鼠肾组织病理改变和肾功能指标的变化
A组大鼠的肾组织中的肾小球、肾小管等结构未出现异常。B组大鼠的肾小囊腔出现狭窄,肾小球系膜区基质出现明显增生,肾小球出现硬化甚至纤维化,肾小管基底膜出现明显增厚,甚至出现肥厚、纤维化等。C组大鼠肾小球及肾小管的病理变化与B组区别不明显,D组、E组大鼠肾小球及肾小管的变化明显较B组轻(图1)。此外,本研究还检测了各组大鼠给药7周后的肾功能,与A组比较,各组大鼠的BUN、Scr均明显升高(P<0.05);与B组比较,各剂量组大鼠BUN、Scr均明显降低,且E组在降低SUN和Ser的水平优于C组和D组,(P<0.05,表3)。提示:达格列净可改善糖尿病大鼠肾脏组织损伤,其中达格列净高剂量效果最好。
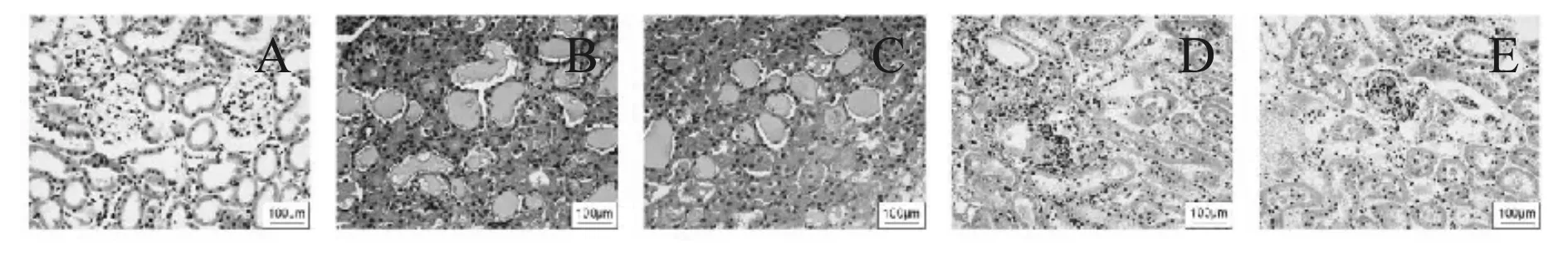
Fig. 1 HE staining results of kidney of diabetic rats in each group after administration(Hematoxylin eosin ×100)
Tab. 3 Renal function of diabetic rats in each n=6)
2.3 各组大鼠氧化应激指标的变化
与A组比较,各组大鼠血清及肾脏SOD、GSH-PX水平明显降低(P<0.05),MDA水平明显升高(P<0.05);与B组比较,各剂量组大鼠SOD、GSH-PX水平明显升高(P<0.05),MDA水平明显降低(P<0.05),且E组在上调SOD、GSH-PX水平、降低MDA水平优于C组和D组,见表4、5。提示:达格列净可降低糖尿病大鼠体内的氧化应激反应,其中达格列净高剂量效果最好。
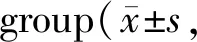
Tab. 4 Changes of serum oxidative stress indexes of rats in each n=6)
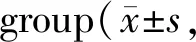
Tab. 5 Changes of kidney oxidative stress indexes in each n=6)
2.4 各组大鼠肾脏组织中GLUT2、GLUT4 mRNA水平与蛋白表达变化
与A组比较,B组大鼠肾脏组织中GLUT2、GLUT4 mRNA水平与蛋白表达明显降低(P< 0.05);与B组和C组比较,D组和E组大鼠肾脏组织中GLUT2、GLUT4 mRNA水平明显升高(P均<0.05);与B组比较,各剂量组大鼠肾脏组织中GLUT2、GLUT4蛋白表达均明显升高(P均<0.05,图2,表6)。
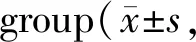
Tab. 6 Changes of GLUT2 and GLUT4 mRNA and protein expressions in kidney tissue of rats in each n=6)
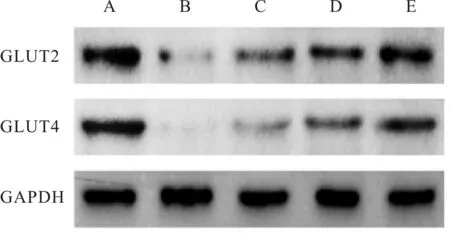
Fig. 2 Expressions of GLUT2 and GLUT4 protein in kidney of rats in each group
3 讨论
胰岛B细胞功能障碍及胰岛素抵抗是2型糖尿病的主要发病机制,而造成功能障碍的病理机制,主要是脂毒性及糖毒性[5-6]。葡萄糖代谢是在细胞内进行的,需穿过细胞膜进入细胞内发挥作用,但是葡萄糖是易溶于水的亲水性物质,而细胞膜是疏水性的双层脂膜。因此,葡萄糖需要借助位于细胞膜内的葡萄糖转运蛋白(GLUTs)通过细胞膜进入细胞内。达格列净是钠-糖协同转运蛋白2的抑制剂,能抑制肾小球对葡萄糖的重吸收,但是其对GLUT2、GLUT4的影响尚未见相关报道。
本研究中通过应用高糖高脂喂养,并联合STZ诱导大鼠进行2型糖尿病大鼠造模,经过4周喂养后,获得了稳定的2型糖尿病大鼠模型,该模型具有与早期人2型糖尿病的发病特征及临床表现。造模组大鼠FBG均>16.7 mmol/L,且FBG、HbA1c明显较对照组升高,并伴有多饮、多食、多尿的症状,与人2型糖尿病类型相似。此外,与对照组比较,模型组大鼠的体重明显降低。因此认为本研究中2型糖尿病大鼠造模成功。达格列净给药7周后,各剂量组的2型糖尿病大鼠的体重明显较模型组大鼠的体重增加,血清FBG、HbA1c、BUN、Scr水平明显降低,中剂量和高剂量达格列净还可改善大鼠肾组织的病变程度,提示了达格列净具有较好的降糖效果及一定的肾脏保护作用,与临床研究相似[7]。
目前发现的GLUTs有14个同种型,其中GLUT2、GLUT4属于基础性的葡萄糖转运体,与糖代谢密切相关[5]。GLUT2基因位于第3号染色体,由11个外显子及1个内含子构成。GLUT2是对葡萄糖的亲和力较低,但是转运能力较高的转移蛋白。有研究显示,大鼠肾脏组织中GLUT2蛋白表达主要在大鼠肾脏肾小管上皮细胞的细胞膜和胞浆中[8]。Liad等[9]研究表明,GLUT2会影响从肾小管细胞重吸收或新合成的葡萄糖从基底外侧流出;在高血糖状态下,通过易化转运体GLUT2的葡萄糖转运改变可能会对肾功能和肾小管间质改变产生负面影响。GLUT2能感应周围环境葡萄糖的浓度,当血糖升高时,会增加对葡萄糖的转运,使细胞内外葡萄糖浓度达到平衡。据报道,糖尿病大鼠血糖增高,血浆胰岛素水平降低,肝脏胰岛素受体底物2(insulin receptor substrate 2, IRS2)和GLUT2蛋白表达下调,骨骼肌GLUT4蛋白表达下调;而经治疗后,血糖水平降低,胰岛素水平提高,肝脏IRS2和GLUT2蛋白表达上调,骨骼肌GLUT4蛋白表达上调,葡萄糖转运蛋白的上调促进了肝脏和骨骼肌的葡萄糖摄取[10]。有研究表明,肾脏GLUT4蛋白主要表达于肾小管,足细胞和血管内皮细胞也有少量表达[11]。GLUT4是胰岛素刺激葡萄糖摄取的主要葡萄糖转运蛋白亚型,葡萄糖不能自由通过细胞膜,需要GLUT4的协助;在胰岛素信号的刺激下,GLUT4转运到细胞膜上,促进葡萄糖进入细胞,是直接影响葡萄糖进入细胞的因子,直接影响血糖的调节[12-13]。张环[14]等认为GLUT4对胰岛素敏感至关重要,其表达下降或转位受损与2型糖尿病病理相关。据报道[15-16],当GLUT2突变时,细胞对葡萄糖的敏感性明显下降,肝脏对葡萄糖的摄取明显减少;而GLUT4突变时,肌肉和脂肪均会出现葡萄糖摄取障碍。氧化应激会干扰胰岛素受体底物和胰岛素受体的磷酸化水平,破坏胰岛素信号传导通路,从而加剧胰岛素抵抗。相关研究还显示[17],氧化应激产生的ROS可通过丝/苏氨酸蛋白激酶等信号分子的活性,抑制GLUT4的表达与转位,干扰GLUT4介导的葡萄糖运输。
本研究结果发现,与对照组比较,模型组大鼠肾组织和血清MDA水平升高,SOD、GSH-PX水平明显降低,肾脏组织GLUT2、GLUT4表达明显降低;大鼠给药达格列净后肾组织和血清MDA水平明显较模型组降低,SOD、GSH-PX水平明显高于模型组,且肾脏组织GLUT2、GLUT4表达明显较模型组上调。提示达格列净可明显降低2型糖尿病大鼠体内的氧化应激反应,上调GLUT2、GLUT4的表达。短期高血糖具有调节胰岛素合成及葡萄糖转化作用,但是长期高血糖会加重体内的氧化应激反应,对胰岛B细胞以及其他器官、组织造成损伤,从而加重胰岛素抵抗,造成GSIS受损[18-19],并抑制了GLUT2、GLUT4的表达。达格列净通过促进血糖从尿液中排出而降低机体血糖,减轻了因高血糖而产生的应激反应,从而减轻了氧化应激损伤,上调GLUT2、GLUT4的表达,改善肾组织损伤,但如何调控GLUT2、GLUT4的表达具体机制尚无定论,可能与改善胰岛素抵抗有关[20],还有待进一步研究。
综上所述,达格列净具有较好的降糖效果,其可能的机制与抑制氧化应激及上调2型糖尿病大鼠GLUT2及GLUT4的表达有关。本研究的意义在于补充解释了达格列净发挥肾保护的相关机制,但不足之处未对GLUT2及GLUT4的表达的机制进行研究,仍需进一步研究。
