不同浓度氯霉素对大肠杆菌质粒扩增的影响
2020-03-15陈绪美尹志勇檀军田莹李卓郭建军
陈绪美 尹志勇 檀军 田莹 李卓 郭建军
摘 要:筛选获得促进大肠杆菌质粒扩增的最优氯霉素浓度。采用单因素控制变量法,通过质粒转化、摇菌、质粒提取、PCR扩增、琼脂糖凝胶电泳检测等方法,并设置菌液培养时间梯度与氯霉素浓度梯度,分析不同濃度的氯霉素对大肠杆菌质粒扩增的影响。结果显示:未加氯霉素的大肠杆菌菌液培养18h时,质粒浓度最高,为(605.425±63.241)ng/μL;菌液培养18h时加入10~250μg/mL的氯霉素对质粒扩增皆具促进作用;且浓度为150μg/mL时,质粒的扩增效率最高,为(645.425±45.042)ng/μL。10~250μg/mL的氯霉素对大肠杆菌质粒扩增皆具促进作用,促进作用最佳浓度为150μg/mL。
关键词:氯霉素;大肠杆菌;质粒;扩增;浓度
中图分类号:Q-9文献标识码:A
文章编号:1008-0457(2020)06-0081-04国际DOI编码:10.15958/j.cnki.sdnyswxb.2020.06.014
Abstract:In order to obtain the optimal concentration of chloramphenicol for promoting the amplification of plasmid in Escherichia coli, this study set the time and the concentration gradient of chloramphenicol to explore the effects of different concentrations of chloramphenicol on the amplification of plasmid. Using single-factor control variable method, this paper performed plasmid transformation, shaking, plasmid extraction, PCR amplification, and agarose gel electrophoresis detection. When E. coli solution was not provided with chloramphenicol, the plasmid concentration had the highest (605.425±63.241ng/μL) at 18 h of cultivation. Adding 10~250μg/mL chloramphenicol to culture for 18 hours could promote the amplification of plasmids. When the added concentration of chloramphenicol was 150μg/mL, the amplification efficiency got the highest(645.425±45.042)ng/μL. Chloramphenicol at the concentrations of 10-250g/mL can promote the amplification of plasmid in E. coli, and the optimal concentration is 150 μg/mL.
Keywords:chloramphenicol; Escherichia coli; plasmid; amplification; concentration
质粒是存在于细菌等生物中的可独立复制的DNA分子,可与细菌共生,并可随宿主的分裂而传给子代细胞[1],其在基因工程中具有广泛的应用,如用于构建表达载体,可实现目的基因转移、蛋白表达[2],用于制备DNA疫苗等[3-4]。在现代分子生物学试验中,质粒的扩增、提取是基本的试验操作[5-6],但用常规方法进行质粒扩增,得到的质粒产率较低[7-9],常常延误试验进程。近年来,研究人员对提取大肠杆菌质粒的各种方法进行了比较和优化,但对大肠杆菌质粒的提取结果都还不是很理想[7,10],张海峰等[11]、王友如[12]提出氯霉素对大肠杆菌质粒有扩增作用,能有效地提高大肠杆菌质粒的提取效率,但此后未见过在大肠杆菌提取试验中应用氯霉素的报道,其中促进大肠杆菌质粒扩增的氯霉素的最适浓度也尚未见报道。本试验旨在筛选促进质粒扩增的最佳氯霉素浓度,为提高大肠杆菌质粒扩增效率提供参考。
1 材料与方法
1.1 材料与试剂
无水乙醇(纯度≥99.7%)购自重庆川东化工有限公司;DH5α感受态细胞(保存于-80℃冰箱)、蛋白胨(FMB 级)、酵母膏(FMB 级)、琼脂粉(试剂级)、氯化钠(分析纯)、氯霉素(USP级)、焦碳酸二乙酯处理水(DEPC水)均购自生工生物工程(上海)有限公司;FastPure Plasmid Mini Kit试剂盒购自南京诺唯赞生物科技有限公司。
1.2 试验方法
1.2.1 LB培养基的配制
称取蛋白胨10g,牛肉膏粉3g,氯化钠5g置于烧杯中,加入去离子水,定容至1L;加入15g琼脂粉,搅拌均匀使之全部溶解,分装于锥形瓶中;121℃高压蒸汽灭菌30min,冷却至常温,备用。
1.2.2 质粒转化
取感受态细胞DH5α200μL,冰上放置10min;融化后,加入5ng大肠杆菌质粒(实验室保存pWSLV-Cytochrome c质粒,含基因片段Cytochrome c,9818 bp),待混匀后于冰上放置30min;42℃水浴45s(PC200- A40型恒温水浴锅,美国赛默飞),冰上放置2min,加入LB培养基800μL,置于37℃恒温摇床中150rpm/min振荡培养1h;取菌液200μL,均匀涂布于LB平板(含有25μg/mL氨苄青霉素);将培养基置于37℃恒温培养箱中培养12h,挑取阳性菌落进行培养。
1.2.3 摇菌时间对菌液质粒浓度的影响
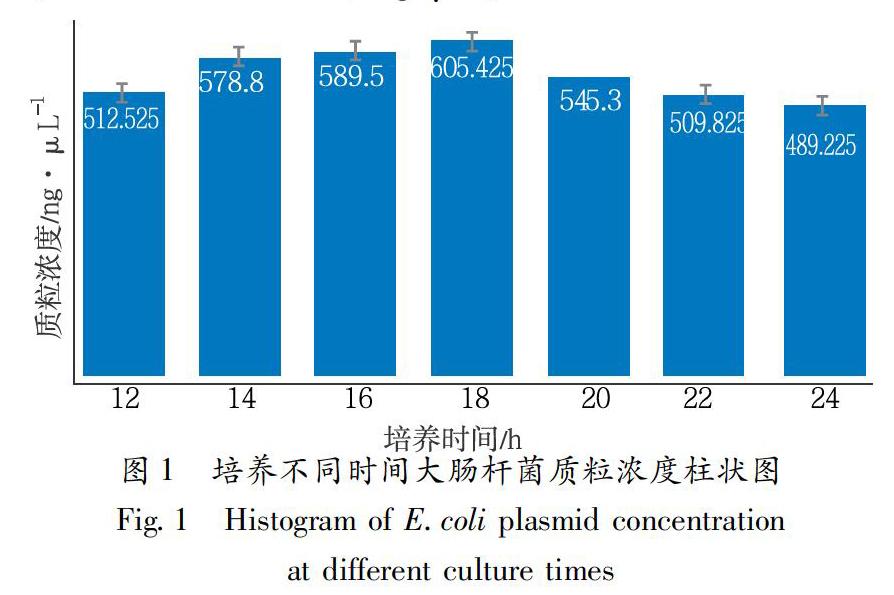
将1μL大肠杆菌加入200mL LB培养基,放入37℃恒温摇床中进行培养,分别在12h、14h、16h、18h、20h、22h、24h時,吸取5mL菌液于15mL无菌离心管中,分别对上述时间点的菌液进行质粒提取,用NanoDrop 2000/2000C分光光度计(美国赛默飞世尔公司)测量质粒浓度,确定质粒浓度最高的培养时间。
1.2.4 不同浓度氯霉素对质粒浓度的影响
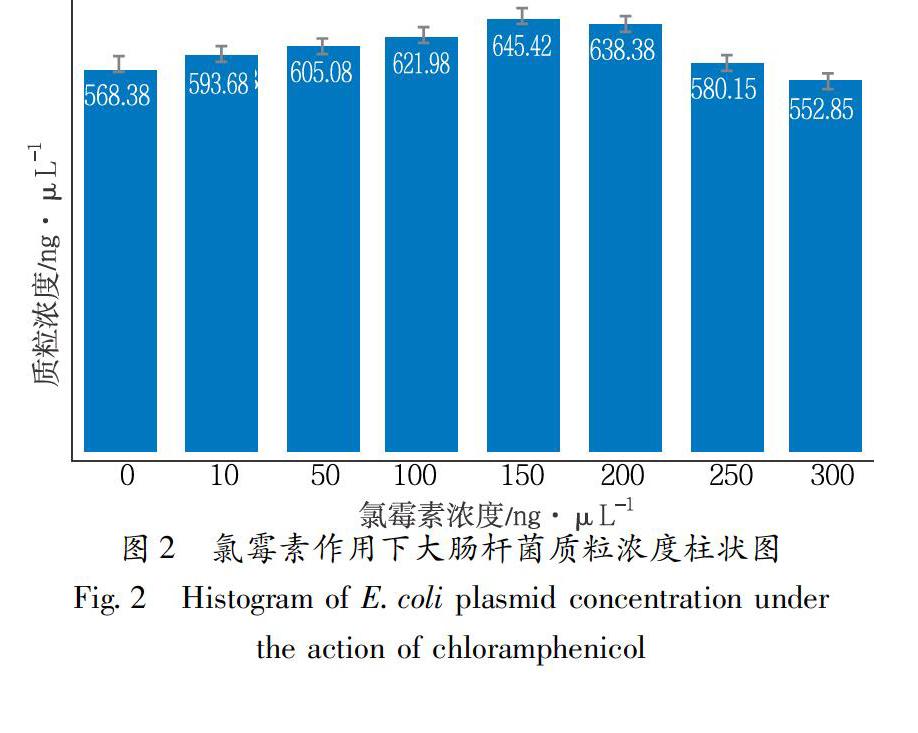
为了延长质粒的对数生长期,在1.2.3筛选到最佳摇菌时间的基础上,分别向各锥形瓶中加入不同浓度氯霉素,终浓度分别为0、10、50、100、150、200、250、300μg/mL,放入37℃恒温摇床中培养6h。
1.2.5 质粒提取
取5mL菌液于15mL离心管中,10000g离心1min,去菌液;向留有沉淀的离心管中加入250μL Buffer P1,用移液枪吹打使之混合均匀;加入250μL Buffer P2,温和地上下颠倒混匀8次;加入350μL Buffer P3,上下颠倒混匀8次,13000g离心10min;将Fast Pure DNA Mini Columns吸附柱置于2mL收集管中,将上清液转移到吸附柱中,13000g离心1min,倒掉收集管中的废液;向吸附柱加入600μL Buffer PW(事先加入无水乙醇稀释),13000g离心1min,弃废液;再加入600μL Buffer PW,13000g离心1min,弃废液;将离心柱放回收集管中,13000g离心1min;将吸附柱置于1.5mL离心管中,加入30μL Elution Buffer,静置2min,13000g离心1min洗脱;重复洗脱一次。-20℃保存。
1.3 质粒的检测
1.3.1 1%琼脂糖凝胶电泳检测质粒
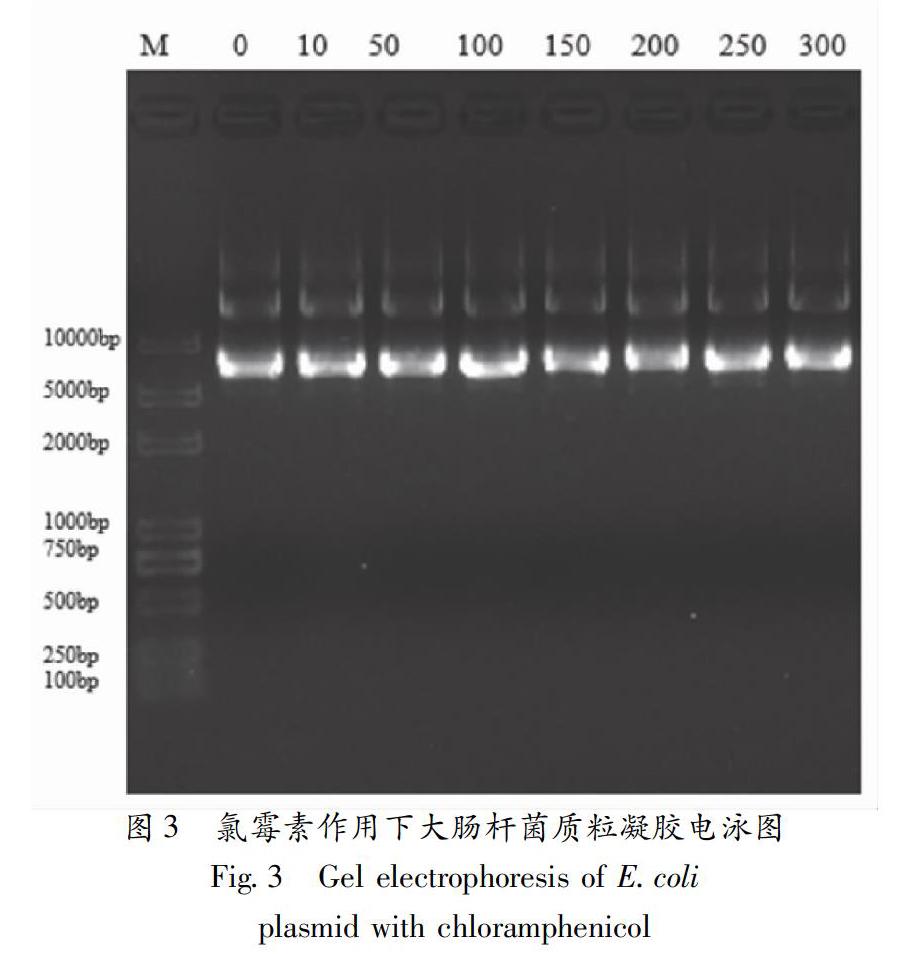
取3 μL质粒和2 μL上样缓冲液混合,加入1% 琼脂糖凝胶中,130V电泳20min,用Bio-Rad凝胶成像仪(美国伯乐公司)拍照。
1.3.2 PCR扩增及扩增产物检测
以1.2.5中提取的质粒为模板,根据质粒中含有的Cytochrome c基因序列(327 bp),利用Primer 6.0软件设计扩增引物如下,上游:5'-ATGGGTGTCCCTGGAGGA-3,下游:5'-CTTAGCTTCTTTTAG-3,依次向PCR管中加入质粒2μg、上下游引物各1 μg、PCRmix 10μL、ddH2O 6μL,PCR总反应体系为20μL。PCR扩增反应条件如下:预变性:96℃、3min,35个循环;变性:96℃、20s;退火:59℃、20s;延伸:72℃、1min;35个循环结束后,总延伸:72℃,3min;取8μL PCR产物,上样;1% 琼脂糖凝胶中130V电压下电泳 20min,用Bio-Rad凝胶成像仪拍照。
1.4 统计学处理
试验数据使用SPSS 21.0软件进行分析,试验数据以均值±标准误(Mean±SE)表示。
2 结果与分析
2.1 不加氯霉素条件下大肠杆菌质粒结果分析
2.1.1 质粒浓度分析
培养不同时间的大肠杆菌菌液的质粒浓度如图1,可见质粒的浓度总体呈现先上升后下降的趋势,在培养18h时,提取的质粒的浓度最高,为(605.425±63.241)ng/μL。
2.2 氯霉素对大肠杆菌质粒扩增结果分析
2.2.1 质粒浓度分析
氯霉素作用下的大肠杆菌菌液质粒浓度如图2所示,结果表明,大肠杆菌质粒的浓度随着氯霉素浓度的升高呈先上升后下降的趋势,10~250μg/mL的氯霉素对大肠杆菌质粒扩增具有促进作用,且在氯霉素浓度为150μg/mL时大肠杆菌质粒的浓度达到最高,为(645.425±45.042)ng/μL。由图2可知,与对照组相比,除氯霉素浓度为300μg/mL时大肠杆菌质粒的浓度有所降低,其余各组中大肠杆菌质粒的浓度都有所增加,其中氯霉素浓度为150μg/mL时对大肠杆菌质粒的扩增作用最明显。
2.2.2 1%琼脂糖凝胶电泳检测结果分析
图3为氯霉素作用下大肠杆菌质粒凝胶电泳图,从图中可见,各浓度氯霉素作用下的大肠杆菌质粒都有亮度基本一致的条带,其分子量在5000~10000 bp之间,与预期的导入大肠杆菌质粒分子量9818 bp基本一致。
2.2.3 PCR检测结果分析
图4是以氯霉素作用下的大肠杆菌质粒为模板进行的PCR扩增产物凝胶电泳图,在氯霉素浓度为0、10、50、100、150、200、300 μg/mL时,在250 bp偏上的位置可见目的条带,其中氯霉素浓度为150 μg/mL时的扩增条带最亮,与其预期的扩增产物Cytochrome c基因开放阅读框327 bp基本一致。
3 结论与讨论
质粒表达并携带的遗传信息对基因工程的开展有着至关重要的作用。随着质粒在基因工程中的广泛应用,试验中对质粒的要求越来越高,提取质粒的浓度、纯度等直接影响试验结果。传统的方法和试剂盒直接提取大肠杆菌的质粒,得到的质粒浓度都不太理想[7-9]。研究表明氯霉素对大肠杆菌质粒有扩增作用[11]。在此基础上,本试验以改变大肠杆菌的培养条件,在培养过程加入不同浓度的氯霉素,再用试剂盒提取大肠杆菌质粒,以探究氯霉素对大肠杆菌质粒扩增作用的最佳浓度,以获得高浓度的大肠杆菌质粒。
近年来,研究人员对提取大肠杆菌质粒的各种方法进行了比较和优化,张海峰等[11]、王友如[12]提出氯霉素对大肠杆菌质粒有扩增作用,此后鲜见在对大肠杆菌质粒的提取方法中应用氯霉素的报道。本试验在前人研究明确氯霉素对大肠杆菌质粒有扩增作用的基础上,筛选促进大肠杆菌质粒扩增作用的最适氯霉素浓度,旨在提高提取的大肠杆菌质粒的浓度,为提高大肠杆菌质粒扩增效率提供参考。
本研究各试验组和对照组的大肠杆菌均在同一时间、同一条件下培养,且采用同一试剂盒在同一时间、同一条件下提取大肠杆菌质粒,避免了温、湿度和营养条件等差异影响试验结果。采用单因素控制变量法,首先明确了大肠杆菌在培养18 h时,所提取的大肠杆菌质粒的浓度最高,在此基础上,向菌液中加入不同浓度的氯霉素,再培养6 h,对大肠杆菌质粒进行提取、比较,明确了在氯霉素浓度为150 μg/mL时,大肠杆菌质粒的扩增效率最高。为进一步明确所提取的质粒为目的质粒,本研究以所提取的质粒为模板,根据质粒中含有的Cytochrome c基因序列设计了一对引物进行PCR扩增,且分别对质粒及PCR扩增产物进行琼脂糖凝胶电泳检测,在预期的分子量(质粒9818 bp、PCR扩增产物327 bp)附近均可见清晰的目的条带,表明所提取的质粒为携带Cytochrome c基因的目的质粒。
在质粒提取试验中,质粒的浓度对后续的一系列试验的结果都有较大的影响,因此在一系列与质粒有关的试验中,质粒的浓度对试验的进行起着至关重要作用。本试验结果表明,氯霉素对大肠杆菌质粒的扩增具有明显的促进作用,与对照组相比,氯霉素浓度为150 μg/mL时,大肠杆菌质粒的扩增效果最明显。在前期质粒提取试验中加入氯霉素对大肠杆菌进行培养,再提取质粒,再用此质粒开展后续试验,有利于后续一系列试验的顺利开展及提高试验效果。
综上所述,菌液培养至18时,加入10~250 μg/mL的氯霉素对大肠杆菌质粒扩增均具有促进作用,且在在氯霉素浓度为150 μg/mL时,大肠杆菌质粒的扩增效率最高,该研究结果可为提高大肠杆菌质粒扩增效率提供参考。
参 考 文 献:
[1] SMILIE C, GARCILLAN-BARCIA M P, FRANCIA M V, et al. Mobility of plasmids[J].Microbiol and molecular biology reviews, 2010, 74(3): 434-452.
[2] HARRISON E and BROCKHURST M A.Plasmid-mediated horizontal gene transfer is a coevolutionary process[J].Trends in microbiol, 2012, 20(6): 262-267.
[3] ABBINK P, LAROCCA R A, DE LA BARRERA R A, et al. Protective efficacy of multiple vaccine platforms against Zika virus challenge in rhesus monkeys[J].Science, 2016, 6304(353): 1129-1132.
[4] LIU M A. Immunologic basis of vaccine vectors[J].Immunity, 2010, 33(4): 504-515.
[5] SAMBROOK J, FRITSCH E F, MANLATIS T. Molecular Cloning: A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press, 1993:16-23.
[6] 王芳, 吳文惠, 蒋霞云. 生化综合实验项目的设计及应用——以大肠杆菌质粒DNA的提取、酶切及电泳为例[J].现代农业科技, 2016, 10(2): 328-329.
[7] 王友如, 崔洪志, 郭三堆. 农杆菌质粒DNA提取方法的优化[J].生物技术, 2005, 15(4): 41-43.
[8] 李恒. 大肠杆菌质粒DNA提取方法的研究[J].资源节约与环保, 2018(6): 72.
[9] 吴桂梅. 柱式法和磁珠法提取大肠杆菌中质粒DNA[J].生物技术世界, 2015, 26(11): 26-27.
[10] 白国辉, 曾凤娇, 于航, 等. 大肠杆菌中质粒 DNA 大量提取条件的优化[J].现代养生, 2019(2): 95-96.
[11] 张海峰, 张登波, 马大龙. 氯霉素对大肠杆菌质粒的扩增作用[J].首都医学院学报, 1988(4): 295.
[12] 王友如. 大肠杆菌质粒DNA提取方法的优化[J].生物技术, 2006, 16(5): 42-44.
