TP53 基因沉默介导PI3K/PTEN/AKT 信号通路对肾透明细胞癌侵袭转移的调控机制
2020-03-15刘晓丽庞文帅黄朝康
刘晓丽,庞文帅,黄朝康,朱 磊
(河北医科大学附属邢台市人民医院病理科,河北 邢台 054001)
肾癌是一类多基因相关肿瘤,发病机制复杂[1]。研究发现,细胞内环境紊乱(细胞内信号转导途径不平衡)为主的机体内环境失衡被认为是肿瘤发展的重要因素[2]。同源性磷酸酶-张力蛋白(PTEN)为常见抑癌基因,PI3K/PTEN/AKT 信号通路处于肿瘤细胞生长调节的中心环节,该通路的活化可抑制外源性刺激对肿瘤细胞凋亡的诱发作用,进而促进细胞的生存能力和增殖转移,在肿瘤进程中发挥重要作用[3]。PI3K/PTEN/AKT信号通路关联基因之一肿瘤蛋白p53 基因(TP53)为常见促癌基因,参与众多肿瘤发病[4]。本研究中探讨了TP53 基因沉默介导PI3K/PTEN/AKT 信号通路对肾透明细胞癌侵袭转移的调控机制,为临床肾透明细胞癌的治疗提供参考。现报道如下。
1 材料与方法
1.1 材料
试剂:DMEM 培养基(美国Gibco 公司);Lipofectamine®2000 转染试剂、Trizol 试剂盒均购自美国Invitrogen 公司;表达载体构建(北京信诺金达生物科技有限公司);免疫组化和Western Blot 抗体(英国Abcam 公司);DAB 显色底物、磷酸缓冲盐溶液(PBS)、RIPA 裂解液、CCK-8 试剂、ECL 发光液均购自上海碧云天生物技术有限公司;PCR 扩增仪、ABI7500 型定量PCR 仪均购自美国赛默飞世尔科技公司;PCR 引物合成(南京金斯瑞生物科技有限公司);BCA 定量试剂盒(南京森贝伽生物科技有限公司)。
细胞:人肾透明细胞癌细胞株RLC-310(中国科学院上海细胞研究所);人正常肾脏上皮细胞(江苏齐氏生物科技有限公司)。
患者纳入标准:经病理组织学或细胞学确诊,或有典型临床特征确诊为肾透明细胞癌;年龄32 ~76 岁;术前未接受放化疗或其他抗肿瘤治疗。
患者排除标准:患有其他原发性恶性肿瘤且对本研究产生影响;临床资料不完整;不配合研究。
标本:选取我院2016 年至2018 年收治的手术患者60 例,其中男36 例,女24 例;年龄32 ~76 岁,平均(56.63±7.44)岁,术后病理检查均确诊为肾透明细胞癌。选取患者的肿瘤组织及癌旁组织,各组织标本采集后均置含RNA 保存液的冻存管中,并立即置-80 ℃冻存,备用。标本采集已得到患者本人及其家属同意。
1.2 方法
细胞培养与细胞转染分组:取人肾透明细胞癌细胞株RLC-310,用含10%胎牛血清、100 μg/mL 青霉素和100 μg/mL 链霉素的DMEM 培养基,于37 ℃及5%CO2恒温培养箱内常规培养。细胞生长至70% ~80%融合度时用0.25%胰酶消化,进行传代。RLC-310 细胞转染分组为空白组(细胞不转染,A 组)、阴性对照组[细胞转染短发夹RNA(shRNA),B 组]、shTP53 组(细胞转染TP53 shRNA,C 组)、PTEN 抑制剂bpv 组[细胞转染空载体,PI3K/PTEN/AKT 信号通路激活剂(phen)处理细胞,D 组]、phen+shTP53 组(细胞转染TP53 shRNA,并用phen 处理细胞,E 组)。细胞培养用6 孔板,以1×106个细胞/孔铺板,使用不含血清的DMEM 新鲜培养基,在细胞密度约占培养板80% 时,使用Lipofectamine® 2000 转染试剂将表达载体加入到培养基中进行转染,转染24 h 后加入phen 处理细胞,作用24 h 后更换为含10%胎牛血清的DMEM 2 mL,继续于37 ℃、5% CO2孵箱中培养72 h。将各组RLC-310 细胞接种于24 孔板内,加入DMEM 新鲜培养基至各组细胞中,并置37 ℃、5% CO2恒温培养箱中培养48 h。
免疫组化检测:取出组织标本,用10%甲醛固定,石蜡包埋,5 μm 连续切片。切片在60 ℃恒温箱中烤片1 h,常规二甲苯脱蜡,梯度乙醇脱水;3% H2O2阻断内源性过氧化物酶;微波抗原修复;10%山羊血清封闭;加兔抗人TP53 一抗;加入辣根过氧化物酶标记的羊抗兔免疫球蛋白(IgG)。DAB 显色后,苏木素复染,用中性树脂固定封片。以PBS 代替一抗作阴性对照。在高倍镜下选取5 个视野计数细胞并拍照,着色为棕黄色为阳性表达,根据阳性细胞占全部细胞的比例计算TP53 的阳性细胞率。
实时荧光定量PCR(qRT-PCR)检测:采用Trizol试剂盒提取各组RLC-310 细胞的总RNA,取5 μL RNA 样品,用无RNA 酶超纯水稀释20 倍,读取其在紫外分光光度计260 nm 和280 nm 波长处的吸光度,测定RNA浓度和纯度。用PCR 扩增仪进行逆转录反应合成cDNA模版,应用ABI7500 型定量PCR 仪进行实时定量RTPCR 试验。采用相对定量法计算,用2-ΔΔCt表示各目的基因的相对表达量,每个试验均重复3 次,取平均值。
Western Blot 检测:将各组RLC -310 细胞加入100 μL RIPA 裂解液裂解,预冷PBS 洗3 遍,将细胞刮下,移至1.5 mL 离心管中使细胞充分裂解,14 000g离心10 min,取上清液置-20 ℃保存。试验时再将样品取出,用BCA 定量试剂盒进行定量,后加入上样缓冲液,95 ℃煮10 min 后,上样30 μg,在100 V 电压下电泳90 min,通过聚丙烯酰胺凝胶上电泳分离蛋白后采用湿转方法将蛋白转膜,用5% BSA 室温下封闭1 h 后孵育一抗,4 ℃过夜。其中一抗为TP53、PTEN、磷脂酰肌醇-3-激酶(PI3K)、AKT、GAPDH。一抗孵育完毕后,用1×TBST 溶液室温下摇床摇动洗膜,每次5 min,洗3 次,加一抗相应的二抗山羊抗兔IgG -HRP 温育后放入ECL 发光液显色。利用Quanity One 软件进行蛋白条带灰度分析。
CCK-8 法检测:取各组RLC-310 细胞进行常规消化,用含5%胎牛血清的DMEM 培养基重悬细胞并计数,以5.0×103个/孔接种于96 孔板中,每组设3 个复孔。置培养箱分别培养24,48,72,96 h 后,吸去培养基,PBS 冲洗,加入100 μL 无血清培养基和10 μL CCK-8液体,37 ℃孵育30 min 后,用酶标仪于490 nm 波长处读取吸光度,取重复试验的平均值,绘制生长曲线。
创口愈合试验:各组细胞转染48 h 后,接种至24孔板中,待细胞生长至密度为80% ~90%时进行转染,转染6 h 后更换新的培养基,在37 ℃、5% CO2培养箱中,加入含10%胎牛血清的DMEM 培养基,培养至细胞长满培养板,使用枪头垂直于细胞培养板划痕,然后使用PBS 溶液冲洗细胞3 次,在0,24,48 h 拍照并测量划痕宽度。计算创口愈合率。
Transwell 侵袭试验:收集各组转染细胞重新悬浮于无血清培养基中,取细胞悬液接种于Transwell 的上室,每孔15 μL,37 ℃包被1 h。在小室下层孔中加入750 μL含15%胎牛血清的DMEM 完全培养基,将Transwell 小室置入37 ℃、5% CO2培养箱培养48 h,用棉棒擦去嵌室底部内表面未穿透的细胞及Matirgel 胶,4%甲醛固定,结晶紫染色。在显微镜下计数5 个单独视野的穿膜细胞数。
1.3 统计学处理
采用SPSS 21.0 统计学软件进行分析。计量资料以表示,两组间及多组间均数比较行t检验及单因素方差分析;计数资料以率(%)表示,行χ2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 TP53 蛋白阳性表达检测结果
各组织切片中TP53 蛋白表达呈阳性,染色为棕黄色,详见图1 A。与癌旁组织组相比,癌组织组的TP53蛋白阳性表达率显著增加[36.67%(22/60)vs.80.00%(48/60),P <0.05],详见图1 B。
2.2 细胞mRNA 和蛋白表达水平
qRT-PCR 检测结果发现,与人正常肾脏上皮细胞相比,RLC-310 细胞的TP53 的mRNA 表达水平显著增加,组间比较,差异有统计学意义[(0.98±0.04)vs.(1.64±0.07),P <0.05]。细胞转染分组后,qRT-PCR和Western Blot 检测各组细胞TP53,PTEN,PI3K,AKT基因的mRNA 和蛋白表达水平见图2 和图3。可见,与A 组相比,B 组的TP53,PTEN,PI3K,AKT mRNA 和蛋白表达水平均无显著变化(P >0.05);C 组的TP53,PI3K,AKT mRNA 和蛋白表达水平显著下降,PTEN mRNA 和蛋白表 达水平均显 著上升(P <0.05);D 组TP53,PI3K,AKT mRNA 和蛋白表达水平均显著上升,PTEN mRNA 和蛋白表达水平均显著下降(P <0.05);E 组的PTEN,PI3K,AKT mRNA和蛋白表达水平均无显著变化(P >0.05),TP53 的mRNA 和蛋白表达水平均显著下降(P <0.05)。
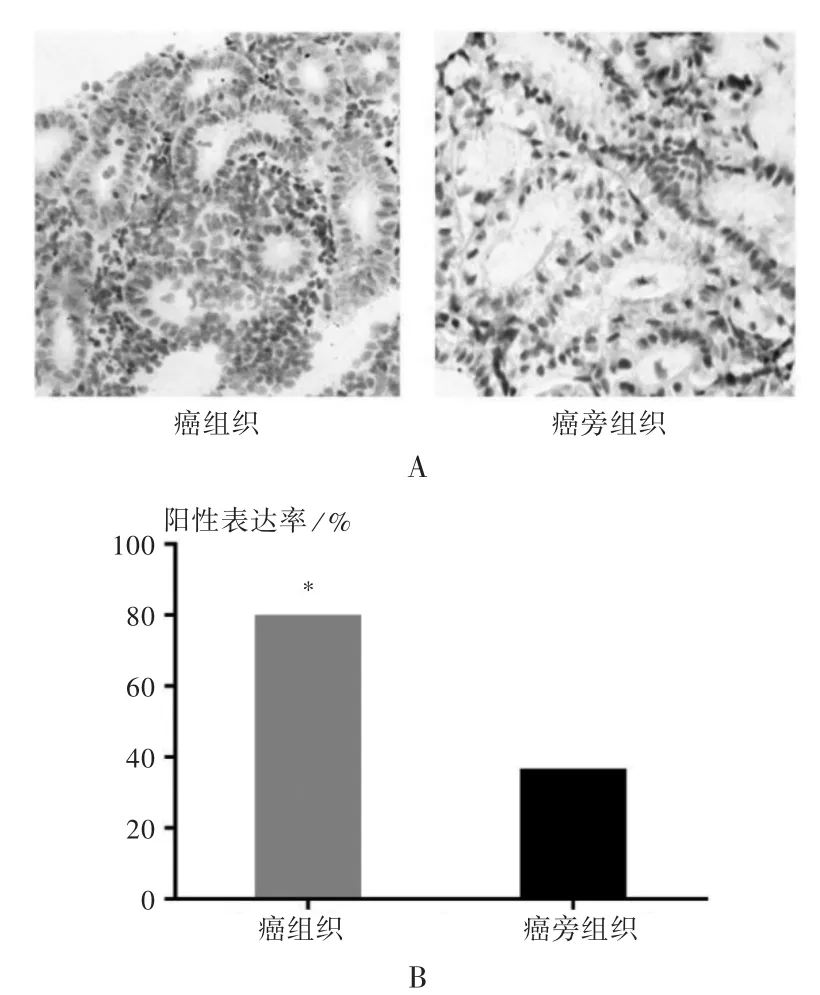
图1 TP53 蛋白阳性表达检测结果

图2 各组细胞qRT-PCR 检测结果
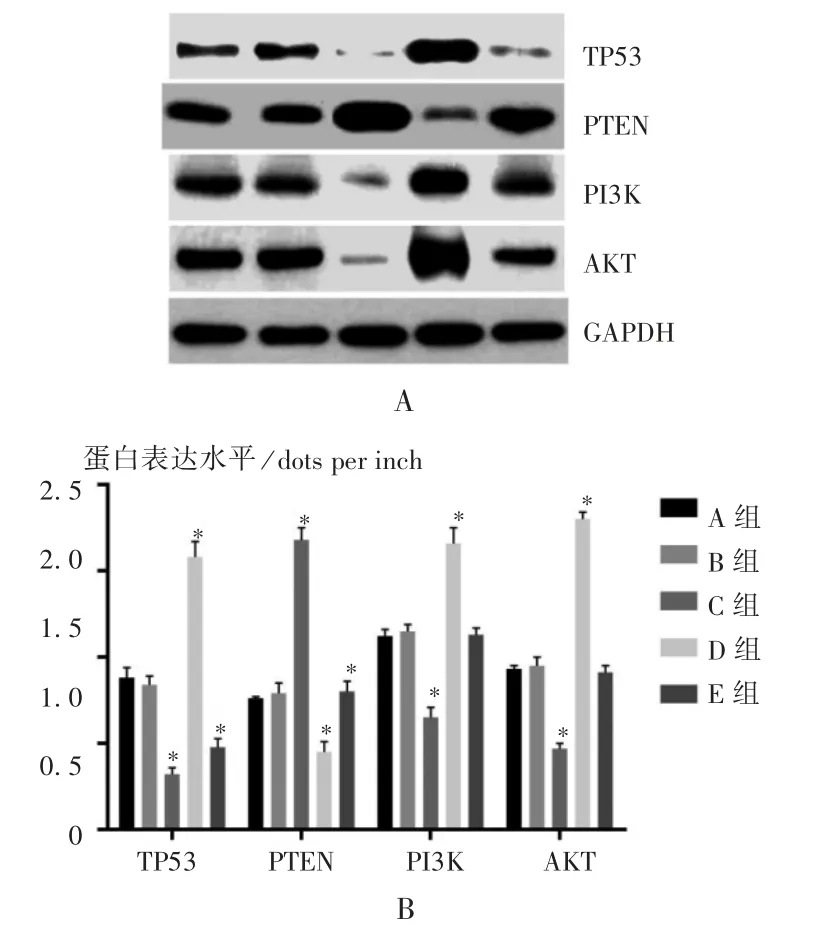
图3 各组细胞Western Blot 检测结果
2.3 细胞转染后增殖能力
各组RLC-310 细胞的增殖能力见图4。可见,与A 组相比,B 组和E 组的增殖能力均无显著变化(P >0.05),C 组的增殖能力显著降低(P <0.05),D 组的增殖能力显著升高(P <0.05)。
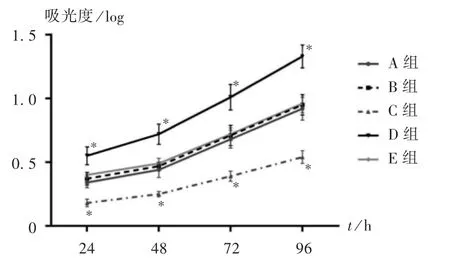
图4 各组细胞增殖能力比较(490 nm)
2.4 细胞转染后迁移和侵袭能力
各组RLC-310 细胞通过划痕愈合试验和Transwell试验分别检测其迁移和侵袭能力,通过测量各组细胞划痕宽度变化来计算迁移率,并通过侵袭细胞数计算侵袭率,结果见图5。可见,与A 组相比,B 组和E 组的迁移率和侵袭率均无显著变化(P >0.05),C 组的迁移率和侵袭率显著降低(P <0.05),D 组的迁移率和侵袭率显著升高(P <0.05)。
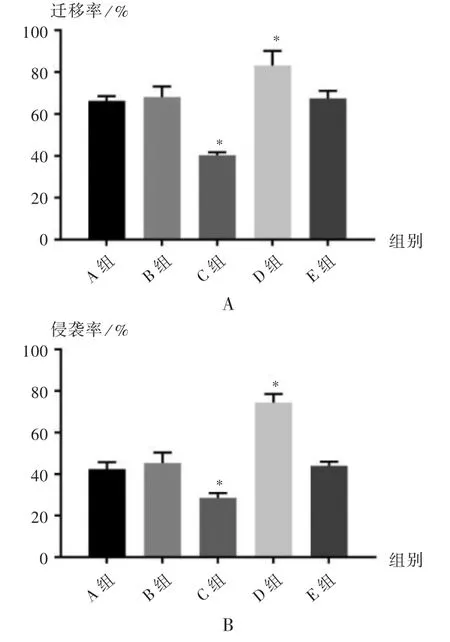
图5 各组细胞迁移能力和侵袭能力比较
3 讨论
肾透明细胞癌属肾实质癌常见类别,起病隐匿,是来源于肾小管上皮细胞的腺癌[5]。作为常见泌尿系统恶性肿瘤,肾癌的发病率和死亡率均较高,且呈逐年上升趋势[6]。肾癌常见治疗手段为手术治疗,根治性肾切除多用于早期局限性肾癌,但尚有部分肾癌患者因远处转移而无法接受手术治疗,生存率极低,预后较差[7]。同时,晚期肾癌及转移性肾癌患者均具有较强耐药性[8]。随着对肾癌分子机制认识的深入,有研究发现传统肿瘤疗法缺乏特异性,并伴有明显毒副作用[9],已不能满足当代肿瘤治疗的需求。近年来,信号转导途径中的某些关键分子已成为分子靶向治疗的研究热点。该治疗基于肿瘤分子生物学,以肿瘤特异性分子作为靶点,应用分子制剂,确认可供治疗干预的分子靶点(促癌基因、抑癌基因、信号转导通路等)。
诸多信号转导途径中,PI3K/PTEN/AKT 信号通路是目前研究较成熟的通路,其活化可促进细胞生长转移[10]。PTEN 是该通路的主要因子之一,可抑制PI3K 的功能并对抗AKT 的活化,在多类肿瘤如脑胶质瘤中等均存在缺失或突变[11-12]。同时,PI3K 的关键功能在于介导组织细胞凋亡,活化的PI3K 可激活细胞信号转导,并与AKT 蛋白相互作用,转位至细胞核或细胞浆,进而调控细胞活性,并抑制细胞凋亡[13]。本研究结果显示,TP53 蛋白在肾透明细胞癌中呈阳性表达,且与癌旁组织组相比,癌组织组的TP53 蛋白阳性表达率显著增加,提示TP53 异常高表达可能与肾透明细胞癌的发病有关,该推测在细胞试验中亦得到证实,RLC -310 细胞的TP53 的mRNA 表达率显著高于正常人肾脏上皮细胞中的水平。另外,推测该蛋白可能通过促进细胞增殖诱发该肿瘤的发生。若可抑制TP53 表达或干扰其目标信号转导通路,可为该肿瘤的早期诊断和治疗提供新思路。
qRT-PCR 和免疫印迹法检测各组细胞TP53,PTEN,PI3K,AKT 基因的mRNA 和蛋白表达水平的结果显示,抑制TP53 基因表达可抑制PI3K/PTEN/AKT信号通路的激活,诱发抑癌基因PTEN 活性,而phen 处理可导致该信号通路的激活,并抑制PTEN 活性;沉默TP53 基因可逆转phen 诱导的PI3K/PTEN/AKT 信号通路的激活,有助于抑制该肿瘤的发生、发展。上述结果经各组细胞转染后增殖能力、迁移能力和侵袭能力比较,验证了沉默TP53 基因表达在抑制phen 诱导的肾透明细胞癌细胞浸润转移中的作用。
综上所述,TP53 在肾透明细胞癌中高表达,可通过抑制该基因的表达来发挥肿瘤抑制作用,TP53 基因可作为肾透明细胞癌诊疗的指标。沉默TP53 基因抑制PI3K/PTEN/AKT 信号通路,从而抑制肾透明细胞癌细胞浸润转移功能,并可逆转phen 诱导的肾透明细胞癌细胞浸润转移,对肾透明细胞癌的诊治作用显著。
