食品中阪崎克罗诺杆菌的药物敏感性及分子分型研究
2020-03-15张彩霞陈颖胡安妥王娉王宏勋
张彩霞, 陈颖, 胡安妥, 王娉*, 王宏勋
(1.武汉轻工大学食品科学与工程学院, 武汉 430023; 2.中国检验检疫科学研究院农产品安全研究中心, 北京 100176; 3.南京财经大学食品科学与工程学院, 南京 210046)
克罗诺杆菌(Cronobacter)[原阪崎肠杆菌(Enterobactersakazakii)]主要寄生于人体和动物肠道内,是周生鞭毛、可运动、无芽孢、兼性厌氧的革兰氏阴性肠杆菌[1],在自然界中广泛分布,乳制品及原料、即食食品、蔬菜、调味品、乳品生产环境、冲调器具等都有检出克罗诺杆菌的报道[2]。2012年,Joseph等[3]将克罗诺杆菌属定义为7个种,即阪崎克罗诺杆菌(Cronobactersakazakii)、丙二酸盐阳性克罗诺杆菌(Cronobactermalonaticus)、苏黎世克罗诺杆菌(Cronobacterturicensis)、康帝蒙提克罗诺杆菌(Cronobactercondimenti)、尤尼沃斯克罗诺杆菌(Cronobacteruniversalis)、穆汀斯克罗诺杆菌(Cronobactermuytjensii)、都柏林克罗诺杆菌(Cronobacterdublinensis)。受到污染的婴幼儿配方粉是新生儿感染的主要渠道,可导致新生儿脑膜炎、败血症和致死性小肠结肠炎等严重疾病,致死率达40%~80%[4]。我国GB 10765-2010《食品安全国家标准婴儿配方食品》中规定0~6月龄婴儿食用的配方食品中不得检出克罗诺杆菌[5],此标准与EC 1441/2007[6]中的相关规定一致。
克罗诺杆菌具有很强的抗干燥特性[7],可在低水分活度的婴幼儿配方食品中长期存活[8]。乳制品生产加工过程中,如操作不当极易造成克罗诺杆菌的污染。近年来,我国婴幼儿感染克罗诺杆菌的事件屡有报道[9-10]。临床上常使用β-内酰胺类抗生素和氨基糖苷类抗生素治疗克罗诺杆菌的感染,并且已有相关耐药菌株的报道。周显凤等[11]研究发现,婴幼儿配方奶粉中分离的7株阪崎肠杆菌对β-内酰胺类抗生素均有不同程度的耐药性,其中1株阪崎肠杆菌几乎对被测的所有头孢类抗生素耐药;张西萌等[12]的研究表明,进口乳制品中阪崎克罗诺杆菌对苯唑西林100%耐药,对头孢噻吩、氨苄西林、头孢唑啉和四环素具有不同程度的耐药性;郑金华等[13]研究发现,婴幼儿食品中分离的7株克罗诺杆菌对头孢西丁的耐药率为100%。因此,需要加强婴幼儿配方奶粉中克罗诺杆菌的监测及控制污染,其中,对细菌耐药性检测是监测的重要内容。本研究分析了食品中分离的68株阪崎克罗诺杆菌的抗生素敏感性和分子分型,探究了阪崎克罗诺杆菌的耐药情况和脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分子分型特征,并探讨了二者之间的相关性,以期为克罗诺杆菌引发的食源性疾病溯源和分子流行病学研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1菌株 从黑龙江、新疆、辽宁、北京等地食品样品中分离的68株阪崎克罗诺杆菌。其中,58株分离自配方粉,3株分离自巧克力,2株分离自洋葱圈,2株分离自方便面,1株分离自辣虾条,1株分离自饼干,1株分离自辣味虾。所有菌株经生化及16s rRNA鉴定确定为阪崎克罗诺杆菌。沙门氏菌标准菌株H9812、质控菌株ATCC25922为本实验室保存。
1.1.2培养基与主要试剂 脑心浸液液体培养基(brain heart infusion,BHI)、脑心浸液琼脂培养基(brain heart infusion agar,BHIA)(北京陆桥技术有限公司);蛋白酶K(德国Calbiochem公司);Tris-HCl(美国Biosharp公司);EDTA(美国Amresco公司);SeaKem Gold琼脂糖(瑞士Lonza公司);硫脲(美国Amresco公司);XbaⅠ限制性内切酶(日本TaKaRa公司);十二烷基硫酸钠(美国Amresco公司);十二烷基肌氨酸钠(日本Sigma公司);细胞悬浮液、细胞裂解液、5×TBE(上海生工生物工程有限公司)。
1.1.3主要仪器与设备 BD Phoenix Spec Nephelometer比浊仪(美国BD公司);BD PhoenixTM-100全自动细菌鉴定及药敏分析系统(美国BD公司);BD PhoenixTMNMIC/ID-4革兰式阴性菌鉴定及药敏板(美国BD公司);恒温水浴摇床(WS20,德国WIGGENS公司);恒温培养箱(Memmert,德国Binder公司);恒温水浴锅(WNB400,德国Memmert公司);CHEF MAPPER XA脉冲场凝胶电泳仪(MODEL 200/2.0 POWER SUPPLY,美国BIO-RAD公司);凝胶成像系统(VersaDoc,美国BIO-RAD公司)。
1.2 试验方法
1.2.1菌株活化 无菌操作将-80 ℃冻存的阪崎克罗诺杆菌接种于BHI中,36 ℃过夜培养,次日将培养液划线接种至BHIA平板上,36 ℃过夜培养。
1.2.2药敏检测 抗生素敏感性分析选用BD PhoenixTM-100全自动细菌鉴定及药敏分析系统。无菌操作刮取BHIA平板上的新鲜菌落到比浊管,调节菌悬液浓度至0.5 MCF,采用BD PhoenixTMNMIC/ID-4药敏板进行药敏检测,按照说明书进行操作。BD PhoenixTMNMIC/ID-4药敏板检测项目19种,包括青霉素类(氨苄西林、哌拉西林)、头孢类(头孢唑啉、头孢吡肟、头孢噻肟、头孢他啶)、β-内酰胺/β-内酰胺酶抑制剂类(氨曲南、亚胺培南、美罗培南、阿莫西林-克拉维酸、氨苄西林-舒巴坦、哌拉西林-他唑巴坦)、氨基糖苷类(阿米卡星、庆大霉素)、喹诺酮类(环丙沙星、左氧氟沙星)、叶酸途径抑制剂类(复方新诺明)、酰胺醇类(氯霉素)、四环素类(四环素)。
1.2.3PFGE分型 参照文献[14],优化部分试验参数。将新鲜培养的阪崎克罗诺杆菌制备成菌悬液(4.0~4.5 MCF),加入1%的SeaKem Gold琼脂糖混合制成胶块,将凝固的胶块转入0.1 mg·mL-1蛋白酶K和细胞裂解液的混合液54 ℃裂解3.5 h,用XbaⅠ限制性内切酶37 ℃酶切3.5 h,然后与1%的琼脂糖制成电泳凝胶。电泳参数:电压为6 V·cm-1,温度为14 ℃,起始转换时间为2.16 s,最终转换时间为54.17 s。电泳结束后,染色、脱色、成像,电泳图谱用BioNumerics Version 6.6软件进行聚类分析。条带位置差异容许度设置为0.5%,优化值设为0.5%,PFGE带型之间的相似度采用Dice系数来衡量。
1.3 数据处理
采用SPSS 19.0软件对数据进行统计分析。
2 结果与分析
2.1 菌株药敏试验结果
表1显示,68株阪崎克罗诺杆菌分离株对氨苄西林、哌拉西林、头孢吡肟、头孢噻肟、头孢他啶、氨曲南、亚胺培南、美罗培南、阿莫西林-克拉维酸、氨苄西林-舒巴坦、哌拉西林-他唑巴坦、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、复方新诺明16种抗生素均敏感。4株阪崎克罗诺杆菌具有耐药性,耐药率为5.88%。其中,对头孢唑啉耐药的菌株3株,对四环素耐药的菌株1株。18株菌表现为中介,其中,对头孢唑啉中介的菌株16株,对氯霉素中介的菌株2株。所有菌株对其余16种抗生素均敏感。
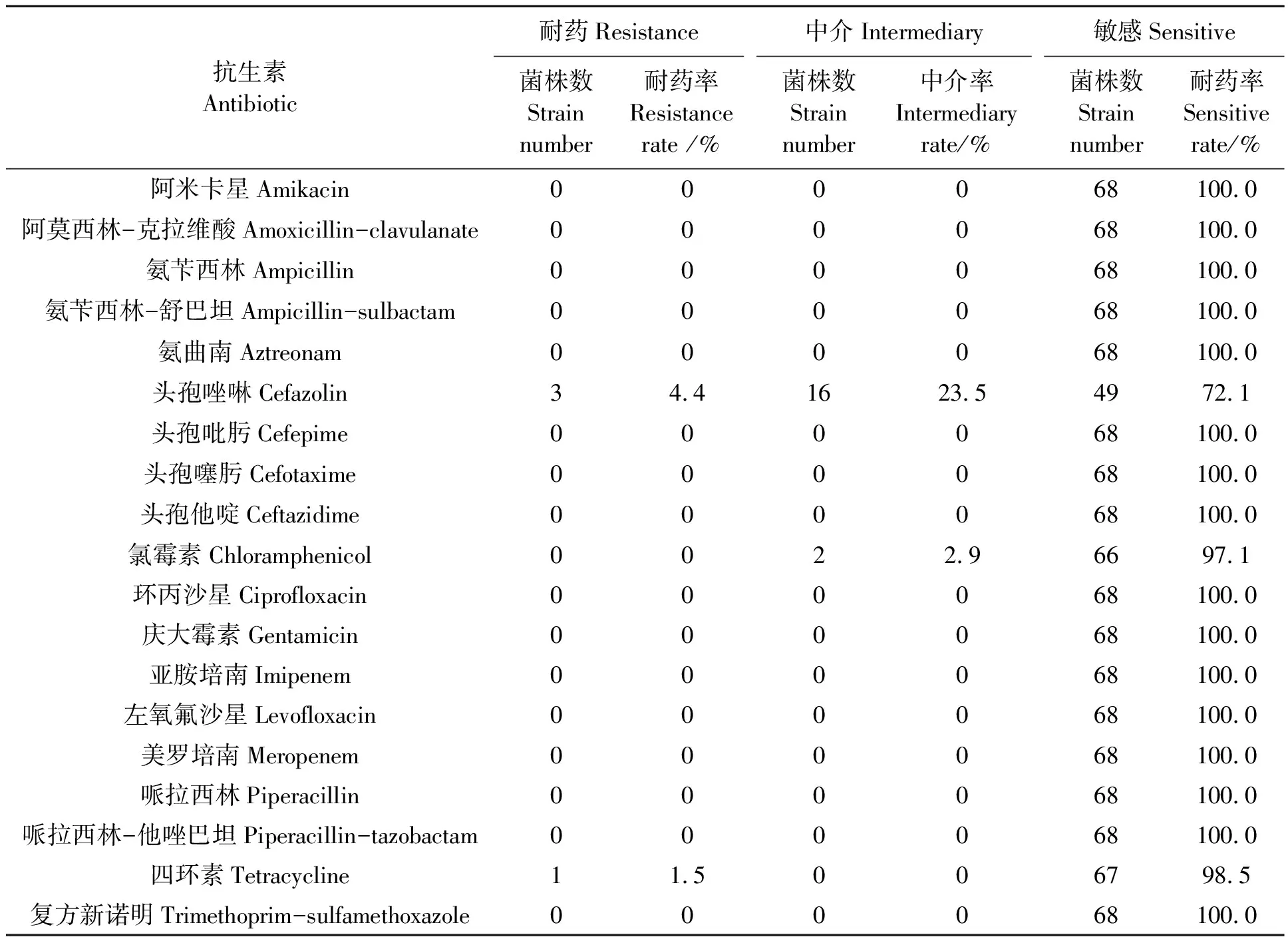
表1 68株阪崎克罗诺杆菌的抗生素敏感性
2.2 PFGE分型结果
图1显示,68株阪崎克罗诺杆菌共形成58个PFGE带型,相似度为20%~100%,分别命名为PT001~PT058型。带型总体较分散,没有明显的优势带型和聚集现象。相似度为100%的菌株被认为属于同一PFGE带型[15]。其中,PT037带型包含4株菌;PT050带型、PT054带型均包含3株菌;PT007带型、PT043带型、PT046带型均包含2株菌;其余带型各包含1株菌株。同一带型的菌株样品来源较集中,如PT037带型的4个菌株均分离自黑龙江A乳品厂的配方粉,PT050带型的3个菌株均分离自黑龙江B乳品厂的配方粉,PT054带型的3个菌株均分离自黑龙江C乳品厂的配方粉,说明配方粉受同一来源克隆株污染的可能性较大。而分离自北京配方粉的菌株BQ02和分离自黑龙江配方粉的BQ26表现出相同的带型PT043,提示乳粉生产过程中可能存在特定型别的菌株。

图1 68株阪崎克罗诺杆菌的PFGE聚类分析
3 讨论
克罗诺杆菌对婴幼儿和免疫力低下的人群具有严重的危害性,因此,对克罗诺杆菌耐药性进行检测具有重要意义。黄玉兰等[16]对婴幼儿食品和临床病例中分离的109株克罗诺杆菌的耐药性研究表明,婴幼儿乳粉中克罗诺杆菌的菌株分离数低于其他食品,虽然食源性克罗诺杆菌对磺胺类药物和氯霉素等的耐受性有逐年上升趋势,但食品中克罗诺杆菌多重耐药株检出较少。王倩宁等[17]对羊奶粉生产环节分离的克罗诺杆菌进行药物敏感性分析,发现29株克罗诺杆菌中的22株对甲氧苄啶/磺胺甲恶唑耐药,2株对头孢西丁耐药,1株对阿莫西林耐药,1株对阿莫西林/克拉维酸耐药,2株菌具有多重耐药现象。本研究的药敏结果显示,68株分离株对所测试19种抗生素中的16种敏感,仅对头孢唑啉和四环素耐药,耐药率分别为4.4%、1.5%,对头孢唑啉和氯霉素的中介率分别为23.5%和2.9%,未发现多重耐药菌株。相比于以上文献报道,本研究中的阪崎克罗诺杆菌分离株耐药性较低,可能与采样地域、样品种类有关。有研究认为,耐药基因在不同细菌间的传递,使原本对抗生素敏感的菌株产生“获得性”耐药[18]。因此,仍需加强克罗诺杆菌的耐药性监测。
PFGE分子分型方法辨识度高、稳定性好,被广泛运用于克罗诺杆菌的分子分型及溯源研究[19]。柴云雷等[20]对婴儿配方乳粉中的克罗诺杆菌分离株进行PFGE分子分型,将12株克罗诺杆菌分为11个带型;甘辛等[21]研究发现,我国19个地区婴儿配方粉来源的49株克罗诺杆菌图谱共形成38个带型;周蒂等[14]利用PFGE技术对配方奶粉加工过程分离的阪崎克罗诺杆菌进行分型,发现46株阪崎克罗诺杆菌共形成29种PFGE基因指纹图谱,说明乳粉来源的菌株呈现出较高的基因多态性和离散性。本研究中,68株阪崎克罗诺杆菌共分为58个PFGE带型,PFGE型别较分散,与上述文献报道结果相似。
将PFGE分型结果与药敏结果结合分析发现,同一PFGE带型的菌株BQ55和BQ56均对头孢唑啉中介,PT054带型中的2个菌株BQ64和BQ65均对头孢唑啉中介,但与它们同型别的菌株BQ63对所有测试的抗生素均敏感,菌株BQ35和BQ36同属于PT007带型,但它们的耐药情况却不同。说明本研究中克罗诺杆菌的耐药性与其PFGE带型的关联性不大,此结果与许龙岩等[22]的研究一致。
本文研究了PFGE带型与菌株耐药性之间的相关性,但并未发现明显的关联性。一方面是由于我国克罗诺杆菌食品分离株具有高度多态性[21],另一方面与肠杆菌科其他属病原菌相比,克罗诺杆菌属菌株对常用抗生素较为敏感[16]。未来需分析更多的菌株,并结合耐药基因检测等其他手段来探究耐药菌株间的联系。
