miR-19a通过Fas基因调节胃癌细胞增殖水平的实验研究
2020-03-14翁国武周真真
翁国武周真真
海南省第三人民医院(三亚中心医院)消化科(海南三亚572000)
胃癌是我国最常见的消化道恶性肿瘤之一,发病率逐年升高且发病人群呈年轻化趋势[1-2]。由于早期胃癌的症状隐匿、诊断难度大,多数胃癌患者确诊时已经为中晚期,治疗效果及预后情况均较差。尽管近年来外科手术技术不断进步、新的化疗药物及靶向药物也陆续问世和应用,但胃癌患者的治疗效果仍不理想,治疗过程中肿瘤的复发和转移会直接影响预后。因此,越来越多的学者致力于探究胃癌发病的分子机制并寻找靶向治疗胃癌的新手段。
微小RNA(microRNA,miR)是一种在转录后水平抑制基因表达的非编码小分子RNA,多种miR 被证实在恶性肿瘤发生发展的过程中存在低表达或高表达[3-5]。在胃癌的发生发展过程中,也有多种miR的表达发生改变[6-8];其中miR-19a在胃癌病灶及胃癌患者外周血中均呈高表达的趋势[9-11]且抑癌基因自杀相关因子(factor associated suicide,Fas)的mRNA 序列中存在miR-19a的结合位点,从生物信息学角度推测miR-19a 能够靶向抑制Fas的表达并起到促癌活性,但miR-19a在胃癌中的具体生物学作用仍未见明确报道。因此,为了阐明miR-19a在胃癌发生发展所发挥的作用及发挥作用的机制,本实验具体分析了miR-19a通过Fas 基因调节胃癌细胞增殖水平的作用,进而能够为深入认识胃癌发病机制、探寻胃癌新的治疗靶点提供依据。
1 材料与方法
1.1 材料胃癌SGC-7901细胞株购自中科院上海细胞资源中心。雄性BALB/c 小鼠购自菲诺克生物科技(上海)有限公司,体质量20~25 g、4~6周龄,许可证号:SCXK(沪)2018-0005。
miR-19a 模拟物、阴性对照(NC)模拟物、Fas的siRNA、NC的siRNA 购自上海吉玛公司,储存液浓度为20 mmol/L;过表达Fas 基因的pcDNA3.1 质粒购自上海生工公司,储存液浓度为2.5 mg/mL;双荧光素酶报告基因购自Promega公司;细胞增殖活力的MTS细胞活力检测试剂盒购自Promega公司,细胞凋亡的TUNEL检测试剂盒购自上海碧云天公司,miRNA 提取试剂盒、miRNA cDNA 第一链合成试剂盒、miRNA 荧光定量PCR检测试剂盒购自北京康为世纪公司,Fas 单克隆一抗购自Abcam公司。细胞培养箱、高速离心机购自Thermo公司,荧光定量PCR 仪购自ABI公司,正置显微镜购自Nikon公司,化学显影仪购自Bio-rad公司。
1.2 细胞培养、分组及干预SGC-7901细胞株用含有10%胎牛血清的DMEM 贴壁培养,铺满培养板底面90%后用0.25%的胰蛋白酶进行消化传代,传代后的细胞接种在培养板内并分组干预。NC组用不含药物的DMEM 处理,NC 模拟物组转染NC 模 拟 物,miR-19a 组 转 染miR-19a的模 拟 物,siRNA-NC 组转染NC的siRNA,siRNA-Fas 组转染Fas的siRNA,NC 质粒组转染空白的pcDNA3.1 质粒,NC 质 粒+miR-19a 模 拟 物 空 白的pcDNA3.1 质粒及miR-19a的模拟物,Fas 质粒+miR-19a 模拟物组转染过表达Fas 基因的pcDNA3.1 质粒及miR-19a的模拟物,连续干预24 h。
1.3 移植瘤小鼠模型建立及干预取消化后的SGC-7901细胞,调整至细胞密度为5 × 107个/mL的细胞悬液,取200 μL细胞悬液接种至小鼠右侧腋下的皮下,1周后肿瘤生长至0.5 cm3后认为胃癌移植瘤小鼠造模成功,共15只小鼠、造模成功率100%。造模成功后,小鼠随机分为NC 组、NC 模拟物组、miR-19a 模拟物组,每组各5只,从造模成功当天开始干预,3 组小鼠分别沿着肿瘤周围不同部位注射200 μL的生理盐水、NC 模拟物、miR-19a 模拟物,每3 天注射1次、共注射7次,末次注射后3 d处死小鼠,解剖得到移植瘤并称重,而后将移植瘤放置在液氮中保存。
1.4 miR-19a表达量检测取分组干预24 h后的SGC-7901细胞,用miRNA 提取试剂盒分离细胞中的miRNA,用miRNA cDNA 第一链合成试剂盒将miRNA 反转录为cDNA,用miRNA 荧光定量PCR检测试剂盒对cDNA 中的miR-19a及U6进行扩增,扩增条件为95℃预变性3 min后95℃5 s、60℃15 s 重复40个循环,自动生成循环曲线及阈值后、以U6为内参、计算miR-19a的表达量。
1.5 细胞增殖活力检测取分组干预24 h后的SGC-7901细胞,将MTS 试剂盒中的检测液20 μL加入培养基中,继续培养4 h后取出培养板,放置在酶标仪上检测490 nm波长处的吸光值、为OD490值。
1.6 细胞凋亡率检测取分组干预24 h后的SGC-7901细胞,4%多聚甲醛固定0.5 h后立即用TUNEL 试剂盒(绿色荧光法)进行染色并在显微镜下观察TUNEL 阳性染色及DAPI 阳性染色的细胞数,计算细胞凋亡率。
1.7 Fas蛋白表达量检测取分组干预24 h后的SGC-7901细胞及液氮冷冻的移植瘤,用RIPA 裂解液裂解细胞、提取蛋白,用BCA 试剂盒测定蛋白含量后取30 μg蛋白进行免疫印迹实验。将蛋白样本加入SDS-PAGE 中,电泳、电转膜后将NC 膜放入5%脱脂牛奶中、室温孵育1 h,而后将NC 膜放入1∶1 000 稀释的Fas 一抗或1∶5 000 稀释的β-actin一抗中、4℃孵育过夜;次日,将NC 膜放入1∶2 000稀释的二抗中、室温孵育1 h,最后加入ECL 显影液、在化学显影仪中曝光得到蛋白条带,根据条带的灰度值、以β-actin为内参计算蛋白表达量。
1.8 双荧光素酶报告基因检测构建包含FAS 基因mRNA 3′UTR的双荧光素酶报告基因,将双荧光素酶报告基因与NC 模拟物或miR-33b 模拟物共同转染进入细胞,24 h后用0.25%胰蛋白酶消化细胞并离心,得到细胞沉淀后采用双荧光素酶报告基因检测试剂盒测定萤火虫荧光值和海肾荧光值,以萤火虫荧光值/海肾荧光值计算荧光素酶报告基因的荧光活性。
1.9 统计学方法采用SPSS 23.0软件录入数据,3 组间计量资料的比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-19a对胃癌细胞增殖及凋亡的调节作用与NC 组、NC 模拟物组比较,miR-19a 模拟物组细胞中miR-19a的表达量、细胞增殖活力OD490值均明显增加,细胞凋亡率明显降低(P<0.05)。见图1。

图1 转染miR-19a 模拟物后的miR-19a表达量、增殖活力及凋亡率Fig.1 miR-19a expression,proliferation viability and apoptosis rate after the transfection of miR-19a mimic
2.2 miR-19a对胃癌细胞中Fas 基因的靶向调节作用经TargetScan进行生物信息学分析,Fas 基因mRNA的3′UTR 上含有miR-19a的结合位点。与NC 模拟物组、NC 组比较,miR-19a 模拟物组细胞中Fas的蛋白表达量、荧光素酶报告基因的荧光值均均明显减少(P<0.05)。见图2。
2.3 沉默Fas 基因对胃癌细胞增殖及凋亡的调节作用与siRNA-NC 组、NC 组比较,siRNA-Fas 组细胞中Fas的蛋白表达量、细胞增殖活力OD490值均明显增加,细胞凋亡率明显降低(P<0.05)。见图3。
2.4 过表达Fas 基因对miR-19a 调控胃癌细胞增殖及凋亡的影响与NC 质粒组比较,NC 质粒+miR-19a 模拟物组的细胞增殖活力OD490值均明显增加,Fas的蛋白表达量、细胞凋亡率明显降低(P<0.05);与NC质粒+miR-19a模拟物组比较,Fas质粒组+miR-19a 模拟物的细胞增殖活力OD490值均明显降低,细胞凋亡率明显增加(P<0.05)。见图4。
2.5 miR-19a对胃癌移植瘤生长及Fas 基因表达的影响与NC 模拟物组、NC 组比较,miR-19a 模拟物组的移植瘤质量明显增加,移植瘤中Fas的蛋白表达量均明显减少(P<0.05)。见图5。
3 讨论
癌细胞过度增殖是与胃癌发生及治疗过程中复发、转移密切相关的生物学环节,分析胃癌细胞增殖的调控方式有助于阐明胃癌发生的机制、也能够为探寻新的靶向治疗手段提供依据。近年来,多种miR在恶性肿瘤发生发展中的作用均受到关注,miR-19a是一种具有促癌作用的miR,在肝癌、乳腺癌、膀胱癌、肺癌、结肠癌、肾癌、骨肉瘤等多种恶性肿瘤中均被证实能促进癌细胞的增殖[12-18]。胃癌相关的临床研究证实,胃癌病灶及胃癌患者外周血中miR-19a 均呈显著高表达的趋势[6-8],提示miR-19a可能参与了胃癌的发生发展。基于此,本实验以胃癌SGC-7901细胞为对象、通过分析miR-19a对癌细胞增殖的调控作用及机制来阐明miR-19a在胃癌发生发展中所起的作用。
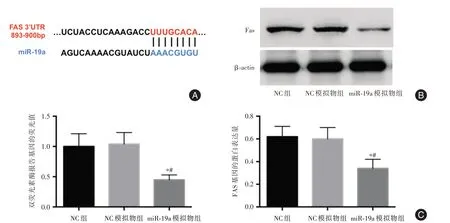
图2 转染miR-19a 模拟物后Fas 基因的表达量Fig.2 Fas gene expression after the transfection of miR-19a mimic

图3 转染Fas siRNA后的Fas表达量、增殖活力及凋亡率Fig.3 Fas gene expression,proliferation viability and apoptosis rate after the transfection of Fas siRNA
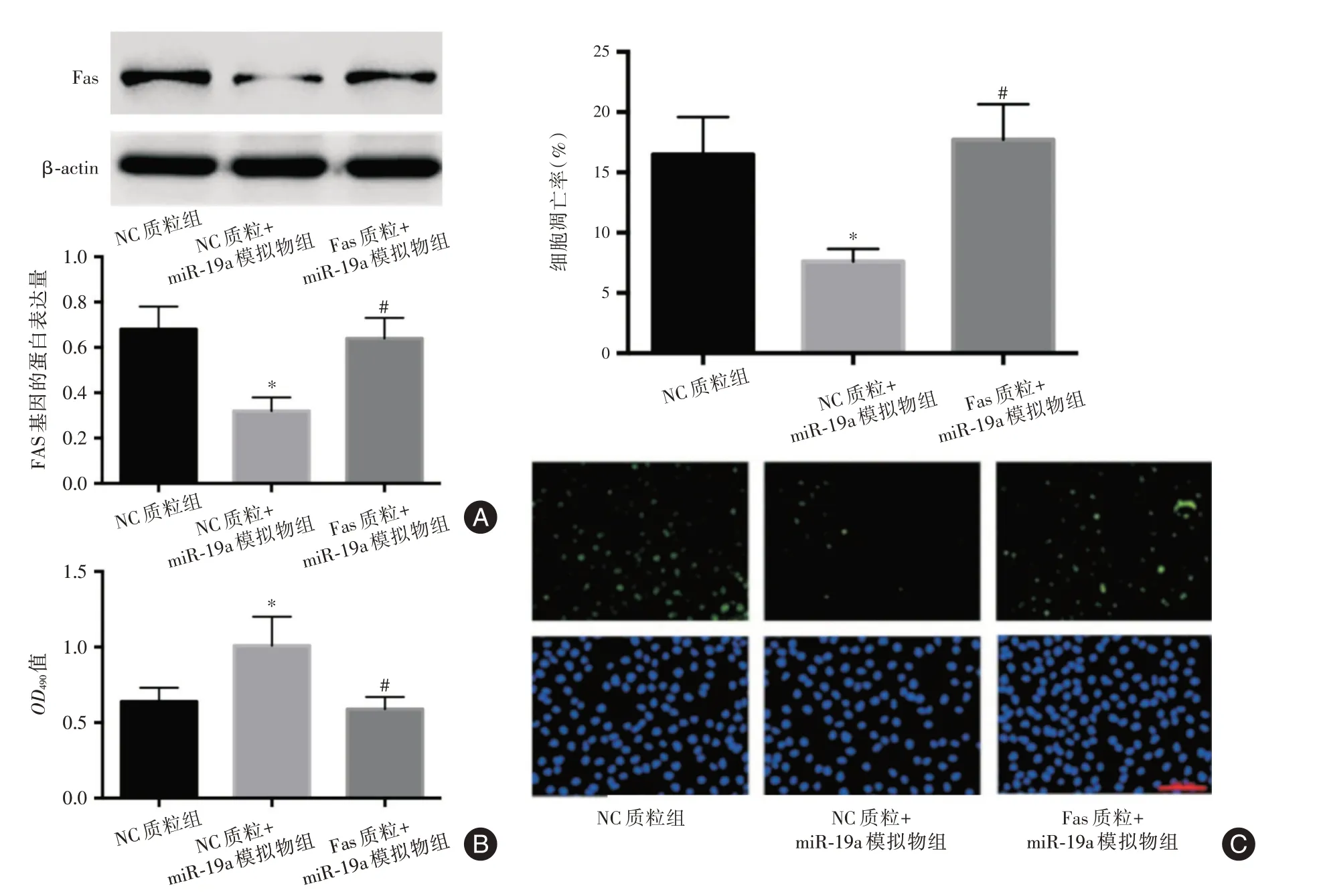
图4 转染Fas 质粒后miR-19a对细胞增殖及凋亡的影响Fig.4 Effect of miR-19a on proliferation viability and apoptosis rate after the transfection of Fas plasmid

图5 miR-19a对胃癌移植瘤生长及Fas 基因表达的影响Fig.5 Effect of miR-19a on gastric cancer transplanted tumors growth and Fas gene expression
在本实验中,转染miR-19a的模拟物后,SGC-7901细胞中miR-19a的表达明显增加;在增加miR-19a的表达后,分别通过MTS 法和TUNEL 法测定了细胞的增殖和凋亡,SGC-7901细胞的增殖活力明显增强、而凋亡明显受到抑制,说明miR-19a 能够促进胃癌细胞增殖且抑制细胞凋亡的发生可能是其发挥促增殖作用的机制之一。MiR 具体的生物学作用是与靶基因mRNA的3′UTR 结合并抑制靶基因的表达,本实验通过targetscan进行生物信息学分析发现,促凋亡基因Fas的3′UTR 上含有miR-19a的结合靶点;在转染miR-19a的模拟物、增加miR-19a的表达后,细胞中Fas 基因的蛋白表达明显减少、含有Fas 基因3′UTR的双荧光素酶报告基因的荧光值明显下降。以上结果说明miR-19a能够在SGC-7901细胞中靶向结合Fas 基因mRNA的3′UTR、抑制Fas 基因的表达,这也可能是miR-19a 促进胃癌细胞增殖、抑制胃癌细胞凋亡的分子机制。
Fas 基因的编码产物是FasL的受体,能够在细胞内招募FADD 并介导死亡受体途径的细胞凋亡[19-22]。有临床研究报道,在胃癌的发生发展中,Fas 基因的表达明显下调[23];也有基础实验研究表明,抑制Fas的表达能够阻碍胃癌细胞的凋亡[24-25]。本实验已经证实miR-19a 能够靶向抑制Fas 基因的表达,在此基础上通过转染Fas 基因的siRNA 来抑制Fas 基因表达、验证胃癌细胞中Fas 基因表达下调后的生物学效应。在转染Fas的siRNA后,细胞中Fas的表达明显减少、细胞凋亡率明显下降,而细胞的增殖活力明显增强,与既往其他研究[24-25]关于Fas 调控胃癌细胞凋亡及增殖的结果吻合,说明Fas 基因参与胃癌细胞增殖及凋亡的调控,miR-19a通过抑制Fas 基因的表达能够削弱Fas 介导的促凋亡效应、进而发挥抑制凋亡及促进增殖的作用。在此基础上,本实验还转染了过表达Fas 基因的质粒来验证Fas 低表达在miR-19a 发挥生物学效应中的作用,增加Fas 基因的表达后、miR-19a 增加增殖活力及降低凋亡率的效应均明显被削弱,由此进一步验证了miR-19a 能够通过抑制Fas 基因的表达来促进胃癌细胞增殖、抑制胃癌细胞凋亡。
本实验在上述细胞学实验的基础上,还通过移植瘤小鼠来验证miR-19a的促癌作用。经皮下注射SGC-7901细胞的方式建立了胃癌移植瘤小鼠模型,在瘤周注射miR-19a的模拟物后观察肿瘤生长及靶基因Fas的表达发现:miR-19a的模拟物能够使移植瘤的质量增加、同时也使移植瘤中Fas基因的表达减少,这一结果与miR-19a在离体SGC-7901细胞中促进增殖、抑制凋亡、减少Fas 基因表达的作用吻合,说明miR-19a 能够促进胃癌的生长。
综上所述,本研究首次阐明了miR-19a对胃癌细胞的增殖具有促进作用,靶向抑制Fas 基因介导的细胞凋亡是miR-19a 发挥促增殖作用的分子机制之一,这也是本研究的创新之处,基于此,未来miR-19a可能可以作为治疗胃癌的靶点。本研究的局限及不足之处是未能对胃癌中miR-19a表达的上游调控机制进行探究,在未来的研究中,可以进一步通过染色质免疫共沉淀的方式来筛选与miR-19a 基因转录本上游结合的转录因子,进而研究不同转录因子对胃癌中miR-19a表达的调控作用。
