组蛋白赖氨酸去甲基化酶4C对卵巢癌SKOV3细胞恶性生物学行为的影响
2020-03-14柏效治原翔刘怡文孔金玉孙蔚李燕乐谢小娟
柏效治 原翔 刘怡文 孔金玉 孙蔚 李燕乐 谢小娟
1河南科技大学临床医学院(河南洛阳471003);2 河南科技大学第一附属医院新正医院麻醉科;3 河南科技大学肿瘤研究所,河南省肿瘤表现遗传重点实验室(河南洛阳471003)
卵巢癌是仅次于子宫内膜癌的第二大妇科肿瘤,病死率位居妇科恶性肿瘤首位[1]。早期不易诊断且易发生扩散和转移是造成卵巢癌高病死率的主要原因[2]。目前,由于缺乏更为理想的治疗方法,使得卵巢癌治疗预后较差,5年生存率低[3]。靶向治疗是近年来肿瘤治疗研究的热点,寻找新的抗肿瘤靶点,是卵巢癌治疗的重要研究方向[4]。研究发现,组蛋白赖氨酸去甲基化酶4C(recombinant lysine specific demethylase 4C,KDM4C)与肿瘤的发生、发展密切相关[5-6]。有文献[7-11]报道,KDM4C在食管癌、乳腺癌、肺癌、皮肤癌及前列腺癌等多种肿瘤中均有异常高表达,并且与肿瘤的增殖、转移等恶性生物学行为密切相关,但其在卵巢癌中未见有相关报道。本研究建立KDM4C 下调的稳定卵巢癌SKOV3细胞系;采用细胞功能实验及裸鼠皮下荷瘤实验检测KDM4C对卵巢癌SKOV3细胞体外及体内恶性生物学行为的影响,为卵巢癌的靶向治疗提供新的靶点和思路。
1 材料与方法
1.1 主要试剂与仪器卵巢癌细胞系SKOV3(中国科学院上海细胞库);DMEM 培养基(美国,Gibco公司);胎牛血清(FBS)、胰蛋白酶、青链霉素(美国,Gibco公司);慢病毒包装试剂盒(GeneCopeia公司);CCK8 试剂盒(美国GLPBIO);Transwell 小室(康宁);光学显微镜(尼康);BCA蛋白定量试剂盒(康为),BSA蛋白标准品(康为);KDM4C 兔单克隆抗体(Abcam),内参GAPDH 抗体(康为),山羊抗兔多克隆抗体(康为);Matrigel 胶(BD,USA);eECL 发光显影试剂盒(美国Invitrogen公司),凝胶成像系统(美国BIO-RAD公司)。
1.2 细胞系的培养细胞培养:用含有10%FBS,1%青链霉素的DMEM 培养基培养SKOV3细胞,将细胞放置于37℃,5%CO2的恒温培养箱中;每1~3 d细胞换液,待细胞生长至80%~90%时传代,取对数生长期细胞做下一步实验。
1.3 慢病毒载体包装培养包装细胞:用含10%热灭活胎牛血清的DMEM 培养基培养293T细胞,细胞至细胞密度60%~70%时,开始转染。配制DNA-EndoFectin 混合物,室温放置30 min。将混合物加入293T细胞,转染操作后的12 h 去除含转染复合物的旧培养液,以新鲜培养液继续培养细胞。向培养基中加入1/500 体积的“Titer Boost”。48 h后收获病毒,将细胞上清至0.45 μm 滤器去除细胞碎片,取上清进行感染。将SKOV3细胞铺板,待密度长至50%~60%时,加入含病毒的培养基进行转染。转染病毒后,需在荧光显微镜下观察信号。待视野中大部分细胞都带有荧光时,用嘌呤霉素筛选培养2周。提取细胞蛋白质,通过Western Blot 方法检测KDM4C蛋白敲降效率。
1.4 Western Blot 方法检测KDM4C蛋白敲降效率取对数生长期的细胞,当细胞增殖至培养瓶80%~90%时,弃去培养皿中旧培养液,用PBS 清洗细胞,除去死细胞、细胞代谢产物及杂质;加入配置好的蛋白裂解液(RIPA:PMSF:蛋白酶抑制剂=5 000∶50∶1),刮匙刮下蛋白,冰上裂解1~2 h,期间间断吹打震荡。4℃,12 000 r/min 离心10~30 min。抽取上清,用BCA 法进行蛋白定量。将蛋白加入10%SDS-聚丙烯酰胺凝胶进行电泳,上层浓缩胶恒压90 V/30 min 电泳,下层分离胶胶恒压120 V/60 min 电泳,电泳后,在恒压80 V/150 min转膜,5% 脱脂奶粉封闭PVDF 膜1 h,TBST 洗膜3次,8次/min,加入KDM4C 兔一抗(1∶1 000)和内参GAPDH(1∶2 000)放于摇床60 r/min,4℃过夜,TBST 清洗3次,8次/min,加入兔二抗(1∶2 000)室温孵育2 h,再用TBST洗膜3次,8次/min,采用ECL检测目的蛋白条带,凝胶成像系统采集图像并进行定量分析。实验重复3次,进行统计学分析。
1.5 细胞功能学实验
1.5.1 CCK8实验取对数生长期细胞,用细胞计数板计数所制备的细胞悬液中的细胞数量。在96孔板中接种细胞悬液(100 μL/孔,1 000/2 000 两个浓度梯度)。将培养板放在培养箱中预培养一段时间(37℃,5%CO2)。待细胞贴壁后,每隔12 h 向每孔加入10 μL CCK-8 溶液,将培养板置于培养箱内孵育2 h。酶标仪测定吸光度。实验设计3个复孔取平均值,并重复3次。
1.5.2 平板克隆形成实验取对数生长期细胞,分别于6孔板中铺入500个细胞和1 000个细胞。当出现肉眼可见的克隆时终止培养,弃去培养基。洗涤、固定、结晶紫染色计数肉眼可见的克隆数,依照克隆形成率=(克隆数/接种细胞数)×100%计算,拍照留存。重复实验3次。
1.5.3 划痕实验用marker 笔在6孔板底部背面均匀划3条记号线,取对数生长期细胞,接种于6孔板中常规培养。待细胞融合至70%~80%,用200 μL 无菌中号枪头比着直尺用力划线,使划痕与记号线垂直。用无菌PBS 轻轻洗涤细胞3次,洗去划下的细胞。向6孔板中加入无血清培养基,于5%CO2,37℃恒温箱中常规培养。每隔3 h对同一位置细胞拍照。应用Image J软件测量不同时间点划痕内空白面积的大小,并用计算迁移面积,比较两组细胞不同时间点迁移面积的大小。重复实验3次。
1.5.4 Transwell实验用50 mg/L Matrigel 胶稀释液包被Transwell 小室基底膜。取对数生长期细胞,常规消化饥饿12~24 h,取含1×106个/mL的细胞悬液(无血清)100 μL,吹打均匀,加入Transwell 小室然后,向下室加含血清培养基继续培养550 μL。分别于16 h和24 h,擦去小室基底膜上层细胞,甲醛固定1~2 h,4 g/L 结晶紫染液,均选10个视野,于倒置相差显微镜下观察、计数并照相。实验重复3次,每次设置3个复孔取平均值。
1.6 裸鼠皮下荷瘤实验将12只5~6周龄健康雄性裸鼠(体质量约20 g)随机分为两组:实验分为SKOV3-GFP(对照组)组与SKOV3-K(KDM4C 敲降组)组,每组6只。每组6只,于超净工作台中饲养。常规细胞培养,胰酶消化细胞并计数,使用PBS 重悬细胞,配置成5 × 107/mL细胞悬液,于小鼠右侧腋下为进针点,酒精棉球擦拭,进针在至皮下,缓慢推注,一般体积为100 μL细胞悬液,注射完后拔出针头,注射位置能看到明显的鼓包,接种肿瘤细胞后,每天观察裸鼠生存状况及成瘤情况;肿瘤形成后,每天用游标卡尺测量肿瘤体积;待肿瘤长至直径为1.5~2.0 cm 时,颈椎脱臼处死裸鼠,取出肿瘤,拍照。重复实验3次。
1.7 统计学方法运用SPSS 23.0对数据进行统计学处理。Western Blot 方法检测KDM4C蛋白敲降效率、CCK8、平板克隆、划痕实验、Transwell及裸鼠皮下荷瘤实验结果均采用t检验,所有计量资料用均数±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 建立KDM4C 下调的稳定细胞系实验分为SKOV3-GFP(对照组)与SKOV3-K(KDM4C 敲降组),应用慢病毒包装试剂盒建立KDM4C蛋白敲降细胞系和GFP 荧光对照细胞系,并使用嘌呤霉素筛选稳定细胞系,共聚焦显微镜观察荧光效果(图1)。

图1 建立SKOV3-GFP(对照组)与SKOV3-K(KDM4C 敲降组)细胞系Fig.1 Skov3-gfp(control group)and Skov3-k(KDM4C knockdown group)cell lines were established
2.2 Western Blot 方法检测KDM4C蛋白敲降效率采用Western Blot 方法检测KDM4C蛋白敲降效率,结果显示,SKOV3-K(KDM4C 敲降组)组中KDM4C表达量(0.202 ± 0.058)显著低于SKOV3-GFP[对照组,(1.669±0.089),t=13.905,P<0.001,表1、图2],成功建立KDM4C下调的稳定细胞系。

图2 Western Blot 方法检测KDM4C蛋白敲降效率Fig.2 Western Blot method was used to detect the knockdown efficiency of KDM4C protein
表1 Western Blot 方法检测KDM4C蛋白敲降效率Tab.1 Western Blot examined the effect of KDM4C on the invasion ability of ovarian cancer cell lines±s

表1 Western Blot 方法检测KDM4C蛋白敲降效率Tab.1 Western Blot examined the effect of KDM4C on the invasion ability of ovarian cancer cell lines±s
注:*P <0.05
组别SKOV3-GFP SKOV3-K t 值P 值KDM4C表达量1.669±0.089 0.202±0.058* 13.905<0.001
2.3 CCK8检测KDM4C对卵巢癌细胞系增殖能力的影响采用CCK8检测KDM4C对卵巢癌细胞系增殖能力的影响,实验分为SKOV3-GFP(对照组)与SKOV3-K(KDM4C 敲降组),设定1 000个/孔和1 500个/孔两个浓度梯度。待细胞贴壁后,每隔12 h测定吸光度。测定加样量为1 000个细胞每孔的吸光度(t= 3.693,P= 0.014,图3A)和1 500个细胞每孔的吸光度(t= 2.781,P= 0.039,图3B),发现SKOV3-K(KDM4C 敲降组)细胞的增殖能力明显减弱。
2.4 平板克隆检测KDM4C对卵巢癌细胞系增殖及成瘤的影响采用平板克隆实验检测KDM4C对卵巢癌细胞系体外增殖和成瘤能力的影响,实验分为SKOV3-GFP(对照组)与SKOV3-K(KDM4C 敲降组)。设置两个细胞铺板密度,分别于6孔板中铺入1 000个细胞/孔和500个细胞/孔。当铺板密度为1 000个/孔时,与对照组(126.000±7.382)相比,KDM4C 敲降组(94.500 ± 6.850)细胞增殖及成瘤能力明显减弱(t=3.128,P=0.020,图4、表2);当铺板密度为500个/孔时,与对照组(72.000 ± 5.541)相比,KDM4C 敲降组(53.000 ± 3.479)细胞增殖及成瘤能力明显减弱(t= 2.904,P= 0.019,图4、表2)。

图3 CCK8检测KDM4C对卵巢癌细胞系增殖能力的影响Fig.3 CCK8 assay was used to determine the effect ofKDM4C on the proliferation ability of ovarian cancer cell lines
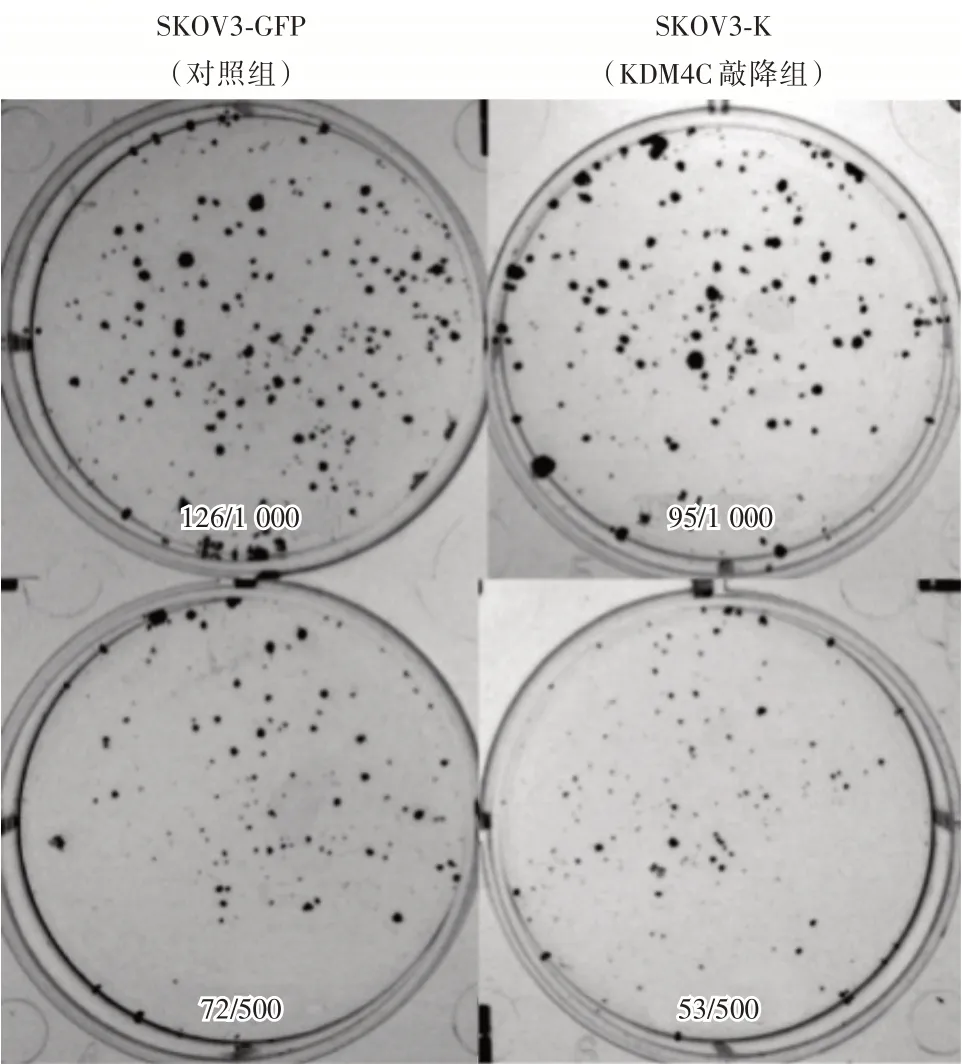
图4 平板克隆检测KDM4C对卵巢癌细胞系增殖能力的影响Fig.4 Effect of KDM4C on proliferation of ovarian cancer cell lines by plate cloning
2.5 划痕实验检测KDM4C对卵巢癌细胞系迁移能力的影响采用划痕实验检测KDM4C对卵巢癌细胞系迁移能力的影响,发现与SKOV3-GFP(对照组,10.720±2.549)相比,SKOV3-K(KDM4C敲降组,4.617 ± 0.939)细胞迁移能力明显减弱(t= 2.248,P=0.039,图5)。
表2 平板克隆检测KDM4C对卵巢癌细胞系增殖能力的影响Tab.2 Effect of KDM4C on proliferation of ovarian cancer cell lines by plate cloning±s

表2 平板克隆检测KDM4C对卵巢癌细胞系增殖能力的影响Tab.2 Effect of KDM4C on proliferation of ovarian cancer cell lines by plate cloning±s
注:*P <0.05
组别SKOV3-GFP SKOV3-K t 值P 值铺板1 000个细胞/孔的成瘤数126.000±7.382 94.500±6.850* 3.128 0.020铺板500个细胞/孔的成瘤数72.000±5.541 53.000±3.479* 2.904 0.019

图5 划痕实验检测KDM4C对卵巢癌细胞系迁移能力的影响Fig.5 Effect of KDM4C on migration ability of ovarian cancer cell lines was detected by Wound-healing
2.6 Transwell检测KDM4C对卵巢癌细胞系侵袭能力的影响采用Transwell实验检测KDM4C对卵巢癌细胞系侵袭能力的影响,实验分为SKOV3-GFP(对照组)与SKOV3-K(KDM4C敲降组),在16 h拍照,与对照组(58.750 ± 2.394)相比,KDM4C 敲降组(44.250 ± 1.436)细胞侵袭能力明显减弱(t=5.195,P=0.002,图6、表3);在24 h 拍照,与对照组(101.500 ± 4.839)相比,KDM4C 敲降组(67.250 ±3.172)细胞侵袭能力明显减弱(t= 5.919,P=0.001,图6、表3)。

图6 Transwell检测KDM4C对卵巢癌细胞系侵袭能力的影响Fig.6 Transwell assay examined the effect of KDM4C on the invasion ability of ovarian cancer cell lines
表3 Transwell检测KDM4C对卵巢癌细胞系侵袭能力的影响Tab.3 Transwell assay examined the effect of KDM4C on the invasion ability ofovarian cancer cell lines±s

表3 Transwell检测KDM4C对卵巢癌细胞系侵袭能力的影响Tab.3 Transwell assay examined the effect of KDM4C on the invasion ability ofovarian cancer cell lines±s
组别SKOV3-GFP SKOV3-K t值P值穿过基底膜细胞数(16 h)58.750±2.394 44.250±1.436 5.195 0.002穿过基底膜细胞数(24 h)101.500±4.839 67.250±3.172 5.919 0.001
2.7 KDM4C对裸鼠皮下成瘤能力的影响采用裸鼠皮下成瘤实验检测KDM4C对卵巢癌SKOV3细胞成瘤能力的影响,将12只5~6周龄的健康雄鼠随机分为SKOV3-GFP(对照组)组与SKOV3-K(KDM4C 敲降组)组,每组6只。通过定期对肿瘤体积的测量,观察到SKOV3-K(KDM4C 敲降组)组裸鼠肿瘤生长明显受到抑制,差异有统计学意义(t= 3.734,P= 0.007,图7A)。裸鼠处死取出腋下肿瘤后称重,KDM4C 敲降组肿瘤质量显著小于对照组,差异有统计学意义(t= 2.388,P= 0.038,图7B、表4)。

图7 KDM4C对卵巢癌SKOV3细胞系体内增殖和成瘤能力的影响Fig.7 effect of KDM4C on SKOV3 cell line proliferation and tumorigenic ability of ovarian cancer
表4 KDM4C对卵巢癌SKOV3细胞系体内成瘤能力的影响Tab.4 effect of KDM4C on SKOV3 cell line tumorigenic ability of ovarian cancer±s

表4 KDM4C对卵巢癌SKOV3细胞系体内成瘤能力的影响Tab.4 effect of KDM4C on SKOV3 cell line tumorigenic ability of ovarian cancer±s
组别SKOV3-GFP SKOV3-K t 值P 值肿瘤质量(g)1.023±0.202 0.508±0.077 2.388 0.038
3 讨论
卵巢癌是临床常见的一种妇科恶性肿瘤,其发病率和病死率连年增长[12]。虽然目前对于卵巢癌治疗有手术、化疗、放疗等手段,因其易出现转移,但治疗效果仍然欠佳[13]。因此,寻找与卵巢癌发生、发展及转移相关的分子靶点,以预测肿瘤的发生、发展、转移及预后情况,为靶向治疗提供可能的新靶点,具有极其重要的意义。
越来越多的证据表明基因组DNA和染色质组蛋白组分的共价修饰可能引起染色质构象的改变,这与癌症的发生和/或发展密切相关[14-16]。编码组蛋白修饰酶的各种基因发生了突变,在各种人类癌症中都能检测到异常的组蛋白修饰,进而调控下游靶基因的转录[17-18]。在这些修饰中,组蛋白甲基化在肿瘤发生调控中的功能重要性已被广泛研究[19-20]。KDM4C能够编码一种组蛋白去甲基化酶,对于维持胚胎干细胞的自我更新和分化潜能有至关重要的作用,在基因表达调控和异染色质形成中发挥重要作用[21-22]。甲基化沉默基因通过抑制DNA 甲基转移酶的重新表达已成为一种有效的抗癌策略。
李娜等[8]证实,抑制KDM4C蛋白的表达能抑制食管癌致瘤性、干细胞性,促进化疗的敏感性。UIMONEN 等[9]认为在鳞状细胞肺癌中,KDM4C的高表达能够预测肿瘤患者的预后较差。研究表明,KDM4C蛋白高表达可诱导正常乳腺上皮细胞MCF-10A 恶性转化和增殖,下调KDM4C的表达可抑制乳腺癌生长和转移[10]。BERRY 等在乳腺癌中证实KDM4C 高表达有助于乳腺癌细胞形成肿瘤,降低KDM4C表达可抑制KDM4C的成瘤能力。上述研究均指出KDM4C在多种肿瘤中均发挥着重要作用,但对其高表达与卵巢癌相关性的研究却鲜有报道。因此,本研究旨在探讨KDM4C表达量的变化对卵巢癌SKOV3 恶行生物学行为的影响。通过CCK8、平板克隆实验结果显示,KDM4C 下调后SKOV3细胞的增殖能力显著下降,表明抑制KDM4C表达可减弱卵巢癌SKOV3细胞体外增殖能力;划痕实验及Transwell 侵袭实验显示KDM4C下调后SKOV3细胞的迁移及侵袭能力显著下降,表明KDM4C 低表达可减弱SKOV3细胞体外迁移及侵袭能力能力。小鼠皮下成瘤实验结果表明KDM4C表达下调,可显著抑制SKOV3细胞在体内的增殖和成瘤能力,表明KDM4C对SKOV3细胞的体内成瘤能力具有至关重要的作用。
综上所述,KDM4C表达与卵巢癌SKOV3细胞恶性生物学行为密切相关。当抑制KDM4C表达时,卵巢癌细胞增殖、迁移、侵袭及成瘤方面恶性生物学行为显著减弱。因此抑制KDM4C可能成为卵巢癌靶向治疗潜在的一种新方法。
