基于NOD2信号通路探讨NADPH抑制剂对肾脏缺血再灌注损伤的影响
2020-03-14张晓林刘文丽李光远马芳夏田雨李迪张哲覃志成
张晓林 刘文丽 李光远 马芳 夏田雨 李迪 张哲 覃志成
030001 太原,山西医科大学第二医院肾内科(张晓林,夏田雨,李迪,张哲);831399 新疆,新疆五家渠人民医院肾内科(刘文丽,李光远,马芳);030012 太原,山西省人民医院肾内科(覃志成)
急性肾损伤(AKI)是以肾功能短期内急剧下降为特征的临床综合征,具有较高的发病率及死亡率[1]。肾脏缺血再灌注损伤(ischemia/reperfusion injury,IRI)是急性肾衰竭发生的重要病理生理基础[2]。而氧化应激作为肾脏IRI的关键致病机制之一,可导致肾脏实质细胞和间质细胞的空泡样变性、坏死及凋亡[3]。核苷酸寡聚化结构域蛋白(nucleotide-binding oligomerization domain-2,NOD2)受体是一类新型的胞浆内固有免疫模式识别受体,表达于人和鼠肾小管上皮细胞,在IRI发生时NOD2受体的激活可引起炎症因子及趋化因子的产生,导致AKI[4]。
本实验采用两种公认的NADPH氧化酶抑制剂4-羟基-3甲氧基苯乙酮(4-hydroxy-3-methoxyacetophenone,Apocynin)和氯化二碘联苯(diphenylene iodonium,DPI)对IRI模型大鼠进行预处理,观察是否可通过抑制氧化应激来介导肾小管上皮细胞NOD2信号通路的抑制,从而减轻IRI过程。现报道如下。
材料与方法
一、实验材料
选取健康雄性Wistar大鼠24只,由山西医科大学动物中心提供,质量为180~210 g之间,常规饲养,禁食12 h后用于实验。主要实验试剂:Apocynin及DPI(Sigma公司);兔抗大鼠NOD2(Boster公司),抗核因子-κB(nuclear factor-κB,NF-κB)(Bioss公司),抗半胱氨酸蛋白酶-1(caspase-1)(Boster公司),抗IL-1β(Bioss公司),抗GAPDH抗体(江苏凯基生物技术股份有限公司)。
二、实验方法
1.分组 取24只雄性Wistar大鼠,通过腹腔注射10%水合氯醛(剂量为0.3 mL/100 g)进行麻醉,分离肾蒂周围组织,暴露左肾动脉,结扎右肾蒂,切除右肾,并随机分为假手术组(Sham组)、肾脏缺血再灌注(ischemia/reperfusion,I/R)组、I/R+Apocynin组、I/R+DPI组,每组6只。其中,I/R+Apocynin组大鼠采用Apocynin以10mol/min的速度,连续10 min从左肾动脉注射,停药3 min后用无损伤微动脉夹夹闭大鼠左侧肾蒂,45 min后解除阻断,建立大鼠IRI模型;DPI组大鼠采用DPI以1mol/min的速度,连续10 min从左肾动脉注射,停药3 min后用无损伤微动脉夹夹闭大鼠左侧肾蒂,45 min后解除阻断;I/R组大鼠给予等体积生理盐水,停药3 min后用无损伤微动脉夹夹闭大鼠左侧肾蒂,45 min后解除阻断;Sham组给予等体积生理盐水,不予夹闭左肾动脉。各组大鼠于试验结束24 h后收集血及肾组织标本。
2.Western blot检测 采用Western blot检测NOD2、NF-κB蛋白、caspase-1表达,取液氮中保存的肾组织每组各取约90 mg加入适量蛋白裂解液匀浆,离心取上清液,采用BCA法测定蛋白浓度。每组取30 μg蛋白于SDS-PAGE凝胶电泳,转入NC膜;5%的脱脂奶粉封闭2 h后加入抗NOD-2及抗NF-κB(1∶2 000)、抗caspase-1(1∶2 000),4 ℃过夜;TBST洗膜,加入HRP标记的二抗(1∶20 000),室温下孵育l h;ECL化学发光法曝光。以GADPH为内参照,通过计算目标蛋白与GADPH的灰度比值进行半定量分析。
3.实时定量PCR法检测 采用实时定量PCR法检测NOD2 mRNA的表达。用Trizol试剂提取组织中总RNA。使用上海宝生物Takara反转录试剂盒将RNA反转录为cDNA。实时定量PCR采用SYBR Green Master Mix试剂盒进行,每管总反应体积25L,PCR温度循环设计:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min循环40次。待测样品mRNA相对表达量=2-ΔΔCt×100%,以GAPDH标化各mRNA拷贝数。
4.组织病理学检查 将大鼠肾组织切片3 μm厚,HE染色处理后,通过计数肾小管损伤面积的百分比,半定量评估肾小管间质损伤程度,评分标准根据肾小管上皮细胞变性、坏死、刷状缘脱落、管型形成及炎细胞浸润程度分为:0分(无损伤)、1分(≤10%)、2分(11%~25%)、3分(26%~45%)、4分(46%~75%)、5分(>76%)。每张切片至少选10个皮髓交界部视野观察。
5.免疫组织化学法检测 采用免疫组织化学法检测肾内炎性因子IL-1β的表达。使用SABC法,一抗为兔抗大鼠IL-1β单克隆抗体(1∶200)。用JD-801计算机图像分析系统分析各目的蛋白的半定量表达水平。每张切片上随机选取6个视野,以平均吸光度计算蛋白表达量。
三、统计学处理
结 果
一、各组大鼠肾组织NOD-2、NF-κB、caspase-1蛋白相对表达量比较
与Sham组相比,I/R组大鼠肾组织NOD2、NF-κB、caspase-1蛋白表达均增加,差异有统计学意义(P<0.05);而与I/R组相比,I/R+Apocynin组和I/R+DPI组NOD2、NF-κB、caspase-1蛋白表达均减少,差异有统计学意义(P<0.05)。(图1)
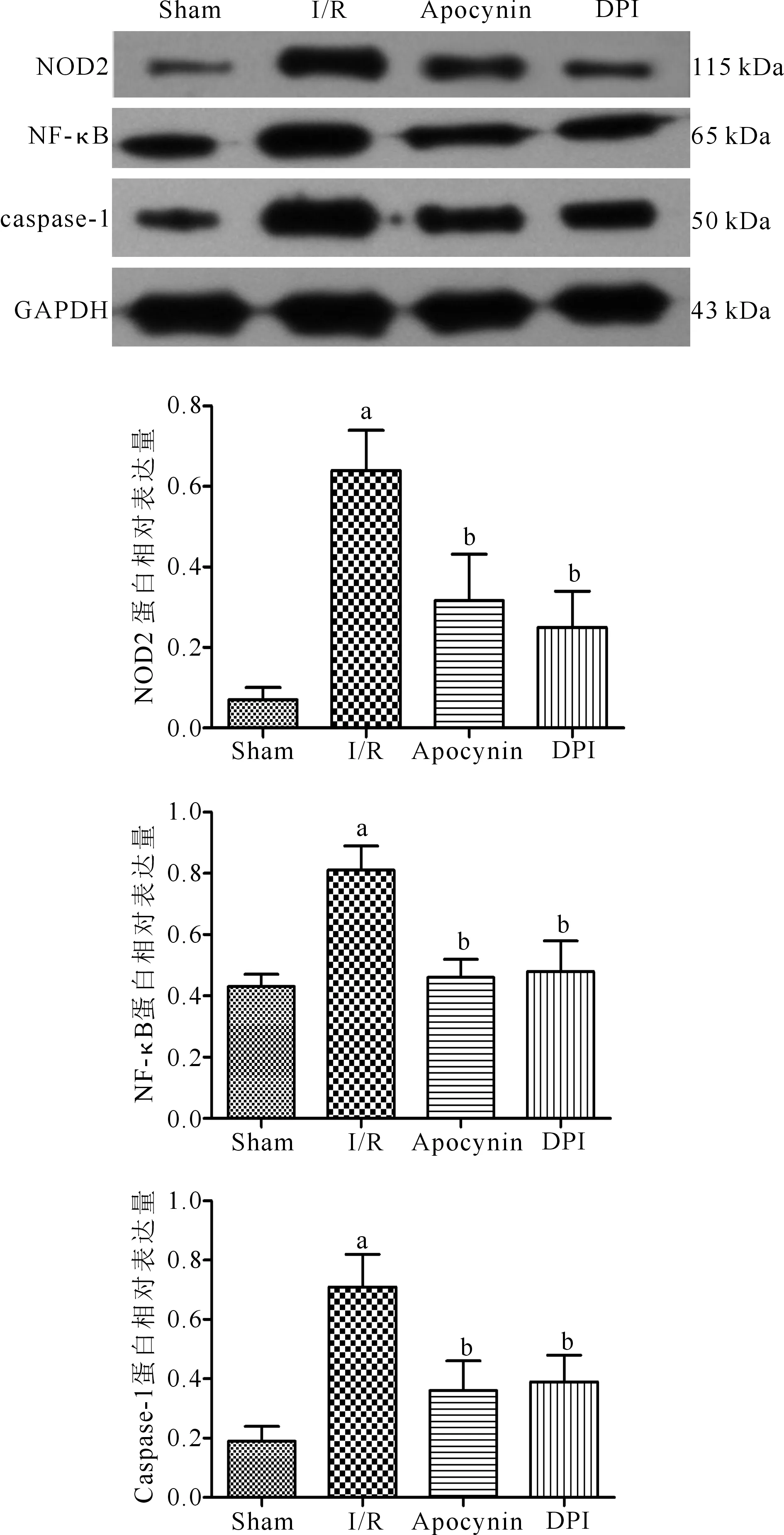
注:Sham为假手术组,I/R为肾脏缺血再灌注组,Apocynin为肾脏缺血再灌注+Apocynin处理组,DPI为肾脏缺血再灌注+DPI处理组;与sham组比较,aP<0.05;与I/R组比较,bP<0.05图1 各组大鼠肾组织NOD-1、NF-κB、caspase-1蛋白相对表达量比较
二、各组大鼠肾组织NOD2 mRNA相对表达量比较
与Sham组相比,I/R组大鼠肾组织NOD2 mRNA表达显著增加,差异有统计学意义(P<0.05);与I/R组相比,I/R+Apocynin组、I/R+DPI组的大鼠肾组织NOD2 mRNA表达均减少,差异均有统计学意义(P<0.05)。(图2)
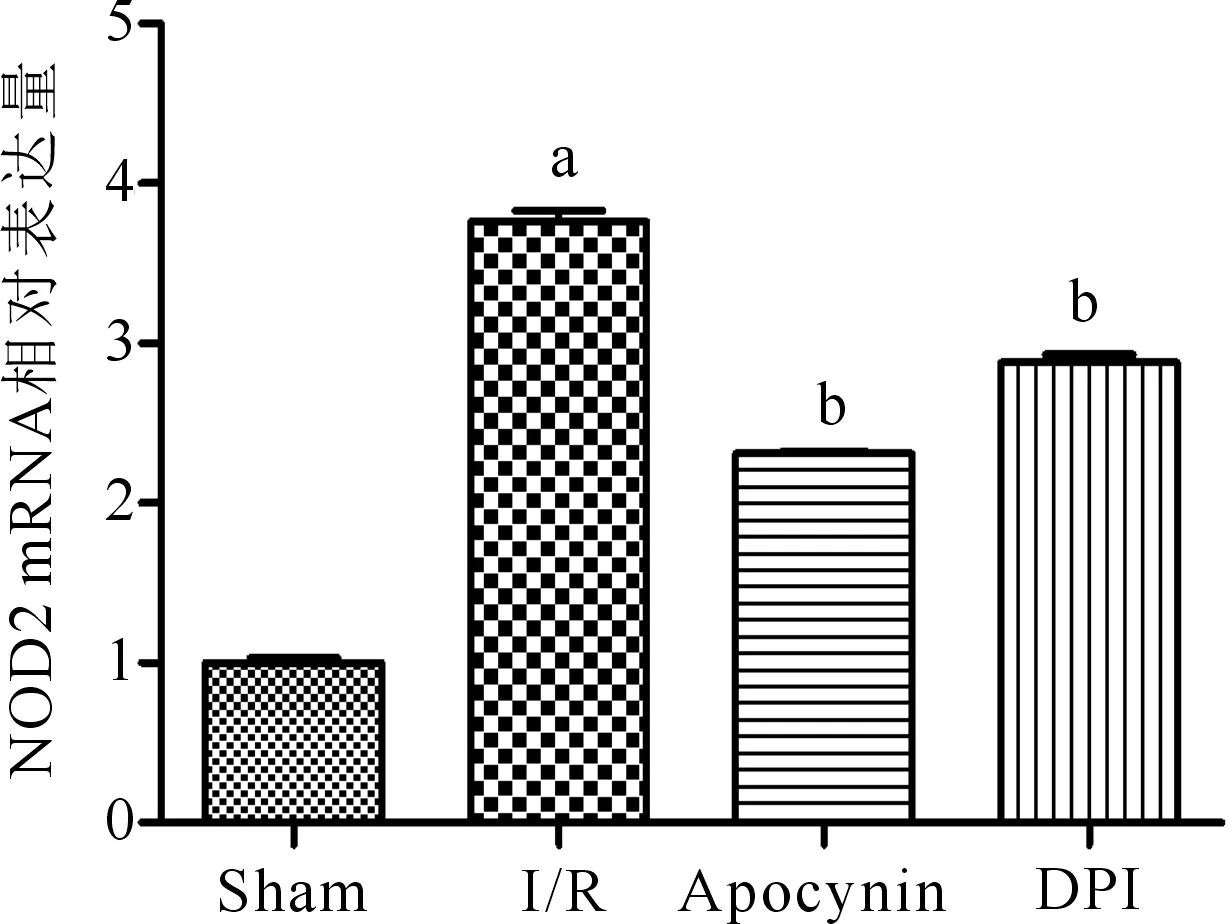
注:Sham为假手术组,I/R为肾脏缺血再灌注组,Apocynin为肾脏缺血再灌注+Apocynin处理组,DPI为肾脏缺血再灌注+DPI处理组;与sham组比较,aP<0.05;与I/R组比较,bP<0.05图2 各组大鼠肾组织NOD2 mRNA相对表达量比较
三、各组大鼠肾脏病理情况比较
与sham组比较,I/R组肾小管损伤程度评分较高(P<0.05),HE染色下显示肾小管上皮细胞水肿、坏死,脱落于管腔,肾小管管腔扩大,肾间质有炎性细胞浸润程度明显增大;与I/R组比较,I/R+Apocynin组、I/R+DPI组肾小管损伤程度评分较低(P<0.05),HE染色显示急性肾小管坏死程度减轻。(图3)
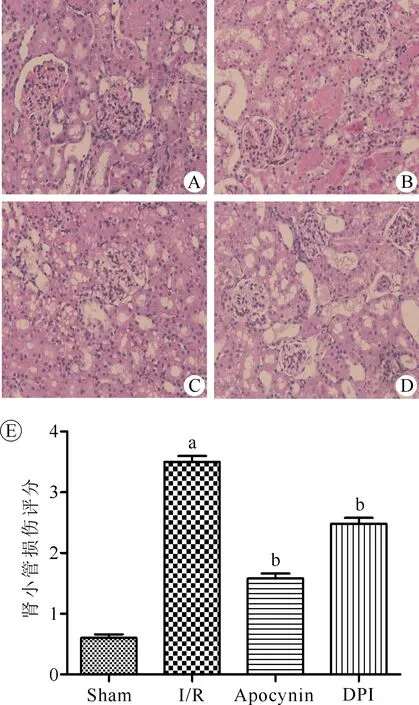
注:Sham为假手术组,I/R为肾脏缺血再灌注组,Apocynin为肾脏缺血再灌注+Apocynin处理组,DPI为肾脏缺血再灌注+DPI处理组;与sham组比较,aP<0.05;与I/R组比较,bP<0.05图3 各组大鼠肾脏病理情况比较(HE,×200) A.假手术组;B.I/R组;C.I/R+Apocynin组;D.I/R+DPI组;E.各组肾小管损伤评分
四、各组大鼠肾组织炎性因子IL-1β相对表达量比较
免疫组化结果显示,sham组肾组织IL-1β仅少量炎性因子IL-1β表达;与sham组相比,I/R组大鼠肾组织IL-1β表达明显增加(P<0.05);与I/R组相比,I/R+Apocynin组、I/R+DPI组IL-1β表达显著减少(P<0.05)。(图4)
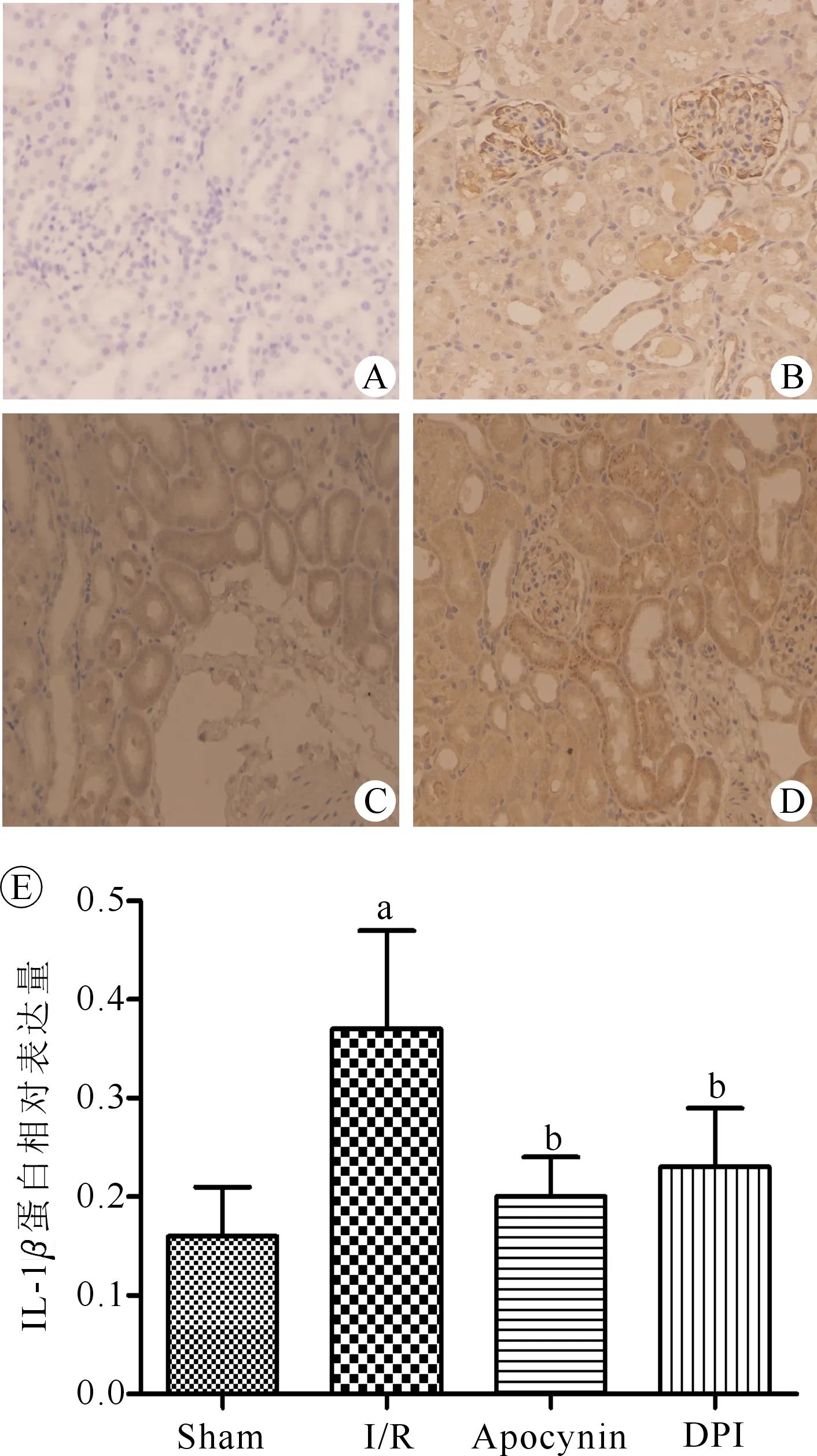
注:Sham为假手术组,I/R为肾脏缺血再灌注组,Apocynin为肾脏缺血再灌注+Apocynin处理组,DPI为肾脏缺血再灌注+DPI处理组;与sham组比较,aP<0.05;与I/R组比较,bP<0.05图4 各组大鼠肾组织IL-1β相对表达量比较 A.假手术组;B.I/R组;C.I/R+Apocynin组;D.I/R+DPI组;E.各组IL-1β蛋白表达量
讨 论
肾脏IRI是一种复杂的病理生理事件,是AKI最常见原因。在IRI中,氧化应激是诱导组织损伤的关键致病机制。正常情况下,细胞中氧化剂和抗氧化剂的产生之间处于平衡状态。当氧化剂产生增加,内源性抗氧化剂耗尽,可导致细胞损伤、蛋白质功能障碍、DNA及脂质的损害[5]。在IRI中,氧化应激直接产生活性氧(reactive oxygen species,ROS),当ROS产生超过机体抗氧化能力时,可氧化破坏生物分子和生物膜,诱导肾小管细胞损伤[6]。NADPH氧化酶(NOX)是产生ROS的重要来源,NOX催化电子从NADPH转移到分子氧,通过NOX催化亚基,产生ROS,参与机体生理和病理生理过程[7]。在几种IRI模型中使用ROS清除剂可导致组织损伤程度显著降低[8-9]。本课题组前期研究也证明,使用硫化氢抑制肾脏中NOX2、NOX4的活化,降低ROS产生,可以增加组织抗氧化能力,减轻脂质过氧化,从而降低肾脏氧化损伤[10]。
动物的先天免疫主要是通过模式识别受体(pattern recognition receptor,PRR)识别疾病相关分子模式(pathogen associated molecular pattern,PAMPs)实现的。PRR的代表为膜结合受体(例如Toll样受体)及胞质内受体(例如NOD样受体)。NOD样受体作为一类新型胞浆内的固有免疫模式识别受体,在自身免疫调节中起重要作用,它可识别细菌肽聚糖,活化NF-κB、caspase,诱导多种炎症因子及趋化因子的分泌,从而介导炎症反应[11]。NOD2在小鼠肾小管上皮细胞、系膜细胞和足细胞及人的肾小管上皮细胞、肾小球内皮细胞上都有表达[4,12]。有研究表明,在肾脏IRI中,肾小管上皮细胞NOD2受体表达增多,引起NF-κB、caspase-1活化,导致IL-1β等炎症因子的产生,从而诱导细胞死亡信号,加重肾脏的损伤[4]。
而本实验结果显示,在肾脏IRI模型大鼠中,检测到NOD2蛋白、NOD2 mRNA表达、NF-κB、caspase-1、炎症介质IL-1β表达均增高,肾组织损伤严重,说明在IRI时,可能通过激活NOD2信号通路,活化NF-κB,诱导炎症介质的产生,导致AKI。这与已有的研究结果相似[4]。有研究表明,NOX可作为IRI的治疗靶标,使用抗氧化剂可减轻肾脏IRI[13]。阻断特异性PRR(如TLR2、NOD1、NOD2)对缺血性肾小管上皮细胞损伤有非常显著的保护作用[14]。本实验结果显示,给予NOX抑制剂Apocynin和DPI处理后,大鼠NOD2、NF-κB、caspase-1、炎症介质IL-1β的表达较I/R组减少,肾小管病理损伤也明显减轻,说明抑制氧化应激可阻断NOD2样受体依赖的炎症途径,抑制NF-κB蛋白的产生,减少炎症介质的分泌,减轻IRI过程,这可以为肾脏IRI治疗提供新的理论依据。
