血硒对维持性血液透析患者左心室结构与功能的影响
2020-03-14张夏明徐刚鄢巨振高云洁吴平周宓
张夏明 徐刚 鄢巨振 高云洁 吴平 周宓
310015 杭州,杭州师范大学附属医院肾内科/杭州师范大学肾脏病研究所
近年研究证实,硒代谢异常与心血管疾病(cardiovascular disease,CVD)的发生与发展密切相关[1-2],低硒可通过引起三碘甲状腺原氨酸(triiodothyronine,T3)降低和炎症反应增强等环节导致慢性肾脏病(chronic kidney disease,CKD)患者左心室功能障碍,增加充血性心衰等心血管事件的发生率,其中非卧床连续性腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)和血液透析(hemodialysis,HD)患者更加严重[3-5]。然而,血硒对维持性血液透析(maintenance hemodialysis,MHD)患者左心室结构和功能影响的研究,迄今国内外却鲜见报道。本研究观察了MHD患者、非透析慢性肾衰竭(non-hemodialysis,NOHD)患者和健康对照者3组人群中血硒、氧化应激指标、甲状腺激素(thyroid hormone,TH)、甲状旁腺激素(parathyroid hormone,PTH)、C反应蛋白(c-reactive protein,CRP)含量和左心室形态与结构的变化,以及MHD患者血硒水平与氧化应激指标、TH、PTH、CRP、左心室形态与结构之间的关系,旨在探讨血硒水平变化对MHD患者左心室结构与功能的影响及其可能的机制。
资料与方法
一、研究对象
选取2016年5月至2018年2月在杭州师范大学附属医院血液净化中心进行血液透析的MHD患者,入选标准:确诊为慢性肾功能衰竭并进入MHD阶段,且透析时间≥3个月。共纳入患者40例,其中男21例,女19例,年龄33~88岁,平均年龄(63.2±15.0)岁;基础疾病为高血压肾小动脉硬化症5例,糖尿病肾病14例,慢性肾小球肾炎14例,IgA肾病1例,成人型多囊肾3例,痛风性肾病2例,病因不明1例。选取在本院肾内科住院的确诊为CKD且eGFR≤60 mL·min-1·(1.73 m2)-1的NOHD患者。共纳入患者40例,其中男25例,女15例,年龄20~89岁,平均(66.2±17.4)岁;基础疾病为高血压肾小动脉硬化症18例,糖尿病肾病15例,慢性肾小球肾炎1例,梗阻性肾病1例,成人型多囊肾1例,痛风性肾病2例,病因不明2例。另选取同一时期在本院健康体检者30例作为正常对照组,其中男12例,女18例,年龄38~80岁,平均(51.5±8.8岁)。本研究经本院伦理委员会批准[伦理审批文编号:2016(伦02)-KS-001],所有患者均签署知情同意书。
研究对象的排除标准:(1)近1个月内发生过心血管事件(如心律失常、心脏衰竭、心脏骤停等)者;(2)近1个月内发生过感染或传染性疾病者;(3)合并冠状动脉粥样硬化性心脏病、原发性心肌病等其他心血管疾病,甲状腺疾病、严重肝脏疾病、恶性肿瘤和自身免疫性疾病者;(4)肾脏移植后状态或近6个月内接受过免疫抑制剂治疗者;(5)理解力或合作能力欠佳者。
二、研究方法
1.透析方案 MHD患者采用Fresenius4008、Fresenius4008S和金宝AK95系列血液透析机,应用NIPRO FB-150透析器进行标准碳酸氢盐透析,透析液为含糖透析液,每周透析3次,每次4 h,血流量为250~300 mL/min,透析液流量为500 mL/min。
2.标本采集和保存 MHD患者于透析前静脉采血,NOHD患者及正常对照组患者于清晨空腹静脉采血。收集的标本离心后,分别留取血浆和(或)血清保存在-80℃专用冰箱中待检。其中血硒、氧化应激指标检测标本采用Baso2005-1型离心机以3 000 r/min的转速离心,TH检测标本以3 500 r/min的转速离心。
3.标本检测方法 血浆硒采用质谱法测定(美国PerkinElmer NexlON 2000),血清总T3(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)、游离T3(free triiodothyronine,FT3)、游离T4(free thyroxine,FT4)、促甲状腺激素(thyroid stimulating horm,TSH)采用放射免疫法测定(试剂盒购自美国雅培公司),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)采用生化比色法测定(试剂盒购自南京建成生物工程研究所);PTH采用化学发光法测定(试剂盒购自德国罗氏公司),CRP、血肌酐、尿素氮、白蛋白、总胆固醇、三酰甘油等生化指标采用全自动生化分析仪(日本OLYMPUS AU5831+ISE)检测。以上各检测均由专人负责操作。
4.超声心动图测定 应用Philips CX50彩色B超仪测定左心室内径(left ventricular diameter,LVD)、左心房内径(left atrial diameter,LAD)、左心室舒张末内径(left ventricular end-diastolic diameter,LVDd)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、室间隔厚度(interventricular septum thickness,IVST)、左心室射血分数(left ventricular ejection fraction,LVEF)等。按Devereux公式计算左心室质量指数(left ventricular mass index,LVMI);LVM=1.04×[(IVST+LVPWT+LVDd)3-LVDd3]-13.6;体表面积(body surface asea,BSA)的计算采用中国人适用的通用公式,BSA(m2)=0.0 061×身高(cm)+0.0 124×体质量(kg)-0.0 099;LVMI(g/m2)=LVM/BSA。按照超声多普勒标准,左心室肥厚(left ventricular hypertrophy,LVH)的诊断标准:LVMI(男)>125 g/m2,LVMI(女)>120 g/m2。EF<50%者提示左心室收缩功能下降,二尖瓣前向血流频谱舒张早期与心房收缩期左室充盈峰速度比值(E/A)<1则提示左心室舒张功能异常。
三、统计学处理

结 果
一、各组血硒水平的比较
MHD和NOHD患者血浆硒含量均明显低于正常对照者(均P<0.05)。(表1)
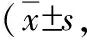
表1 MHD组、NOHD组和对照组患者血硒水平比较g/L)
注:与对照组比较,aP<0.05,bP<0.01
二、各组氧化应激指标及炎症指标比较
MHD和NOHD患者血清GSH-Px和SOD活性均明显低于正常对照者(P<0.01),MDA含量均明显高于正常对照者(P<0.01)。MHD患者血清CRP含量明显高于正常对照者和NOHD者(P<0.01)。(表2)
三、各组甲状腺功能指标的比较
MHD和NOHD患者血清TT3和FT3含量均明显低于正常对照者(P<0.01)。MHD和NOHD患者血清PTH含量明显高于正常对照者(P<0.01和<0.05)。(表3)
四、各组心脏结构指标的比较
MHD组患者LAD、LVDd和LVMI均明显高于正常对照者(P<0.01)(表4)。MHD组患者和正常对照者间LVEF无显著性差异(P>0.05),MHD组患者E/A比值均<1,正常对照者中50%的E/A比值<1。
五、MHD组患者血硒与其他临床指标的相关分析
血硒与GSH-Px、SOD、TT3、FT3呈正相关(P<0.05),与MDA(P=0.056)和CRP(P<0.01)呈负相关。(表5)
六、血硒等临床指标与心脏指标的相关分析
血硒与LAD、LVDd呈负相关(P<0.05);GSH-Px、TT3、FT3与LAD、LVDd、IVST、LVMI均呈负相关(P<0.05);SOD与LAD、IVST、LVMI呈负相关(P<0.05);MDA、PTH、CRP与LAD、LVDd、IVST、LVMI均呈正相关(P<0.05)。(表6)
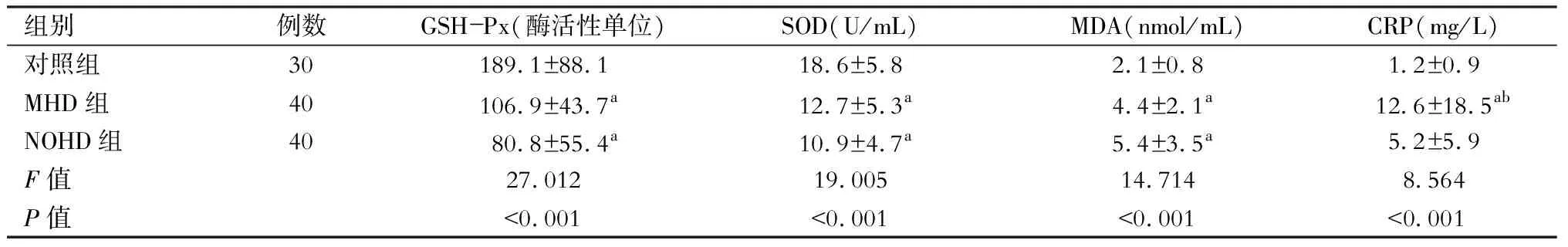
表2 MHD组、NOHD组和对照组患者血清氧化应激指标及炎症指标的比较
注:与对照组比较,aP<0.01;与NOHD组比较,bP<0.01
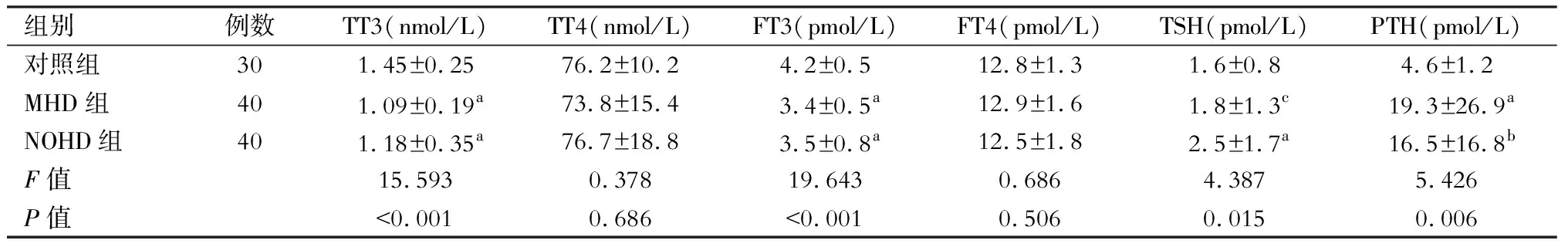
表3 MHD组、NOHD组和对照组患者甲状腺功能指标比较
注:与对照组比较,aP<0.01,bP<0.05;与NOHD组比较,cP<0.05
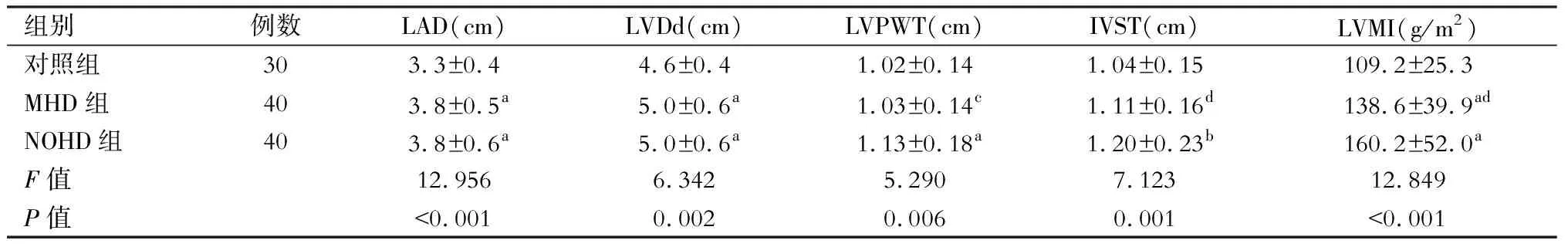
表4 MHD组、NOHD组和对照组患者心脏结构指标比较
注:与对照组比较,aP<0.01,bP<0.05;与NOHD组比较,cP<0.01,dP<0.05

表5 MHD患者血硒与其他临床指标间的相关性分析
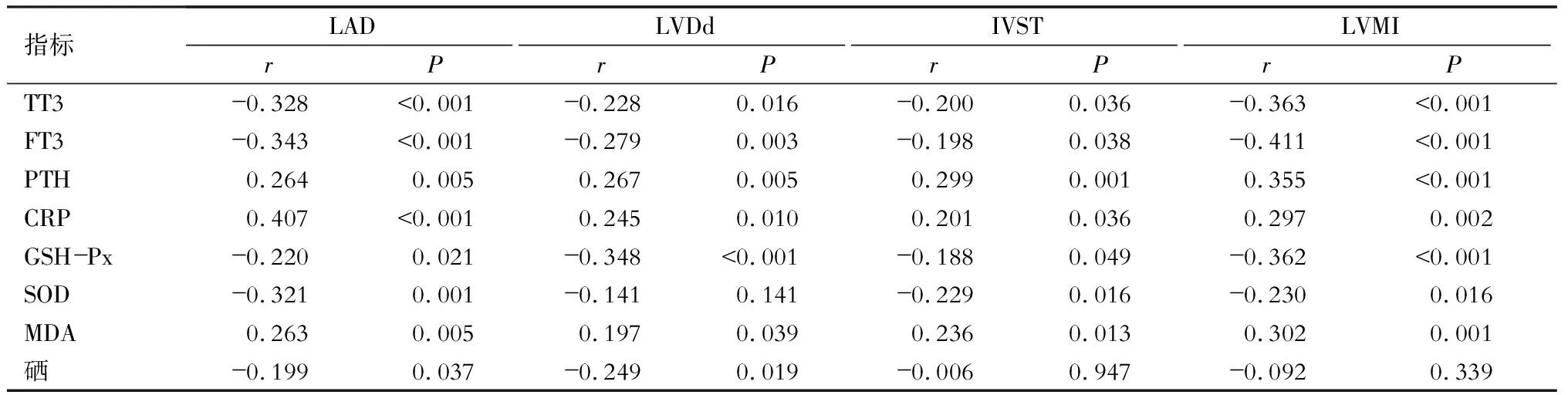
表6 血硒等临床指标与心脏结构指标间的相关性分析
讨 论
MHD患者的心血管事件死亡风险是同龄人群的10~20倍,欧美国家透析患者中约43%死于急性心肌梗死、心脏骤停和心律失常等CVD事件[6],我国透析患者中约51%死于心脑血管疾病,其中32%死于心力衰竭[7]。可见,CVD是MHD患者最常见和最重要的死因[8-10]。LVH、冠状动脉疾病、充血性心力衰竭和心律失常是MHD患者的常见CVD,其中以LVH最为常见。MHD患者开始透析时LVH的发生率高达70%~75%[11],且随透析龄增加而逐渐进展,LVH是MHD患者最主要的心血管结构的异常改变。通常认为血压升高、容量超负荷、交感神经活性亢进和贫血是引起MHD患者LVH的主要原因。近年来,高尿酸血症、高脂血症、持续的微炎症状态、氧化应激状态、TH及PTH代谢紊乱等因素对LVH的影响日益受到人们的重视。而微量元素硒与上述因素关系密切,体内低硒状态可能通过影响上述因素而在MHD患者LVH形成中起作用。本研究发现,MHD患者血硒、GSH-Px、SOD、TT3和FT3均明显低于正常对照者,而MDA、CRP和PTH均明显高于正常对照者;LAD、LVDd、LVPWT和LVMI均明显大于正常对照者;血硒与GSH-Px、SOD、TT3、FT3呈正相关,与MDA、CRP、LAD和LVDd呈负相关;GSH-Px、TT3、FT3与LAD、LVMI、LVDd、IVST均呈负相关;SOD与LAD、IVST、LVMI呈负相关;MDA、PTH、CRP与LAD、LVDd、IVST、LVMI均呈正相关。上述结果表明MHD患者血硒水平明显降低,同时存在氧化应激反应增强、炎症反应增强、TH和PTH水平紊乱以及左心室形态和结构异常。血硒与氧化应激、炎症反应、TH和PTH变化关系密切,而氧化应激反应增强、炎症反应增强、TH和PTH水平紊乱与左心室形态和结构异常关系密切,提示低血硒可能通过以上多个环节影响MHD患者左心室结构和功能。但本研究仅发现血硒水平与LAV和LVDd呈显著负相关,而与LVMI、LVPWT、IVST等指标间虽也呈现出负相关趋势,但结果并无统计学意义,考虑与本研究样本量较小有关。
缺硒对MHD患者左心室结构和功能异常的影响及其确切机制目前尚未完全明了,其可能机制如下:(1)缺硒可使MHD患者体内GSH-Px等抗氧化硒酶活性下降,肿瘤坏死因子-α、白介素-6表达上调,8-羟基-2-脱氧鸟苷、8-异前列腺素水平和连接蛋白-43去磷酸化增加以及脂质代谢紊乱而引起心肌细胞氧化应激增强、心脏重塑、心肌病而导致猝死等CVD[12-14]。(2)缺硒可使MHD患者体内I型碘甲状腺原氨酸5’-脱碘酶活性下降,引起T4向有生物活性的T3转化受阻,导致甲状腺功能低下[15]。甲状腺功能低下可通过激活氧化应激反应、引起脂质代谢紊乱而增加患者发生动脉粥样硬化和左心室收缩或舒张功能障碍的风险[16-17]。而TH治疗则可减轻心肌梗死大鼠的左心室扩张、改善左心室重构过程,进而改善左心室功能,并可调节心脏促炎性Toll-4受体/核因子-kB(TLR4/NF-kB)的表达,降低黄嘌呤氧化酶的表达而改善左心室功能,进而起到心肌保护作用[18-19]。此外,PTH可能通过与心肌细胞上的PTH相关蛋白受体结合而影响心肌细胞能量代谢,引起心肌细胞增生、心肌纤维化,从而导致心脏结构和功能的异常[20]。本研究发现MHD患者血硒、TT3、FT3显著降低,PTH含量明显升高,血硒与TT3、FT3呈正相关,与LAD和LVDd呈负相关,PTH与LAD、LVDd、IVST、LVMI均呈正相关,提示低硒可能通过引起TH和PTH代谢异常而导致MHD患者左心室结构与功能的改变,使收缩和舒张功能受损。(3)MHD患者常因尿毒症毒素、透析器的生物相容性、透析用水的质量、反复穿刺血管通路和不同透析方式等因素的影响,体内长期处于微炎症状态。持续的微炎症状态使MHD患者左心室功能明显减低,显著增加CVD的发生风险,CRP每升高1 mg/L,主要心脏不良事件发生风险增加1.94倍[21-23]。MHD患者血清CRP显著升高,并与血硒水平呈显著负相关[24],本研究结果与文献报道相符。同时还发现MHD患者的CRP与LAD、LVDd、IVST、LVMI均呈正相关,提示缺硒可能通过激活氧化应激反应而介导单核细胞等炎症细胞产生炎症因子,参与MHD患者的心脏结构与功能的损伤。
综上所述,低硒可使MHD患者体内GSH-Px等抗氧化硒酶活性降低、氧化应激反应增强,TH、PTH代谢异常以及炎症反应增强,这些因素共同作用可导致MHD患者左心室结构和功能异常,尤以舒张功能异常更为明显,低硒可能是MHD患者左心室结构和功能异常的另一危险因素。但由于本研究为单中心小样本研究,其对低硒与MHD患者左心室形态和功能损害间的确切关系及其发病机制尚难以得出十分可靠的结论。今后将进一步开展分层研究或更大样本量的深入研究或进行多中心大样本联合研究以验证本研究的结论。
