多重交叉置换扩增联合羟基萘酚蓝检测脓肿分枝杆菌方法的建立
2020-03-13尹树鹏言晨绮李马超刘海灿李相新万康林
尹树鹏,钱 城,言晨绮,李马超,刘海灿,李相新,万康林
脓肿分枝杆菌(Mycobacteriumabscessus,M.abscessus)是最常见的快速生长型非结核分枝杆菌,也是抗生素耐药性最强的分枝杆菌之一,其通常与伤口感染和脓肿形成有关,是免疫功能低下患者中慢性肺病的常见原因[1-2]。最新的证据表明,脓肿分枝杆菌复合群(M.abscessuscomplex)应分为3个亚种,即脓肿分枝杆菌脓肿亚种、马赛亚种和bolletii亚种[3-4],脓肿分枝杆菌和马赛分枝杆菌较常见,M.bolletii相对较少见[5-6]。脓肿分枝杆菌对许多抗生素的耐药性高于马赛分枝杆菌[7]。与马赛分枝杆菌感染的治疗高成功率(80%~90%)不同的是,脓肿分枝杆菌感染者抗生素治疗后的治疗成功率低于50%[8]。基于基因的片段大小不同,提出erm(41)PCR测定法作为区分脓肿分枝杆菌和马赛分枝杆菌的简单方法[9]。虽然菌培养结合基因测序(16SrRNA,hsp65,rpoB,ITS)已被用于确定样本中脓肿分枝杆菌的存在,但在常规临床微生物学实验室中进行该操作既费时又昂贵,并且这种方法有可能提供相互矛盾的结果[10]。最近基于erm(41)基因PCR的测定提供了更快速的鉴别方法,但它需要在许多环境中可能无法获得的仪器。在等温条件下进行的多重交叉置换扩增(multiple cross displacement amplification,MCDA),是一种核酸扩增技术,已用于检测许多病原体[11-12]。羟基萘酚蓝(Hydroxynaphthol blue,HNB)是一种比色指示剂,可用于检测扩增产物。因此,MCDA与HNB方法结合可以仅使用保持均匀温度的简单加热器或水浴来检测微生物。
本研究尝试建立一种简单、快速、可见、经济、有效的基于MCDA的检测方法,用于检测具有全长erm(41)基因的脓肿分枝杆菌,同时评估MAB-MCDA-HNB方法在使用纯培养物和痰样品检测脓肿分枝杆菌中的表现。
1 材料与方法
1.1试剂和仪器 检测试剂羟基萘酚蓝购自北京海泰正元科技有限公司;Loopamp试剂盒购自荣研生物科技有限公司;TE缓冲液购自北京索莱宝科技有限公司;实时浊度仪(Loopamp,LA-320c)。
1.2菌株 从中国福建省福州市肺科医院获得23株脓肿分枝杆菌复合群临床分离株。对所有菌株进行rpoB,hsp65和ITS基因测序以区分脓肿分枝杆菌、马赛分枝杆菌和M.bolletii。此外,还使用了8种参考菌株(表1)。将细菌菌株在-70 ℃下储存在20%(w / v)甘油7H9肉汤中。在使用之前,将菌株在Middlebrook 7H10上传代培养。使用水煮法在100 ℃下从每个分枝杆菌菌落中用10 μL接种环提取的DNA,并通过Nanodrop ND-1000进行定量。
表1 所使用的菌株信息
Tab.1 Bacterial strains used in this study

BacteriaSource of strainsNo. of strainsM. abscessusATCC 199771M. abscessusIsolated strains15M. massilienceIsolated strains8M. tuberculosis H37RvATCC 292741M. bovis BCG-1M. kansassiATCC 124781M. smegmatisATCC 194201M. phleiATCC 117581M. aviumATCC 252911Staphylococcus aureusATCC259231
1.3用于MAB-MCDA-HNB测定的引物设计 为了设计脓肿分枝杆菌特异性MCDA引物,下载了脓肿分枝杆菌的erm(41)基因的核苷酸序列(GenBank登录号:KT185513.1)和马赛分枝杆菌(GenBank登录号:FJ358487.1)。比较脓肿分枝杆菌和马赛分枝杆菌的核苷酸序列,脓肿分枝杆菌的erm(41)序列为522 bp,马赛分枝杆菌由于两个片段的缺失,erm(41)序列仅含有246 bp,基于该缺失序列设计了脓肿分枝杆菌特异性MCDA引物对。引物设计,引物序列和位置的详细信息显示在表2和图1中。所有引物均由北京梓熙生物科技有限公司合成和纯化到高效液相色谱(HPLC)等级。
表2 多重交叉置换扩增引物信息
Tab.2 MCDA primers information

PrimersSequences (5'-3')Length/bpF1TGCTAGCCGTCGAGCT16CP1GCAGGTCCGCTTCCGCTAT-TCGACACCTTCGTTCACG37C1GCAGGTCCGCTTCCGCTAT19D1GACATCTTCCTCGGCAAAC19R1AATGGCCGTCGCGGCCA17R2CCCTACCAAGTCACCAGC18D2ACCTGGTGCTGCAGCG16C2TACGGAGTCTCTTGACGCCG-GAAT24CP2TACGGAGTCTCTTGACGCCG-GAATGCTTCGCATGTTTGTGC41F2TGGCGAACAGGTGCTC16

引物序列的位点标有下划线,左箭头和右箭头显示了使用的互补序列图1 用于设计多重交叉置换扩增引物的所选基因的位置和序列 Fig.1 Location and sequence of selected gene used to design multiple cross displacement amplification primers
1.4MAB-MCDA-HNB测定的标准化 MAB-MCDA-HNB反应在终体积为25 μL的扩增混合物中进行。简言之,每个反应含有0.4 μmol/L的置换引物F1和F2,每个扩增引物C1和C2各0.8 μmol/L,扩增引物R1,R2,D1和D2各1.2 μmol/L,2.4 μmol/L交叉引物CP1和2.4 μmol/L交叉引物CP2, 1.25 μL的Bst DNA聚合酶(10 U),12.5 μL的2×反应混合物(Loopamp试剂盒),1 μL HNB和1 μL DNA模板。离心混匀后,在实时浊度计(Loopamp,LA-320c)中进行等温扩增。
3种方法用于分析MCDA产物,包括浊度计,凝胶电泳和比色指示剂(HNB)。当使用HNB时,扩增产物使颜色从紫色变为天蓝色,而没有发生扩增反应的管(阴性对照和空白对照)保持紫色。
通过将温度从65 ℃改变到70 ℃确定最佳的扩增温度。以每次反应1 ng的水平使用脓肿分枝杆菌基因组DNA模板,并使用实时浊度法监测反应。
1.5MAB-MCDA-HNB的检测限 使用脓肿分枝杆菌ATCC 19977基因组DNA梯度稀释液(10 ng,1 ng,100 pg,10 pg,1 pg,100 fg,10 fg,1 fg)为模板测定检测限。我们将反应时间设定为60 min。测试每种稀释度的3个重复。
1.6MAB-MCDA-HNB测定的灵敏度和特异性 使用来自31株细菌菌株的基因组DNA分析MAB-MCDA-HNB的特异性和灵敏度(表1)。将MAB-MCDA-HNB的检测与具有实时浊度和2%琼脂糖凝胶电泳的方法进行比较。另外,用引物ermF(5′-GAC CGG GGC CTT CTT CGT GAT-3′)和ermR1(5′-GAC TTC CCC GCA CCG ATT CC-3′)扩增erm(41)基因[9]。PCR循环条件为95 ℃预变性10 min,然后35个循环(95 ℃ 30 s,62 ℃ 30 s,72 ℃ 1 min),最后72 ℃延伸10 min。通过2%琼脂糖凝胶电泳观察PCR产物。使用来自31个菌株的DNA模板。
1.7MAB-MCDA-HNB人工模拟痰标本检验 将MAB-MCDA-HNB测定应用于人工模拟的痰标本以评估其适用性。将脓肿分枝杆菌ATCC 19977在Middlebrook 7H10上孵育,然后培养使用生理盐水将脓肿分枝杆菌(10-1至10-6)连续稀释,7H10一式3份,并将100 μL等分试样铺在Middlebrook上,在37 ℃培养3 d后计数CFU。同时,将100 μL稀释的脓肿分枝杆菌悬浮液(10-1至10-6)加入1 mL痰液中(无脓肿)。然后将加标的痰液样品液化并用N-乙酰半胱氨酸—4%NaOH去污并用于DNA提取。通过在100 μL TE缓冲液中100 ℃煮沸15 min提取DNA。然后1 μL DNA用于评估MAB-MCDA-HNB测定。将测试重复3次。
2 结 果
2.1脓肿复合群的鉴定 通过16SrRNA,rpoB,hsp65和ITS序列的多位点序列分析,鉴定出23株脓肿分枝杆菌和8株马赛分枝杆菌的临床分离株。
2.2最佳反应温度 我们在65 ℃至70 ℃的温度下进行了所有测试温度的测定,在68 ℃下MAB-MCDA-HNB观察到最快的扩增。
2.3MAB-MCDA-HNB的检测限 在MAB-MCDA-HNB测定中使用系列稀释的脓肿分枝杆菌杆菌参考菌株(ATCC 19977)基因组DNA,最后我们证实低至100 fg的DNA模板可以启动MAB-MCDA反应(图2)。
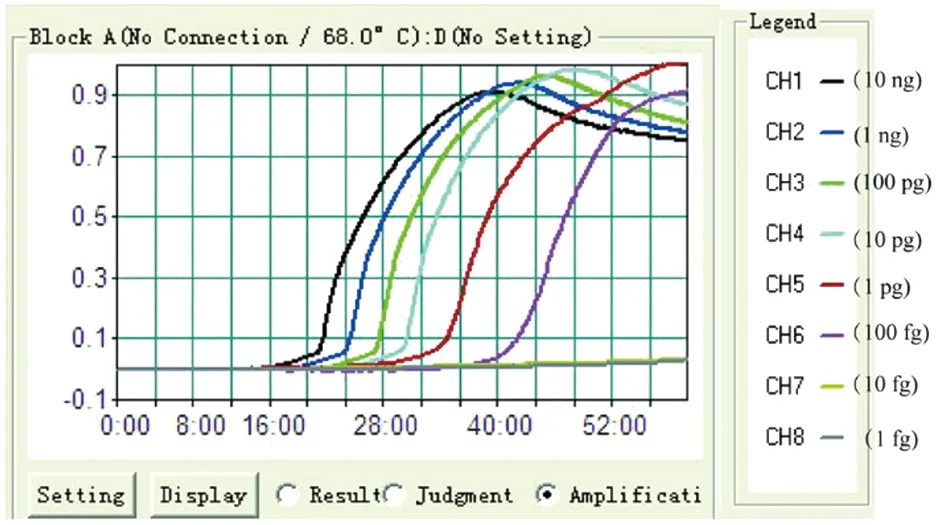
使用脓肿DNA模板(10 ng,1 ng,100 pg,10 pg,1 pg,100 fg,10 fg,1 fg)的系列稀释液,通过浊度的实时测量来监测扩增图2 MAB-MCDA-HNB测定的检测限 Fig.2 Limit of detection of MAB-MCDA-HNB assay
2.4测定的特异性和灵敏度 在31种细菌菌株中,只有来自M.abscessus的DNA显示阳性结果,来自M.massilience、结核分枝杆菌、BCG、M.kansassi、M.smegmatis、M.phlei、M.avium和金黄色葡萄球菌的DNA模板表现为阴性结果(图3)。
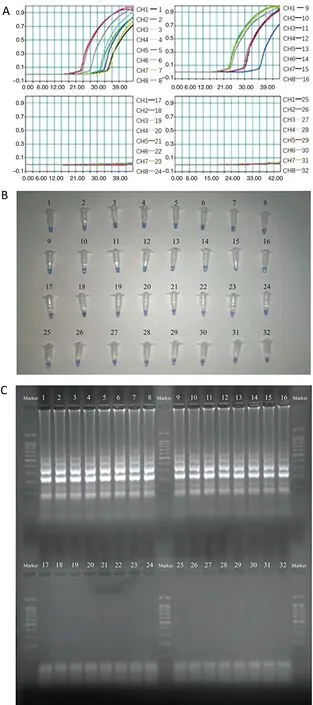
A产物通过实时浊度检测;B产物通过颜色变化检测;C产物通过琼脂糖凝胶电泳检测1-16,M. abscesuss; 17-24,M. massilience; 25,结核分枝杆菌H37Rv; 26,M. bovis BCG; 27,M. kansassi; 28,M. smegmatis,29,M. phlei; 30,M. avium; 31,金黄色葡萄球菌; 32,空白对照(DW)图3 MAB-MCDA-HNB检测M. abscessus中erm(41)基因的分析特异性Fig.3 Analytical specificity of MAB-MCDA-HNB for detecting erm (41) gene in M. abscessus
2.5erm(41)PCR产物的片段大小 使用ermF和ermR1引物通过PCR扩增两种不同大小的产物。来自脓肿分枝杆菌的DNA模板较长产物(~700 bp)和来自马赛分枝杆菌的较短产物(~400 bp)。其他细菌没有PCR产物(图4)。

M. massilience的扩增erm(41)产物小于M. abscessus的产物;1-16,M. abscesuss; 17-24,M. massilience; 25,结核分枝杆菌H37Rv; 26,M. bovis BCG; 27,M. kansassi; 28,M. smegmatis,29,M. phlei; 30,M. avium; 31,金黄色葡萄球菌; 32,空白对照(DW)图4 脓肿分枝杆菌、马赛分枝杆菌和其他细菌的PCR扩增产物Fig.4 PCR amplified products from M. abscessus, M. massilience and other bacteria
2.6MAB-MCDA-HNB在模拟脓肿分枝杆菌痰标本中的检测限 1 mL模拟痰中最低可检测的分枝杆菌数量约为1.7×103CFU(每次反应17 CFU)。如果浓度低于1.7×103CFU/mL,则MAB-MCDA-HNB测定显示阴性结果。
3 讨 论
脓肿分枝杆菌是重要的致病菌,特别是在患有囊性纤维化和慢性呼吸道疾病的患者中。此外,脓肿分枝杆菌被认为是最耐药的分枝杆菌物种,其感染的治愈率不理想[13],其对克拉霉素的诱导耐药性被认为是克拉霉素治疗效率低下的一种解释[14]。相比之下,马赛分枝杆菌显示出对克拉霉素的显著易感性[9]。因此,对脓肿分枝杆菌的正确诊断和菌种水平鉴定具有临床重要意义。
常用的临床分枝杆菌鉴定方法是结合PCR基因测序,PCR-限制酶分析(PRA)和基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF MS)进行培养。 PCR不完全正确,RPA方法可提供精确可靠的结果,但它需要更多的时间并且诊断过程比其他方法更复杂[15]。与GenBank数据库相比,基因序列分析是将所有菌株分布到物种和亚种水平的金标准方法。虽然多位点序列分析(16SrRNA,hsp65,rpoB,ITS)已用于检测样品中分枝杆菌属的存在,但在常规临床微生物学实验室中进行这种方法耗时且昂贵且该方法仅限于专业实验室[10]。一些研究数据表明,MALDI-TOF方法是一种快速有效的方法,可用于细菌菌种的鉴定[16]。该方法的主要缺陷是它不能区分亚种水平,包括脓肿分枝杆菌、马赛分枝杆菌和M.bolletii。此外,MALDI-TOF方法需要高度纯化的培养,因此会带来许多不便的过程[17]。在这项研究中,我们建立了一种方法,使用MCDA结合可视化结果来检测临床样本中的脓肿分枝杆菌。
erm(41)基因仅在脓肿分枝杆菌复合群中发现,并且脓肿中的全长erm(41)基因赋予可诱导的大环内酯抗性,这使人们质疑大环内酯治疗脓肿性脓肿感染的有效性。相比之下,马赛分枝杆菌中的erm(41)基因含有274 bp的缺失,导致无功能的erm(41)基因[9,18]。为了特异性检测脓肿脓肿,我们设计了针对该274 bp基因序列的MAB-MCDA-HNB引物(图1)。使用来自16株脓肿分枝杆菌,8株马赛分枝杆菌和7种其他细菌菌株的DNA模板证实MAB-MCDA-HNB测定的特异性,扩增仅发生在脓肿分枝杆菌的测试中(图3)。因此,MAB-MCDA-HNB测定提供了用于以高特异性检测脓肿分枝杆菌的诊断工具。
除了高特异性外,MAB-MCDA-HNB方法能够检测从纯培养物中提取低限100 fg的脓肿分枝杆菌DNA(图2)。此外,扩增反应结果可以根据颜色变化来判断,因此,该测定所需的唯一设备是加热块或水浴,其在68 ℃下提供恒定温度。
为了评估MAB-MCDA-HNB在临床样品中的实际应用,通过MAB-MCDA-HNB方法分析人工污染的痰样品。痰中脓肿分枝杆菌菌株MCDA的平均最低检测限为1.7×103CFU / mL(每个反应17 CFU)。
由于颜色差异,该方法的优点是快速且方便地获得反应结果。其次它不需要大型测量仪器来加热反应,因此有可能应用于初级和社区医院。这项研究的一个限制是我们只使用人工痰作为样本,我们没有得到临床样本来测试敏感性和特异性。
据我们所知,这是目前第一次尝试开发一种快速、可见的脓肿分枝杆菌检测方法。这种新型MAB-MCDA-HNB方法为将来临床样本中快速检测脓肿分枝杆菌提供了良好的选择。
利益冲突:无
引用本文格式:尹树鹏,钱城,言晨绮,等. 多重交叉置换扩增联合羟基萘酚蓝检测脓肿分枝杆菌方法的建立[J].中国人兽共患病学报,2020,36(1):40-44,49. DOI: 10.3969/j.issn.1002-2694.2019.00.193
