抗结核药物引起的艰难梭状芽胞杆菌相关性腹泻一例并文献复习
2020-03-13王静张蒙贺建清
王静 张蒙 贺建清
艰难梭状芽胞杆菌(Clostridiumdifficile,Cd)感染(Clostridiumdifficileinfection,CDI)是导致医院相关性胃肠道疾病的主要原因,并且给医疗保健系统带来了较高负担[1]。Cd相关性腹泻(Clostridiumdifficile—associated diarrhea,CDAD)的症状可以表现为Cd无症状定植或轻度腹泻,也可发展为严重威胁生命的假膜性结肠炎(pseudomembranous colitis,PMC)。几乎所有类别的抗生素都可诱发CDAD,尤其是克林霉素、第三代头孢菌素、广谱青霉素类和氟喹诺酮类药物[2]。相较于其他抗生素,抗结核药物的使用率更低,因此由抗结核药物诱导的CDI报道较少。笔者报告1例抗结核药物治疗6个月后出现抗结核药物导致CDAD的患者,回顾其临床资料,分析CDAD的诊疗过程及其与结核病、抗结核药物治疗之间的关系,讨论CDAD的发病机制、临床表现、诊断和治疗方法。
临床资料
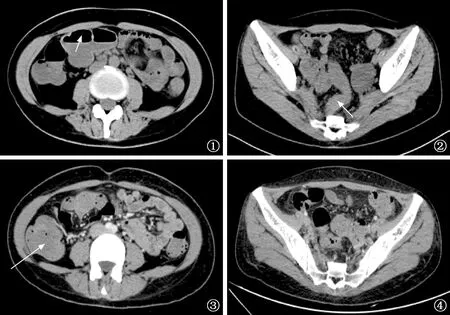
图1 患者于2017年7月7日行腹部CT检查,显示升结肠及横结肠呈节段性扩张,并见小液平(箭示) 图2 患者于2017年7月7日行腹部CT检查,显示乙状结肠壁肿胀(箭示) 图3 患者于2017年7月21日行腹部CT检查,显示肠壁肿胀好转,肠腔无液平,肠腔内为粪便(箭示) 图4 患者于2017年7月21日行腹部CT检查,肠壁未见明显肿胀
患者,女,藏族,32岁。因“咳嗽、咳痰超过1年,胸痛、腹泻超过3个月”,于2017年7月7日入我院。2016年6月,患者出现咳嗽、咳痰,伴畏寒、发热,无气促、咯血、胸痛、腹痛、腹泻、头痛、呕吐等症状;2016年10月于青海省第四人民医院完善相关检查,诊断为“继发性肺结核,双肺,痰涂片阴性,初治”,给予3H-R-Z-E/13H-R方案(H:异烟肼,0.3 g/次;R:利福平,0.45 g/次;Z:吡嗪酰胺,1.5 g/次;E:乙胺丁醇,0.75 g/次;均为1次/d,口服)进行抗结核治疗后,患者咳嗽、咳痰症状明显缓解。2017年4月,患者再次出现咳嗽,咳少许黄白色黏痰,伴深吸气时胸痛,伴间断性腹泻,呈水样便,4~6次/d,持续3~5 d后好转,反复发作,逐渐加重。于2017年5月10日再次至青海省第四人民医院就诊,胸部CT复查显示双肺继发性结核伴双肺局限性支气管扩张,纵隔淋巴结增大,病灶较前明显吸收。腹部及腹腔彩色超声检查未见异常。大便潜血试验呈阳性,血常规、肝肾功能、血红细胞沉降率均正常,结核抗体、痰抗酸杆菌涂片、大便培养志贺菌及沙门菌均阴性。按照“肠炎”进行治疗(具体不详)后腹泻无明显好转,遂转至我院。于2017年6月30日进行结肠镜检查,显示直肠及结肠未见异常。门诊予以抑菌、改善肠道功能、补充消化酶、调节肠道菌群(复方黄连素片,120 mg/次;复方谷氨酰胺肠溶胶囊,3 粒/次;复方消化酶胶囊,1 粒/次;枯草杆菌二联活菌肠溶胶囊,2 mg/次;均为3次/d,口服)治疗7 d后腹泻未缓解,以“继发性肺结核,双肺,痰涂片阴性,初治和腹泻原因待诊”收入我院。
患结核病以来,患者体质量较前下降15 kg。否认高血压、糖尿病、甲状腺功能亢进及慢性腹泻病史,否认肝炎等传染病病史,无生食海鲜肉类等嗜好。入院时体格检查:体温36.5 ℃,血压93/55 mm Hg(1 mm Hg=0.133 kPa)。胸廓未见异常,双肺未闻及干湿性啰音。腹部外形正常,全腹软,轻压痛,无反跳痛及肌紧张。听诊肠鸣音亢进,呈高调气过水声。双下肢无水肿。入我院后完善各项辅助检查,显示钾2.50 mmol/L(参考值 3.5~5.3 mmol/L),C反应蛋白33.7 mg/L(参考值 0~5 mg/L),降钙素原0.05 μg/L(参考值 0~0.046 μg/L)。大便常规:白细胞高倍镜下阳性,潜血阳性,大便菌群比6∶1,菌量大致正常。肿瘤标记物:癌胚抗原3.43 μg/L(参考值 0~3.4 μg/L),血清糖类抗原125为54.27 U/ml(参考值 0~35 U/ml),非小细胞肺癌抗原8.95 μg/L(参考值 0~3 μg/L),血清烯醇化酶、糖类抗原199、糖类抗原153、甲胎蛋白均正常。血常规、血红细胞沉降率、肝肾功能、凝血功能均正常。GM试验、甲型流感病毒、腺病毒、博卡病毒、鼻病毒、甲型流感H1N1(2009)病毒、副流感病毒、衣原体、偏肺病毒、乙型流感病毒、肺炎支原体、甲型流感H3N2病毒、冠状病毒、呼吸道合胞病毒、寄生虫、乙型肝炎病毒、丙型肝炎病毒、梅毒抗体、HIV抗体均为阴性。纤维支气管镜镜检、刷片未见异常,肺泡灌洗液及痰抗酸杆菌涂片、结核分枝杆菌DNA检查均为阴性。于2017年7月7日在我院行胸部CT平扫,显示右肺中叶及双肺下叶片状、小结节状模糊影,并支气管轻度扩张,对比1年前胸部CT平扫结果,患者肺部结核病灶明显吸收,故考虑支气管扩张伴感染,于2017年7月14日予以抗感染(哌拉西林他唑巴坦,4.5 g/次,1 次/8 h,静脉滴注)治疗。2017年7月11日所送痰及肺泡灌洗液培养结果显示肺炎链球菌,药物敏感性试验提示对阿莫西林敏感,于2017年7月 17日加强抗感染(阿莫西林克拉维酸钾,1.0 g/次,2次/d,口服)治疗,患者咳嗽症状逐渐缓解。于2017年7月7日行腹部增强CT扫描,提示直肠、乙状结肠、降结肠壁广泛肿胀,升结肠及横结肠呈节段性扩张,并见小液平,考虑炎性改变伴不全性肠梗阻,下腹盆腔轻度腹膜炎征象(图1,2)。结合肺结核病史,考虑并发腹腔结核,继续在H-R(利福平0.45 g/次,异烟肼0.3 g/次;均为1 次/d,口服)方案进行抗结核治疗的基础上,口服蒙脱石散止泻,益生菌调节肠道菌群,氯化钾纠正低钾血症,患者腹泻症状未缓解。继续完善相关检查,大便培养未分离出志贺菌及沙门菌。大便检查:Cd毒素A/B检查阳性,谷氨酸脱氢酶(glutamate dehydrogenase,GDH)抗原检测阳性。结合腹部CT扫描,提示肠壁炎性改变伴不全性肠梗阻,考虑长期使用利福平所致抗生素相关性肠炎的可能。调整治疗方案,于2017年7月12日停用利福平、异烟肼,予以抗CDI(万古霉素,50万U/次,4 次/d,口服)治疗,并补充肠道益生菌[双歧杆菌乳杆菌三联活菌片(金双歧),4 片/次,3 次/d,口服]。治疗2 d后患者诉腹泻次数减少为1~2次/d,治疗6 d后患者腹泻停止,于2017年7月21日复查腹部CT显示肠壁未见明显增厚肿胀(图3,4),复查Cd毒素A/B阴性,GDH抗原检测阴性,停用万古霉素。
文献复习及讨论
自1935年Hall和O’Toole首次对Cd进行描述以来,其一直被认为是导致医院内感染性腹泻的病原菌之一。此后,Cd在1978年被确定与PMC的发生有关,且几乎是其发生的唯一原因[3]。Cd是一种革兰阳性厌氧芽孢杆菌,一般被认为是环境和人类肠道中的正常菌群。大量应用广谱抗菌药物、免疫抑制剂或化疗药物后,肠道菌群平衡被破坏,导致出现厌氧环境,进而使耐药的Cd过度繁殖,从而产生毒素A和毒素B,导致CDI[4]。CDI的临床表现呈现多样性,从轻、中度腹泻到暴发性甚至致命性PMC,还会导致中毒性巨结肠、肠穿孔、败血症。感染严重者须行肠切除术,甚至死亡[1]。近几年来,CDI的发病率和严重性在逐渐增加,成为医院内获得性腹泻的主要病原菌之一[5]。
通过PubMed数据库,以“antitubercular agents”“pseudomembranous colitis”“rifampin”为检索词,检索到相关外文文献36篇,国内尚未检索到相关文献,选取资料完整的13篇[6-18]病例报告中的13例患者进行总结,具体情况见表1。这些患者以老年人为主,年龄为28~90岁,男5例,女8例。开始服用抗结核药物后,CDI的潜伏期为20~126 d不等。并发肿瘤、自身免疫性肝病或糖尿病等免疫功能低下的患者,以及高龄、重症结核病患者,潜伏期相对较短。韩国的一项多中心研究显示,患者行抗结核药物治疗后,CDI的潜伏期可从3 d至167 d[19]。PMC的潜伏期可从7 d至240 d,大部分在1个月后才出现CDI[10],本例患者潜伏期较大部分患者长,这提醒在抗结核药物治疗的后期仍需警惕CDI的发生。检索到的文献中仅有5例患者进行了大便Cd毒素检测,原因考虑为部分地区未开展此检测项目,故其检测率相对较低;6例进行了Cd培养,2例为阳性,培养阳性率较低。肠镜检查符合PMC表现的有11例,故肠镜检查仍为临床诊治过程中的主要检查手段。8例患者经甲硝唑治疗后症状改善,2例停用利福平后自愈,1例仅口服乳酸杆菌治愈,1例口服万古霉素后治愈;另1例患者肝、脾、骨髓、肺等多部位结核分枝杆菌感染,病情重,尽管已口服万古霉素治疗,但仍未取得满意效果,最后因心力衰竭死亡。本例患者在确诊后立即口服万古霉素治疗,病情得到缓解。甲硝唑仍为治疗CDI的首选药物,万古霉素应限制使用于甲硝唑治疗无效或者重度及复杂性CDI的患者。
Gerding等[20]提出了CDAD的3个主要诊断标准:(1)出现不能用其他原因解释的腹泻≥3次/24 h;(2)粪便检测产毒Cd或Cd毒素阳性;(3)肠镜检查或组织病理学发现为PMC。本例患者在入院前腹泻次数达到4~6次/d,入院后腹部CT(2017年7月7日)提示有肠壁肿胀及不全性肠梗阻,GDH及Cd毒素A/B均为阳性,患者没有确定其他腹泻原因,符合CDAD的诊断标准。患者门诊结肠镜提示直肠及结肠未见异常,其原因考虑有以下两点:首先,当CDI累及横结肠、升结肠、盲肠等结肠较远节段时,结肠镜不易观察到。再者,患者反复腹泻已超过3个月,且为间歇性发作,肠镜检查时可能处于健康带菌状态,结肠镜未能发现阳性病变。因此,患者的结肠镜检查结果考虑为假阴性。遗憾的是,本例患者因粪便Cd毒素已呈阳性,故未进行结肠镜复查。此时应重复检查结肠镜,以免延迟诊断和治疗,尤其在最初测定是阴性的情况下[21]。
CDI的危险因素包括抗生素的使用、高龄、潜在疾病严重程度增加、既往住院、饲管的使用、胃肠道手术及质子泵抑制剂的使用[22-23]。抗生素中最常见的有克林霉素、第三代头孢菌素、广谱青霉素类和氟喹诺酮类。抗结核药物是该病的罕见病因,自20世纪80年代以来已经有少数与抗结核药物相关的CDI患者被报道[6-18, 24]。在抗结核药物中,由于利福平具有广谱的抗菌活性,而异烟肼及乙胺丁醇对肠道菌群影响不大,故考虑利福平为致病因素[25]。在此例患者中,由于属于继发性肺结核,患者长期服用抗结核药物治疗,包括利福平及异烟肼,停服抗结核药物,并加服万古霉素等综合措
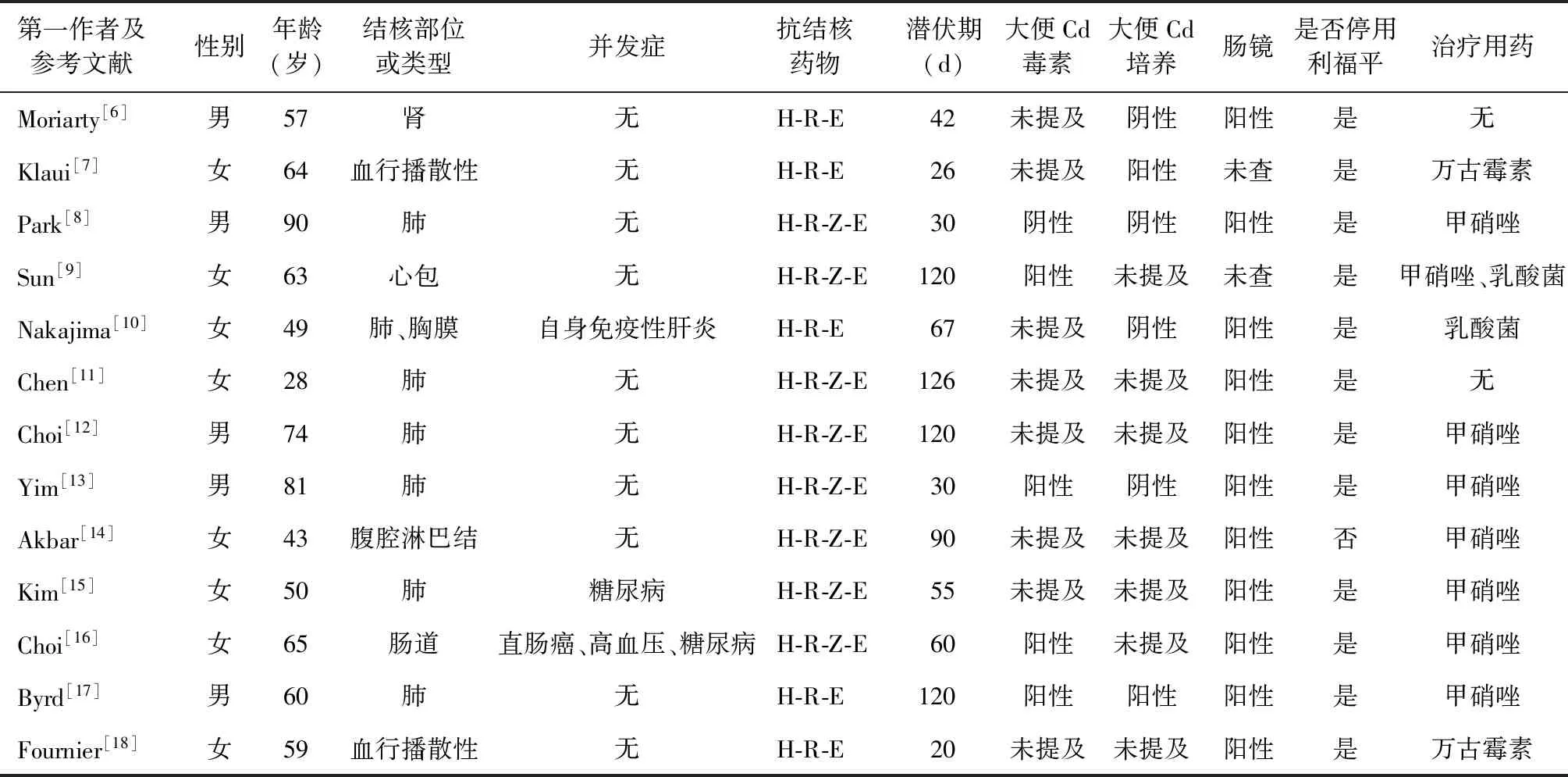
表1 相关文献中患者的临床资料
注Cd:艰难梭状芽胞杆菌
施后症状缓解,因此,利福平很可能是这种情况下导致患者发生抗生素相关性腹泻的原因。
CDI的疾病严重程度分类及治疗简述如下。(1)轻度CDI:腹泻是唯一的症状。(2)中度CDI:腹泻,但没有符合以下严重或复杂CDI定义的其他症状或体征。(3)重度CDI:在疾病过程中出现或发展为低蛋白血症(血清白蛋白<30 g/L),并满足以下任何一项,①白细胞(WBC)计数≥15×109/L;②腹部压痛,无复杂疾病标准。(4)复杂性CDI:出现或发展至少1种下列体征或症状。①入住重症监护室;②有或无需要使用血管加压剂的低血压;③发热≥38.5 ℃;④肠梗阻或腹胀;⑤精神状态变化;⑥WBC≥35×109/L或<2×109/L;⑦血清乳酸水平>2.2 mmol/L;⑧任何终末器官衰竭的证据。CDI的治疗原则为先停用相关抗生素,给予液体和补充电解质等支持治疗,同时应用抗Cd的抗生素、免疫调节治疗药物和改善肠道微生态药物,并避免使用解痉剂,以免毒素滞留于肠腔。抗Cd的抗生素一般首选甲硝唑或万古霉素。甲硝唑是轻中度CDI初发的首选药物,剂量为500 mg/次,3次/d。万古霉素是重度和复杂性CDI初发的首选药物,剂量为125 mg/次,4 次/d。均以口服为宜,疗程一般为10 d[1]。本例患者出现腹泻,血压为93/55 mm Hg,腹部CT检查提示有肠梗阻,属于复杂性CDI,故首选万古霉素进行抗Cd治疗。患者在发生CDI后立即停用抗结核药,纠正水、电解质平衡紊乱,给予营养支持治疗,在行万古霉素抗感染治疗的基础上,加用益生菌治疗以改善肠道菌群,症状即得到缓解。
抗结核药物导致CDI的潜伏期长,故在使用抗结核药物、尤其是利福平的整个过程中,对于出现腹泻、肠梗阻的患者应评估CDI,尽早进行大便Cd培养、Cd毒素及结肠镜等检查。一旦确诊为CDAD,应立即停用正在使用的抗结核药物及其他抗生素,根据情况使用甲硝唑或万古霉素,及时恢复肠道菌群,改善肠道屏障,同时注意营养支持和维持酸碱电解质平衡,避免PMC等重症肠道疾病的发生。
