抗结核药物作用新靶点及其研究进展
2020-03-13陈浩武楠楠胡文辉杨忠金
陈浩 武楠楠 胡文辉 杨忠金
目前,世界卫生组织推荐治疗药物敏感性结核病使用标准四药方案,即利福平、异烟肼、乙胺丁醇和吡嗪酰胺的6个月联合治疗(利福平、异烟肼、吡嗪酰胺和乙胺丁醇使用2个月,随后联用利福平、异烟肼4个月),治愈率可达到90%~95%[1-2];但是该方案的药物及其代谢产物会引起肝损伤。此外,长达6个月的治疗使患者的用药依从性有所降低,如果用药管理不完善容易导致耐药性的产生。因此,我们需要时间更短的标准治疗方案和能够抵抗耐药性菌株的新型药物来更加快速有效地消灭结核分枝杆菌。
由于结核分枝杆菌耐药性的越来越严重,世界卫生组织和全球结核病联盟联合开展了抗结核新药的开发。近10年来结核分枝杆菌分子靶点耐药机制及其研究取得了令人振奋的成果,针对各种新靶点的抗结核新药已经陆续进入临床试验,新药贝达喹啉和德拉马尼已经获批用于治疗耐多药结核病(multi-drug resistant tuberculosis,MDR-TB)和广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)。目前各大研发机构已经创建了一个丰富的先导化合物资源库,笔者对最有潜力的抗结核分枝杆菌新靶点和13个临床研究阶段的药物进行梳理和分析(表1)。
一、细胞壁合成
结核分枝杆菌富含脂质的细胞壁是新型抗结核药物靶点的主要来源。
癸烯基磷酸基-β-D-核糖氧化酶(decaprenylphosphoryl-β-D-ribose oxidase,DprE1)是一种参与结核分枝杆菌细胞壁生物合成的关键酶,与癸烯基磷酸基-β-D-核糖-2-表异构酶(decaprenylphosphoryl-β-D-ribose-2-epimerase,DprE2)一起催化D-核糖(phoryl-β-D-ribofuranose,DPR)向D-阿拉伯呋喃糖(decaprenylphosphoryl-β-D arabinofuranose,DPA)转化。DPA是合成细胞壁阿拉伯聚糖的唯一前体。DprE1已经成为多种化学物的作用靶点。目前正在开发的DprE1抑制剂有:苯并噻嗪酮类、氟喹诺酮类和氮杂吲哚类。其作用靶点对分枝杆菌物种具有高度选择性,近年来DprE1正在成为开发安全和有效的抗结核药物的研究热点[3]。如苯并噻唑酮类化合物,它们作为还原形式的DprE1的底物进行硝基还原,产生亚硝基分子,特异性地攻击活性位点半胱氨酸残基Cys387的巯基侧链,从而形成共价加合物并不可逆地使酶失活[4](图1)。
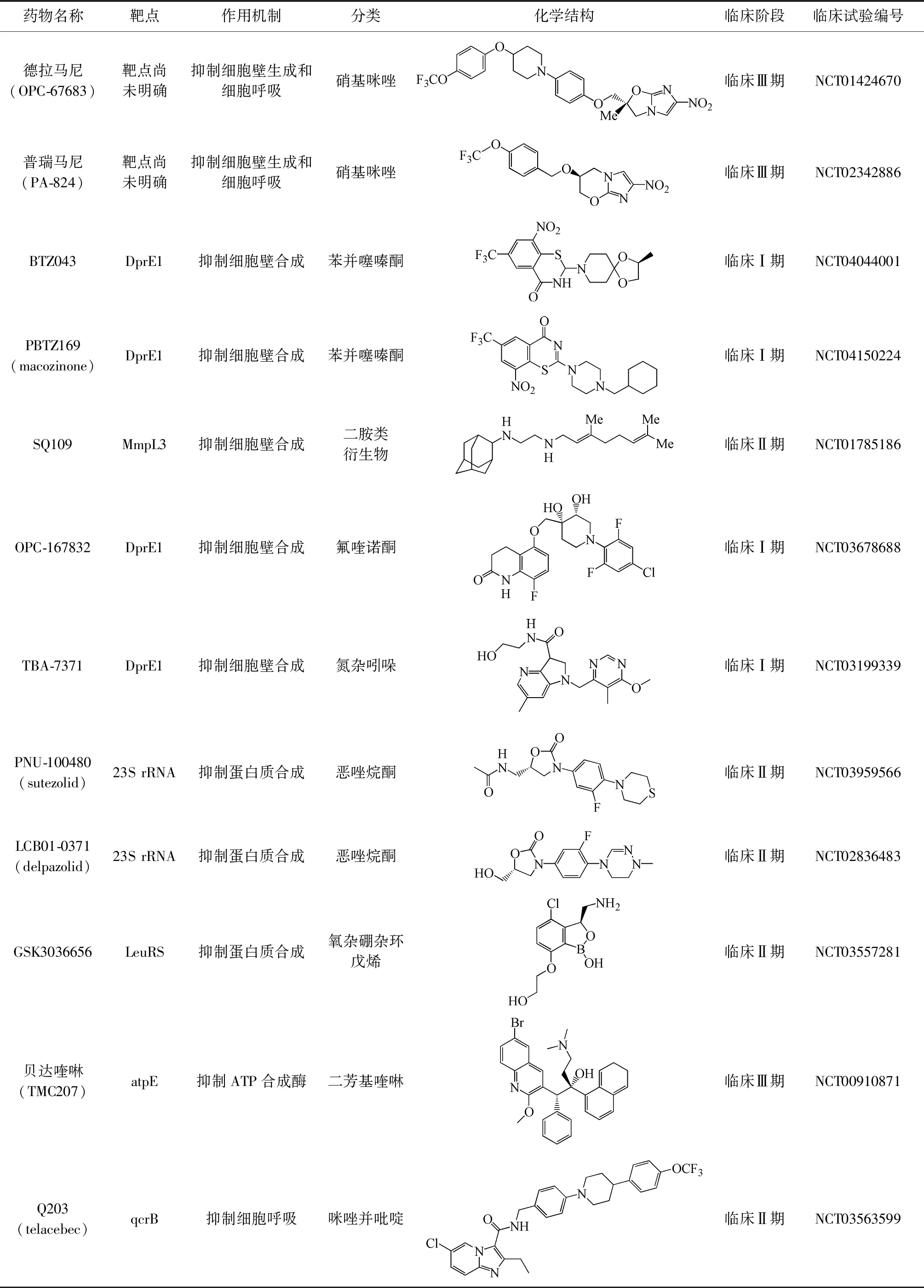
表1 抗结核新药及其介绍
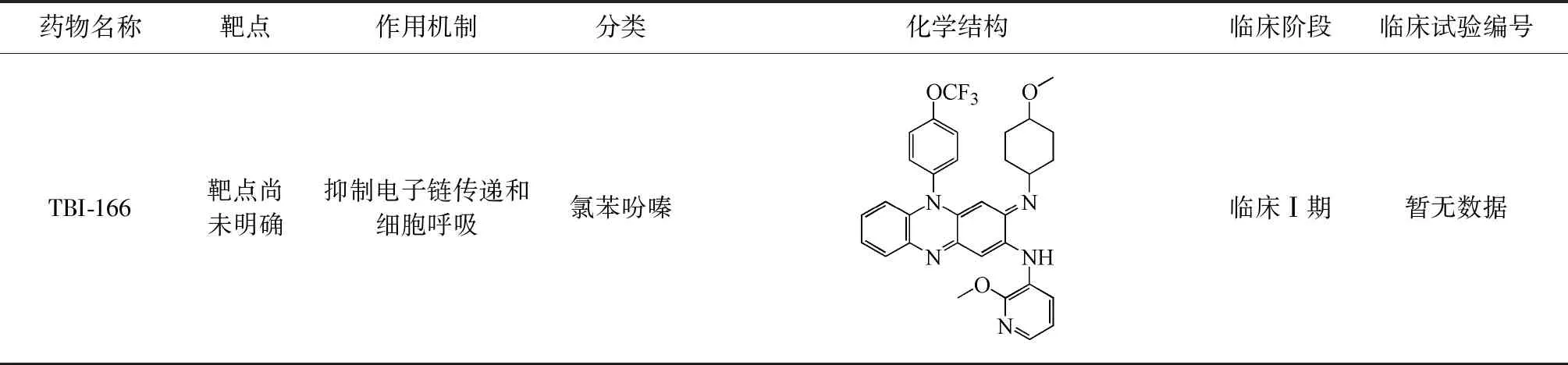
续表1
注数据来自http://www.newtbdrugs.org,截止到2020年1月
分枝杆菌膜蛋白3(mycobacterial membrane protein large 3,Mmp L3)是另一个细胞壁靶标,MmpL3作为转移内膜上的跨膜转运蛋白[6],具有在体内成为高度易受攻击的靶标的吸引力[7]。二胺类衍生物SQ109通过作用于MmpL3进而干扰霉菌酸组装到细菌细胞壁中而起作用,主要表现为抑制海藻糖二霉菌酸酯(trehalose dimycolate,TDM)的产生,并且霉菌酸盐不能附着到细胞壁阿拉伯半乳聚糖上。SQ109化合物的类似物导致相似的TDM合成关闭,以及伴随的海藻糖一霉菌酸酯(trehalose monomycolate,TMM)积累。全基因组测序显示自发产生的SQ109抗性突变体都在必需的MmpL3基因中具有突变[8](图1)。
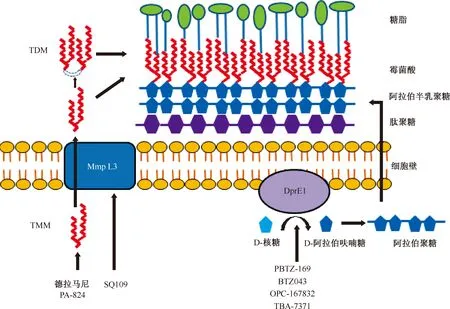
TDM:海藻糖二霉菌酸酯,trehalose dimycolate;TMM:海藻糖一霉菌酸酯,trehalose monomycolate;Mmp L3:分枝杆菌膜蛋白3,mycobacterial membrane protein large 3; DprE1: 癸烯基磷酸基-β-D-核糖氧化酶,decaprenylphosphoryl-β-D-ribose oxidas;该图参考文献[5]绘制图1 抑制细胞壁合成的靶点
硝基咪唑类化合物抑制细胞壁霉菌酸合成,其分子机制尚未阐明;研究表明,硝基咪唑类化合物可抑制结核分枝杆菌细胞壁甲氧基-霉菌酸和酮-霉菌酸的合成。此外,硝基咪唑类化合物的中间体作为一氧化氮供体,引起的呼吸中毒已得到证实[9-10]。
(一)德拉马尼(OPC-67683)
德拉马尼是一种已经上市的抗结核药品,来源于硝基咪唑类化合物,具有高效的抗结核分枝杆菌活性[11]。德拉马尼是一种前药,其通过一种尚未知的分子机制抑制分枝杆菌细胞壁甲氧基-霉菌酸和酮-霉菌酸的合成;与异烟肼不同,该药物不会抑制α-霉菌酸,可有效减少细菌耐药性的形成。德拉马尼需要通过分枝杆菌F420辅酶系统代谢激活才能发挥其抗结核活性[9-10]。有研究已经证明,双环硝基咪唑代谢途径中的中间体作为一氧化氮供体,从而引起呼吸中毒[10]。德拉马尼对结核分枝杆菌体外的最小抑菌浓度(minimum inhibitory concentration,MIC)范围为0.006~0.0241 μg/ml,在体内低剂量即可表现出高效的治疗活性。德拉马尼不受肝脏微粒体酶活性的影响,也不影响肝微粒体酶的活性,这表明德拉马尼能够与抗逆转录病毒药物联合使用,诱导或被细胞色素P450酶代谢[11]。世界卫生组织关于德拉马尼的使用指南中,临床数据验证了药物的安全性和有效性[12]。
(二)普瑞马尼(PA-824)
普瑞马尼是一种双环硝基咪唑类分子(硝基咪唑并吡喃),对复制、非复制期和缺氧条件下的结核分枝杆菌都有效。和德拉马尼一样,普瑞马尼是一种前药,其通过尚未完全阐明的分子机制抑制细胞壁霉菌酸生物合成。对普瑞马尼作用模式的微阵列分析显示,细胞壁抑制(如异烟肼)和呼吸中毒(如氰化物)的基因表现出混合效应[10]。目前,研究已经证明普瑞马尼直接作为一氧化氮供体,引起的呼吸中毒是普瑞马尼抑制细菌无氧活动的关键因素。在缺氧非复制条件下,普瑞马尼对呼吸复合物的作用表现为细胞内ATP水平的快速下降,这与氰化物处理的现象相似[10]。最近,一项新的研究显示,毒性代谢物甲基乙二醛的积累是分枝杆菌中普瑞马尼的额外杀灭机制[13]。体外测试普瑞马尼对药物敏感菌株的MIC为0.015~0.25 μg/ml,对MDR-TB分离株的MIC为0.039~0.531 μg/ml;在体内模型试验中具有良好的活性[14]。
临床Ⅱ期试验数据显示,普瑞马尼杀菌活性的剂量范围内所有剂量均安全且耐受性良好。在药物敏感性成人肺结核患者的剂量范围研究中,普瑞马尼被证明是安全的,耐受良好且有效[15]。在一项Ⅱ期临床试验的联合用药评估中,认为莫西沙星、PA-824和吡嗪酰胺的组合是安全的,耐受性良好,并且在治疗8周期间在药物敏感结核病中显示出优异的杀菌活性。该方案已准备好进入药物敏感性结核病和MDR-TB患者的临床Ⅲ期试验,预期可以缩短和简化治疗[16]。
(三)BTZ043
BTZ043是一种苯并噻嗪酮类化合物,对耐多药结核分枝杆菌耐多药临床分离株具有抑菌活性。BTZ043通过阻断DprE1来抑制结核分枝杆菌细胞壁合成。BTZ043对结核分枝杆菌H37Rv的MIC为1 ng/ml,体内试验显示出较低的毒性,表明BTZ043是治疗结核病的有潜力的候选药物[17]。
(四)PBTZ169 (macozinone)
PBTZ169是一种哌嗪基苯并噻嗪酮衍生物,通过BTZ043的结构优化得到。与BTZ043相比,PBTZ169化学合成更容易、商品成本低和药效学更好。PBTZ169通过作用于DprE1酶抑制分枝杆菌细胞壁的合成。PBTZ169对结核分枝杆菌H37Rv的MIC为0.0625 μg/ml[18]。PBTZ169在临床前模型中与贝达喹啉和氯法齐明具有协同作用。
(五)SQ109
SQ109是一种新型1,2-乙二胺小分子药物,对药物敏感和耐药性结核分枝杆菌均具有抑菌活性。SQ109通过作用于Mmp L3靶点,干扰霉菌酸组装到细菌细胞壁中起作用。SQ109对结核分枝杆菌H37Rv的MIC为0.015 μg/ml[19]。体外研究表明,SQ109可以增强异烟肼、利福平和贝达喹啉的抗结核分枝杆菌活性,治疗患有结核病小鼠的时间缩短30%以上。SQ109可替代目前的一种或多种抗结核药物,简化治疗,缩短目前的治疗时间[20]。2017年3月,俄罗斯生物技术公司Infectex报道了SQ109安全性、有效性和耐受性方面的积极结果,Ⅱ/Ⅲ期临床试验结果良好,接受SQ109加标准方案治疗患者的痰培养阴转率为80%,明显高于接受标准方案加安慰剂治疗的患者(61%)[21]。
(六)OPC-167832
OPC-167832是一种新合成的氟喹诺酮类衍生物,其通过抑制DprE1在体外显示出较高的抗结核分枝杆菌活性。对实验室菌株和临床分离菌株(包括耐药性结核分枝杆菌),OPC-167832对结核分枝杆菌的MIC范围为0.00024~0.002 μg/ml。OPC-167832对慢性结核病的试验小鼠模型显示出对细胞外和细胞内结核分枝杆菌的有效杀菌活性,其剂量低于其他抗结核药物。OPC-167832在体外琼脂稀释法和慢性结核病小鼠模型中未显示出与其他抗结核药物的拮抗作用[22]。对慢性结核病小鼠模型的研究显示,德拉马尼和OPC-167832,以及其他新的抗结核药物联用较标准治疗方案更有效。OPC-167832与德拉马尼联用方案可以缩短治疗时间并改善治疗效果[23]。
(七)TBA-7371
TBA-7371是一种新型的氮杂吲哚类化合物,作为靶点DprE1的非共价抑制剂,TBA-7371已显示对结核分枝杆菌的抑菌活性,MIC范围为0.28~1.12 μg/ml,并且在结核病的啮齿动物模型中显示出功效[24]。
二、蛋白质合成
抑制结核分枝杆菌的蛋白质合成是可行的治疗策略。
RNA抑制剂表现出一定的抗结核潜力,恶唑烷酮类化合物中利奈唑胺治疗MDR-TB具有较好的效果。恶唑烷酮类化合物可以通过结合23S rRNA的V结构域来抑制50S rRNA形成,从而阻断蛋白质的合成[25]。
最近研究报道了一种新的蛋白质合成抑制剂,其靶向亮氨酰-tRNA合成酶(leucyl-tRNA synthetase,LeuRS)具有较强的抗菌活性。LeuRS是所有细胞中蛋白质合成所需的一系列必需酶,具有2个活性位点:氨基酰化tRNA的合成位点,以及通过校对机制确定翻译保真度的编辑位点。此外,含硼化合物被证明可通过tRNA的捕获机制抑制LeuRS,这种机制中硼原子结合到tRNA的3′末端腺苷核苷酸的Ade76上,形成的共价化合物结合了编码位点中tRNA的3′端,抑制亮氨酸和tRNA的合成,从而抑制蛋白质合成。这些LeuRS抑制剂的口服生物利用度和抗菌活性,预示着这种新型药物将得到进一步的发展[26](图2)。
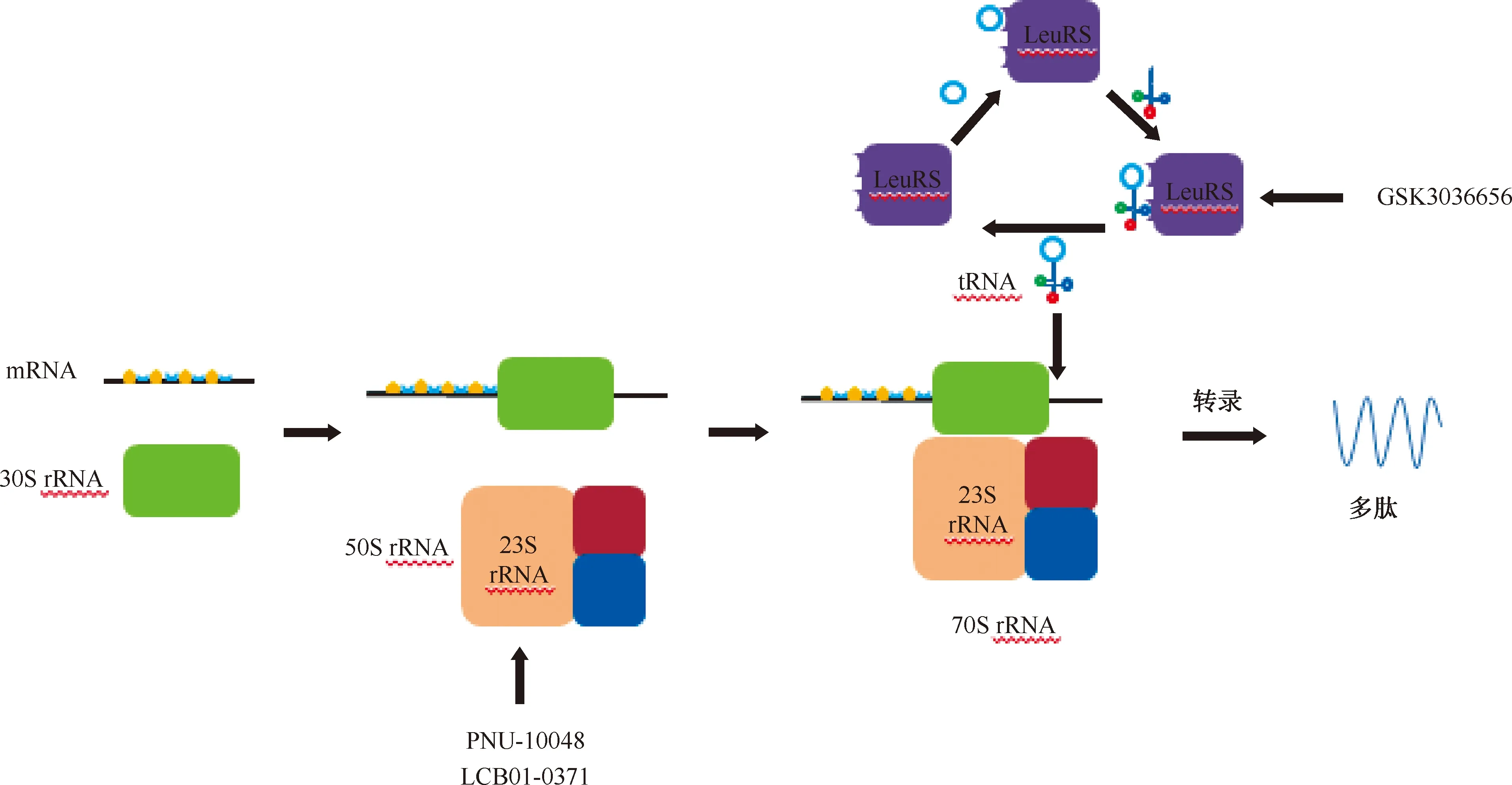
LeuRS:亮氨酰-tRNA合成酶,leucyl-tRNA synthetase;该图参考文献[5]绘制图2 抑制蛋白质合成的靶点
(一)PNU-100480(sutezolid)
PNU-100480是一种恶唑烷酮类化合物。它可以结合细菌23S rRNA的50S亚基并阻止功能性70S起始复合物的形成,从而抑制mRNA的转录。PNU-100480对于药物敏感性结核分枝杆菌的MIC为0.21 μg/ml,对耐药结核分枝杆菌的MIC范围为≤0.0625~0.25 μg/ml[27]。Ⅰ期临床研究结果显示,在多次递增剂量的安全性、耐受性、药代动力学和药效学评价中,PNU-100480是安全的,并且在所有测试剂量下均耐受良好[28]。
(二)LCB01-0371(delpazolid)
LCB01-0371是一种具有环状氨基腙的新型恶唑烷酮,表现出较好的抗革兰阳性菌的活性。LCB01-0371通过结合23S rRNA的V结构域来抑制mRNA的转录,从而阻断蛋白质的形成[25]。LCB01-0371对240种多耐药和广泛耐药结核分枝杆菌的90%MIC(90% minimun inhibitory concentration,MIC90)为0.5 μg/ml[29]。研究表明,LCB01-0371具有良好的安全性,由于其较好的水溶性可用于口服给药。LCB01-0371显示出体外和体内抗革兰阳性菌活性,同时具有良好的药物代谢和药代动力学特性[25]。
(三)GSK3036656
GSK3036656是一种新型氧杂硼杂环戊烯化合物,其靶向结核分枝杆菌的LeuRS酶可抑制蛋白质合成。GSK3036656 对结核分枝杆菌H37Rv的MIC为0.02 μg/ml。此外,GSK3036656对结核分枝杆菌LeuRS酶具有高度选择性(MIC=0.05 μg/ml)。GSK3036656在结核病小鼠感染模型中表现出良好的PK特性和抗结核分枝杆菌效果[26]。GSK3036656在南非进行的临床Ⅱa期试验(NCT03075410)研究表明,GSK3036656在单次和多次给药后是安全的,耐受良好。GSK3036656药代动力学特性和代谢产物图谱使其成为一种有希望的抗结核药,具有新的作用机制和更短的治疗时间[30]。
三、能量代谢
结核分枝杆菌的喜氧性提示干扰或阻断能量代谢可以成为有效的杀菌机制。
atpE基因编码ATP合酶的亚单位C(质子泵),二芳基喹啉类化合物贝达喹啉通过与结核分枝杆菌ATP合酶的亚基c结合,进而抑制ATP合成产生杀菌活性。这种独特的作用方式可以减少与现有抗结核药物交叉耐药的可能性[31]。
结核分枝杆菌中的细胞色素bc1:aa3促进了对末端呼吸氧化酶抑制剂的研究。分枝杆菌细胞色素bc1:aa3由甲基萘醌、细胞色素c还原酶(bc1)和细胞色素aa3型氧化酶组成。咪唑并吡啶类化合物Q203能干扰甲基萘醌的亚基b的功能。尽管Q203对bc1:aa3复合物具有亲和力,但该化合物仅具有抑菌作用。研究表明,细胞色素bd氧化酶能在Q203存在下足以维持呼吸和ATP合成,以保护结核分枝杆菌免受Q203诱导的细菌死亡。在细胞色素bd氧化酶编码基因cydAB的遗传缺失后,Q203完全抑制细胞呼吸作用,变成杀菌剂杀死耐受药物的分枝杆菌,并且在体内迅速清除了结核分枝杆菌感染[32]。这些结果表明,两种末端呼吸氧化酶之间的相互作用可能用于抗结核药物开发。
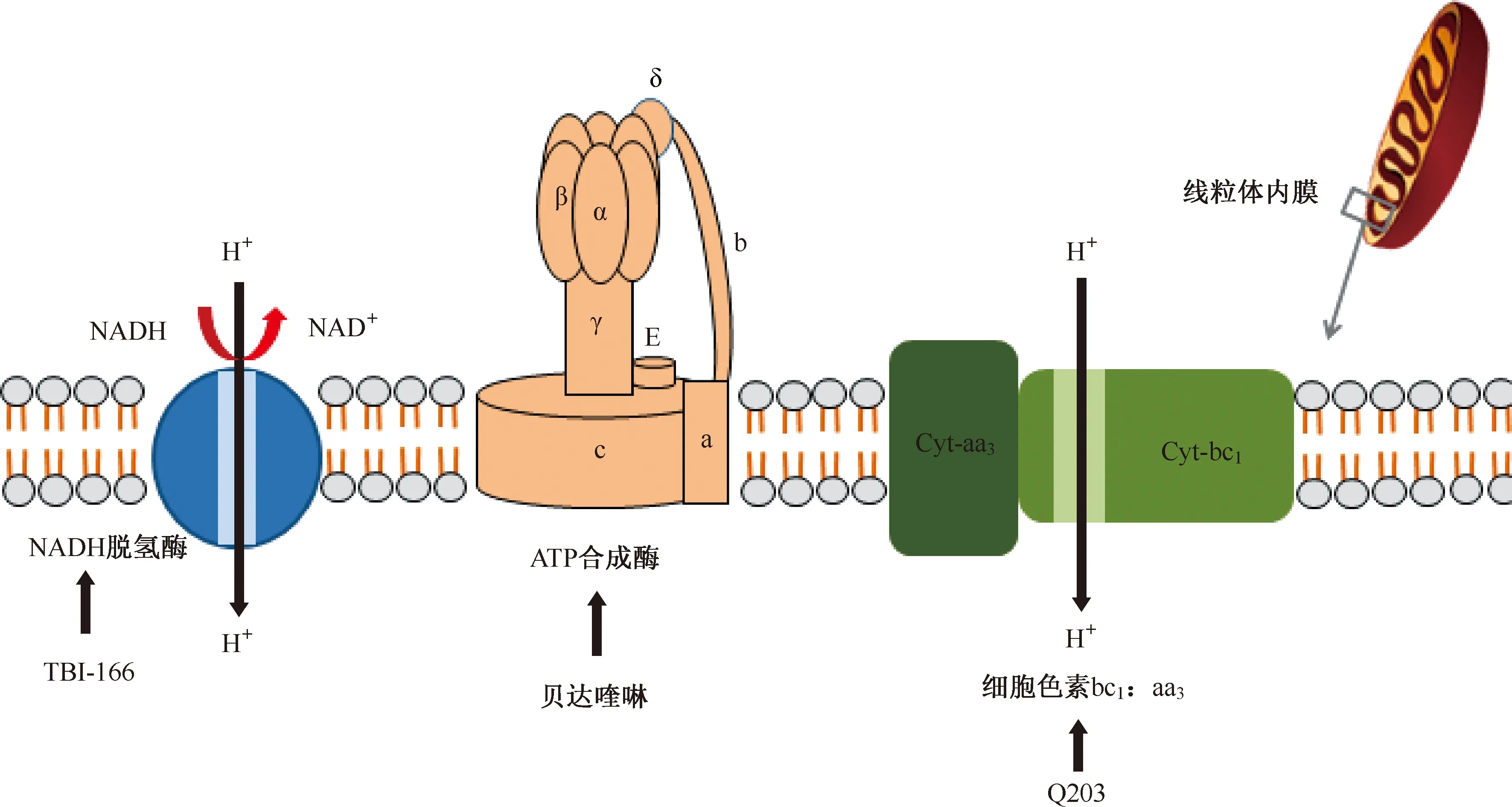
NADH:烟酰胺腺嘌呤二核苷酸,nicotinamide adenine dinucleotide;Cyt:细胞色素,cytochrome;该图参考文献[5]绘制图3 抑制能量代谢的靶点
氯苯吩嗪类化合物抗结核分枝杆菌的活性极好,但其作用机制尚不完全清楚。根据研究结果推测,氯苯吩嗪类化合物可能与分枝杆菌电子传递链中的关键辅助因子甲基萘醌(MK-4)竞争烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)脱氢酶从而影响电子链传递和细胞呼吸。通过研究MK-4对氯苯吩嗪类化合物的抗结核分枝杆菌活性的影响,发现氯苯吩嗪类化合物和MK-4之间的竞争直接影响氯苯吩嗪类化合物对非复制和活跃生长细菌的杀灭效应,试验中表现为补充MK-4阻止了药物对非复制性细菌的活性[33](图3)。
葛兰素史克公司的一项研究显示,新化合物GSK-286通过结核分枝杆菌的胆固醇分解代谢杀灭细菌,相关数据未见报道。
(一)贝达喹啉(TMC207)
贝达喹啉是二芳基喹啉类药物的成员。贝达喹啉靶向结合结核分枝杆菌的ATP合成酶,抑制ATP合成而起到杀菌活性的作用。贝达喹啉的这种独特作用方式最大限度地减少了与现有抗结核药物交叉耐药的可能。贝达喹啉对药物敏感性和耐药性分枝杆菌的MIC≤0.063 μg/ml[31]。目前正在开发的含贝达喹啉新型结核病治疗方案可能会提高耐多药结核病的治愈率。体内外测试和临床试验表明,贝达喹啉具有很强的杀菌作用。
贝达喹啉在2012年获得美国食品药品监督管理局批准用于治疗MDR-TB,世界卫生组织发布了使用临时指南[34],中国于2016年已经批准贝达喹啉用于治疗MDR-TB。根据Ⅱb期临床试验结果,世界卫生组织于2013年发布了关于贝达喹啉用于MDR-TB的治疗手册[35]。
(二)Q203(telacebec)
Q203是一种咪唑并吡啶化合物。Q203抑制分枝杆菌细胞色素bc1复合物的qcrB亚基,抑制细胞呼吸。Q203对临床分离的结核分枝杆菌的50%MIC(50% minimun inhibitory concentration,MIC50)为0.84~1.56 μg/ml[32]。这些数据表明Q203是治疗MDR/XDR-TB有效的临床药物。在慢性结核病小鼠模型中的低剂量效力及其对能量代谢的影响表明,Q203可以缩短结核病小鼠的治疗时间[36]。
(三)TBI-166
TBI-166是由结核病联盟与中国医学科学院药物研究所合作在抗麻风杆菌药物氯法齐明的优化工作中确定的新型氯苯吩嗪类化合物。TBI-166具有良好的药代动力学特性并且没有皮肤变色的不良反应,抗结核的疗效与氯法齐明相近。TBI-166作用机制尚不完全清楚, 研究表明氯苯吩嗪类化合物可能与分枝杆菌电子传递链中的关键辅助因子MK-4竞争NADH脱氢酶,从而影响电子链传递和细胞呼吸[33]。TBI-166的前期研究数据表明其对结核分枝杆菌MIC为0.016 μg/ml,体外抗菌活性显著[37]。
四、展望
近年来,抗结核新药研发领域取得了重大进展。对结核分枝杆菌药物靶点基因组学和耐药机制的研究,使人们更深入了解了抗结核的作用靶点,这些新型靶点的发现给予人类对抗结核分枝杆菌以新的希望。同时,涌现出来的一大批新化合物结构显示出巨大的抗结核潜力,如BTZ043和OPC-167832 的MIC均已经到达“ng/ml”;德拉马尼和普瑞马尼具有多个作用靶点,能够有效杀伤结核分枝杆菌,降低耐药菌株的威胁。医药研究工作者通过合理地对先导物进行结构修饰,有望优化抗结核药物及治疗方案,为患者带来更好的疗效。
