茎瘤固氮根瘤菌ORS571受体TlpA1对琥珀酸的感应机理
2020-03-13隋傅刘晓琳解志红
隋傅, 刘晓琳, 解志红
(1.中国科学院烟台海岸带研究所, 山东 烟台 264003;2.中国科学院大学, 北京 101400; 3.中国科学院海洋大科学研究中心, 山东 青岛 266071)
茎瘤固氮根瘤菌(Azorhizobiumcaulinodans)ORS571属于α-变形菌,能够在宿主毛萼田菁(Sesbaniarostrata)根部和茎上结瘤,也可自生或作为内生菌固氮[1],减少宿主对土壤中氮肥的需求。毛萼田菁具有强的耐盐、耐涝、耐瘠能力,是滩涂盐碱地修复和改造的先锋植物。ORS571作为模式菌株,已完成全基因组测序及注释(NCBI序列号AP009384.1)。其既具备根瘤菌的共性,又可自生固氮,且与宿主植物共生体系固氮效率高,因此更具备研究价值。
趋化是指细菌通过运动响应外界化学物质刺激的过程[2-3]。为应对生存环境的复杂性和生活状态的多样性,ORS571具有数量众多的跨膜趋化受体[4-6]。跨膜趋化受体通常由位于N端与信号分子结合的配体结合域,负责信号传递与内部酶活调控的HAMP结构域和甲基化信号转导结构域组成[7-9]。通过跨膜受体信号转导调节鞭毛进行顺时针或逆时针旋转,从而调节运动状态。趋化受体在根瘤菌与宿主植物建立共生关系的初始阶段具有至关重要的作用。
茎瘤固氮根瘤菌跨膜趋化受体TlpA1由配体结合结构域、HAMP结构域和MCP信号转导结构域组成。其缺失突变株丧失对琥珀酸的趋化能力,固氮能力和竞争结瘤能力均低于野生型[10]。对TlpA1的功能研究有助于深入理解ORS571跨膜趋化受体对琥珀酸等根系分泌物[19-22]的感应机理。本研究对茎瘤固氮根瘤菌ORS571跨膜趋化受体TlpA1进行分析,构建了N端表达菌株,通过体外ITC试验筛选趋化物,从分子水平上初步探究TlpA1对琥珀酸等趋化物的感应机理,以期为今后从分子水平上探究ORS571跨膜趋化受体信号感应和生物学功能提供理论参考。
1 材料和方法
1.1 材料
1.1.1菌株和质粒 供试菌株和质粒详见表1。
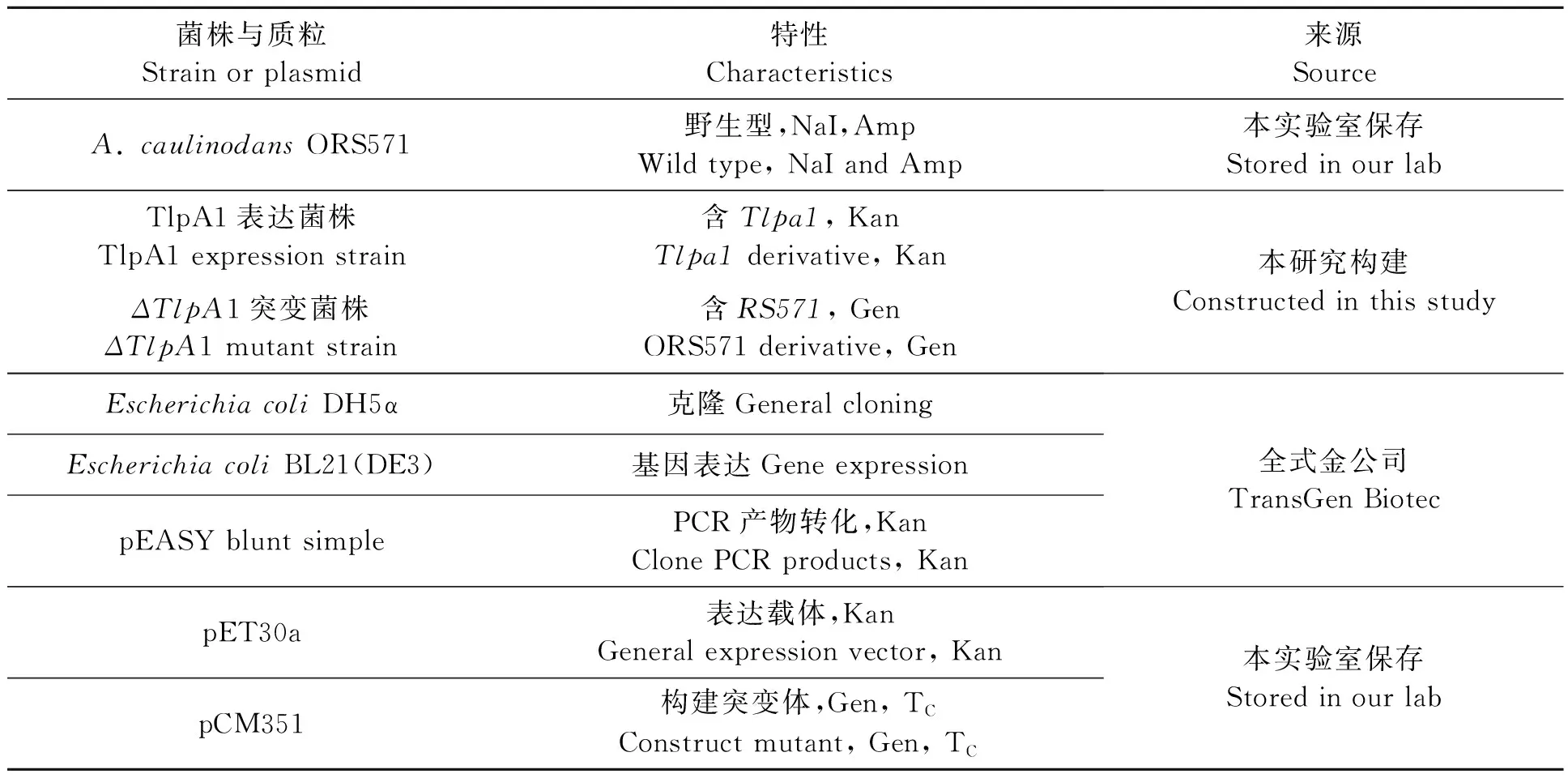
表1 本研究所用菌株和质粒Table 1 Bacterial strains and plasmids used in this study
1.1.2主要试剂和仪器 DNA提取试剂盒、质粒小提试剂盒、切胶回收试剂盒均购自天根生物科技有限公司;DNA聚合酶、T4连接酶、限制性内切酶购自NEB公司;抗生素、镍琼脂凝胶FF购自全式金生物技术有限公司;引物合成及测序由青岛睿科生物科技有限公司完成。
NanoDrop 2000紫外分光光度计,金业德祥科技有限公司;PCR扩增仪和凝胶成像系统,Bio-Rad公司;ReadMax 1000F酶标仪,上海闪谱科技有限公司。
1.2 细菌培养
TY培养基[11]:8 g胰蛋白胨,5 g酵母提取物,5 g NaCl,ddH2O定容至1 000 mL,用于茎瘤固氮根瘤菌ORS571培养,37 ℃。
LB培养基用于大肠杆菌培养,37 ℃。
L3培养基:2 mL 50%乳酸钠,1 mL K-Pi buffer,1 mL NH4Cl,100 μL 1 000×Mg-Na-Mo Mix,ddH2O定容至100 mL,灭菌后分别加入100 μL 1 000×CaCl2,1 000×FeCl3,1 000×Vitamins,用于生物膜试验与絮凝试验。
抗生素工作浓度:NaI(萘啶酮酸)25 μg·mL-1,Kan(卡那霉素)50 μg·mL-1,Gen(庆大霉素)30 μg·mL-1,TC(四环素)10 μg·mL-1,Amp(氨苄青霉素)100 μg·mL-1。
1.3 蛋白质结构域预测
茎瘤固氮根瘤菌ORS571跨膜趋化受体TlpA1蛋白质结构域使用MIST3数据库(https://mistdb.com/genomes/GCF_000010525.1/signal-genes)查询。TlpA1蛋白质结合位点使用Phyre2软件(http://www.sbg.bio.ic.ac.uk/ phyre2/htmL/page.cgi)进行预测。
1.4 N端表达载体构建
通过基因克隆和平末端连接的方法将目的片段接入大肠杆菌外源表达载体上。以天根DNA提取试剂盒提取茎瘤固氮根瘤菌ORS571基因组DNA为模板,用TlpA1-F(5′-CGGGATCCAACG-AGTTGAACAACACG-3′)和TlpA1-R(5′-GC-GTCGACGGTTTGATTCTGCAAGCC-3′)扩增。反应体系总体积50 μL:25 μL 2×GC缓冲液,1 μL 模板DNA,4 μL dNTP混合物,引物各0.5 μL,18 μL ddH2O,1 μL DNA聚合酶。反应程序:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min,4 ℃保存。
将得到的片段与pEASY载体连接并测序,测序结果与NCBI数据库基因序列比对,验证正确后的片段与pET30a载体都使用BamHⅠ和SalⅠ进行酶切。回收的酶切片段与pET30a载体用T4连接酶16 ℃过夜连接,得到pET30a∷TlpA1质粒,将其转入大肠杆菌感受态DH5α中,菌落PCR验证,挑选出验证正确的阳性克隆提取质粒并测序验证。
1.5 原核表达
将1.4中提取的质粒转化接入大肠杆菌感受态BL21(DE3)中,使用TlpA1-F和TlpA1-R这对引物进行菌落PCR验证,挑选验证正确的阳性克隆子,接入5 mL LB液体培养基中过夜培养,取1 mL菌液转接100 mL LB液体培养基,OD600值为0.6时加入30 μL IPTG, 14 ℃、120 r·min-1诱导表达24 h,4 ℃、8 000 r·min-1离心5 min收集菌体,超声破碎细胞,4℃、12 000 r·min-1离心30 min,取50 μL上清溶液,加入20 μL上样缓冲液[0.25 mol·L-1Tris·HCl (pH 6.8) 2.5 mL,0.5 mol·L-1二硫苏糖醇0.39 g,10%SDS 0.5 g,0.5%溴酚蓝0.025 g,50%甘油2.5 mL,混匀],沸水煮20 min,冷却后SDS-PAGE电泳验证目的条带。
1.6 蛋白分离与纯化
1.5中破碎的细胞液使用镍琼脂糖凝胶FF进行分离,镍琼脂糖凝胶 FF装柱,1.6×20 cm,柱床体积为10 mL,用缓冲液1(0.5 mol·L-1,NaH2PO419 mL,0.5 mol·L-1Na2HPO481 mL,NaCl 29.3 g, 加适量水溶解后定容到1 000 mL)平衡2~5个柱床体积,流速为2 mL·min-1,将20 mL细胞破碎液(50 mmol·L-1PBS,pH 7.4,0.5 mol·L-1NaCl)0.45 μm滤膜过滤,上样,流速为1 mL·min-1,用缓冲液1再洗2~5个床体积,流速为2 mL·min-1,用分别含10、20、50、100、200、300、400 mmol·L-1咪唑的缓冲液2(缓冲液1中加入对应浓度的咪唑)进行阶段洗脱,流速为2 mL·min-1,收集各阶段洗脱峰,用SDS-PAGE检测融合蛋白的分子量大小和纯度。
将以上洗脱液使用超滤管进行蛋白纯化,3 000g离心约2 h直至管内液体剩余2 mL左右,加入10 mL缓冲液1,3 000g离心2 h去盐化,将管内残余液体吸出,即纯化后的蛋白,使用NanoDrop 2000紫外分光光度计检测蛋白质浓度,-80 ℃保存。
1.7 蛋白与趋化物相互作用检测
使用等温滴定量热仪(NANO-ITC 2G )检测蛋白与趋化物的相互作用,趋化物种类为茎瘤固氮根瘤菌ORS571利用的常见有机酸:琥珀酸、柠檬酸、苹果酸、脯氨酸。在样品池中加入300 μL待滴定的TlpA1蛋白,注射针中加入50 μL 10 mmol·L-1的趋化物,设置两次滴定间隔为120 s,注射针单次注射体积2 μL,总注射次数25次。使用Origin软件进行数据分析。
1.8 生物膜实验
在以琥珀酸(10 mmol·L-1)为碳源的无氮L3液体培养基中。调节各待测菌株OD600为2.5,取150 μL 菌液接种于1.5 mL的上述培养基中,3个平行实验,37 ℃静置培养5 d后,弃培养液加入0.1% 结晶紫2 mL染色20 min,移除染色液,用蒸馏水洗3~5次,观察各菌株生物膜的形成情况。生物膜的定量测定实验,取150 μL 待测菌液接种至含1.5 mL上述培养基的24孔板中,3次平行实验,37 ℃静置培养5 d后,弃培养液加入0.1% 结晶紫1.7 mL 染色20 min,移除染色液,用蒸馏水洗3~5次,放入培养箱中烘干后,加入30%的乙酸溶解,利用酶标仪测定OD590处的吸光度。
1.9 絮凝实验
以TY培养基过夜培养待测菌株,并调节OD600为1.0。向50 mL 锥形管中加入10 mL 的L3+1/2 N液体培养基(碳源为10 mmol·L-1琥珀酸)和200 μL菌液,将锥形管放置在摇床上。37 ℃、200 r·min-1分别培养24、48、72 h。取出并静置锥形管,吸取上清菌液测定OD600,并定义为ODs,将絮凝沉淀磨碎并与上清混匀,测定混合后菌液的OD600,定义为ODt。
2 结果与分析
2.1 TlpA1 蛋白结构域分析
通过Phyre2预测蛋白质结构与结合位点,结果显示,TlpA1共551个氨基酸,其中位于胞外的29~183氨基酸形成周质跨膜结构域,大小为154个氨基酸(图1A),通过PyMOL蛋白三维结构分析软件对N端配体结合结构域与TlpA1进行比对,结果显示,单独的配体结合结构域(图1B绿色)三维结构与全长蛋白(图1 B蓝色)的N端三维结构类似。蛋白质结合位点的预测结果显示,N端配体结合结构域(图1C)与大肠杆菌K12中负责感应硝酸盐或碳类的组氨酸激酶NarQ胞外部分同源性最高[12]。
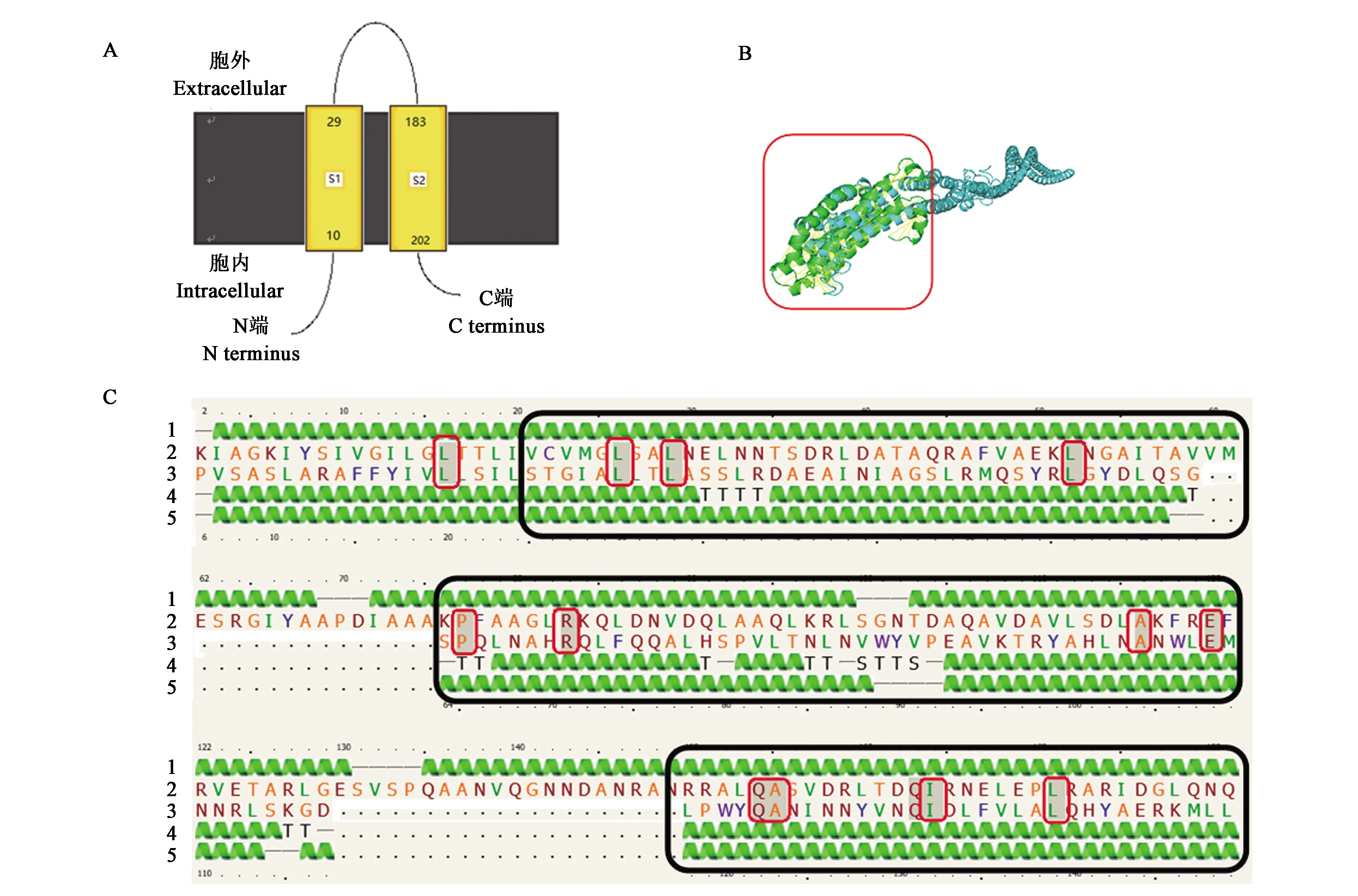
A:跨膜结构;B:蛋白质三维结构,红框代表蛋白重叠部分;C:蛋白质结合位点比较,黑框代表同源性相似序列,红框代表相同氨基酸序列。1—TlpA1预测二级结构;2—TlpA1氨基酸序列;3—NarQ氨基酸序列;4—NarQ已知二级结构;5—NarQ预测二级结构。A: Transmembrane structure; B: Comparison of protein three-dimensional structure, the red box represents the protein overlap; C: Comparison of protein binding site, the black boxes represent homologous similar sequences, the red box represents the same amino acid sequence. 1—Predicted secondary structure of TlpA1; 2—Amino acids of TlpA1; 3—Amino Acids of NarQ; 4—Known secondary structure amino acids of NarQ; 5—Predicted secondary structure of NarQ.图1 TlpA1蛋白质结构Fig.1 TlpA1 protein structure
2.2 TlpA1原核表达结果
构建N端表达菌株,用于蛋白表达。SDS-PAGE电泳结果(图2)显示,在加入IPTG诱导的菌株,细胞破碎后的上清溶液中出现目的条带,大小约为31.48 kD,说明N端表达菌株能够过表达可溶性目的蛋白。扩大细菌培养体积,使用镍琼脂糖凝胶FF分离出上清溶液中的目的蛋白,并使用超滤管进行纯化,紫外分光光度计检测蛋白浓度,约为3.14 mg·mL-1。
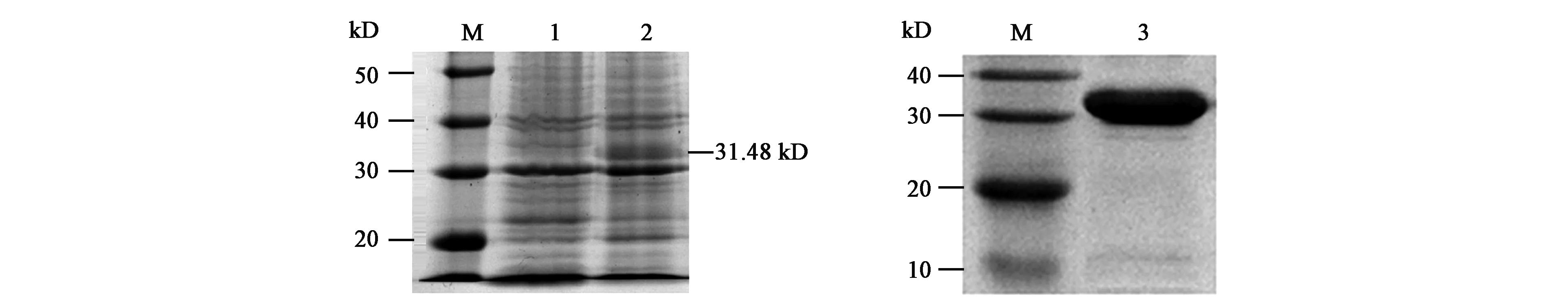
注:M—Maker;1—未加IPTG的上清;2—加入30 μL IPTG的上清;3—纯化的蛋白。Note: M—Maker; 1—Supernatant of cell fragmentation solution without IPTG; 2—Supernatant of cell fragmentation solution with 30 μL IPTG; 3—Purified protein solution.图2 TlpA1 SDS-PAGE电泳结果Fig.2 SDS-PAGE electrophoresis results of TlpA1
2.3 TlpA1与有机酸相互作用分析
为探究受体蛋白TlpA1感应信号的类型,利用等温滴定量热法检测茎瘤固氮根瘤菌ORS571与常见有机酸[22]之间的相互作用。结果表明(图3),琥珀酸与受体蛋白TlpA1之间存在相互作用,即滴定过程中,热流峰值不断下降,热量变化为吸能反应。而柠檬酸与受体蛋白TlpA1的滴定反应中,其热流峰值未出现明显变化,两者之间不存在相互作用。
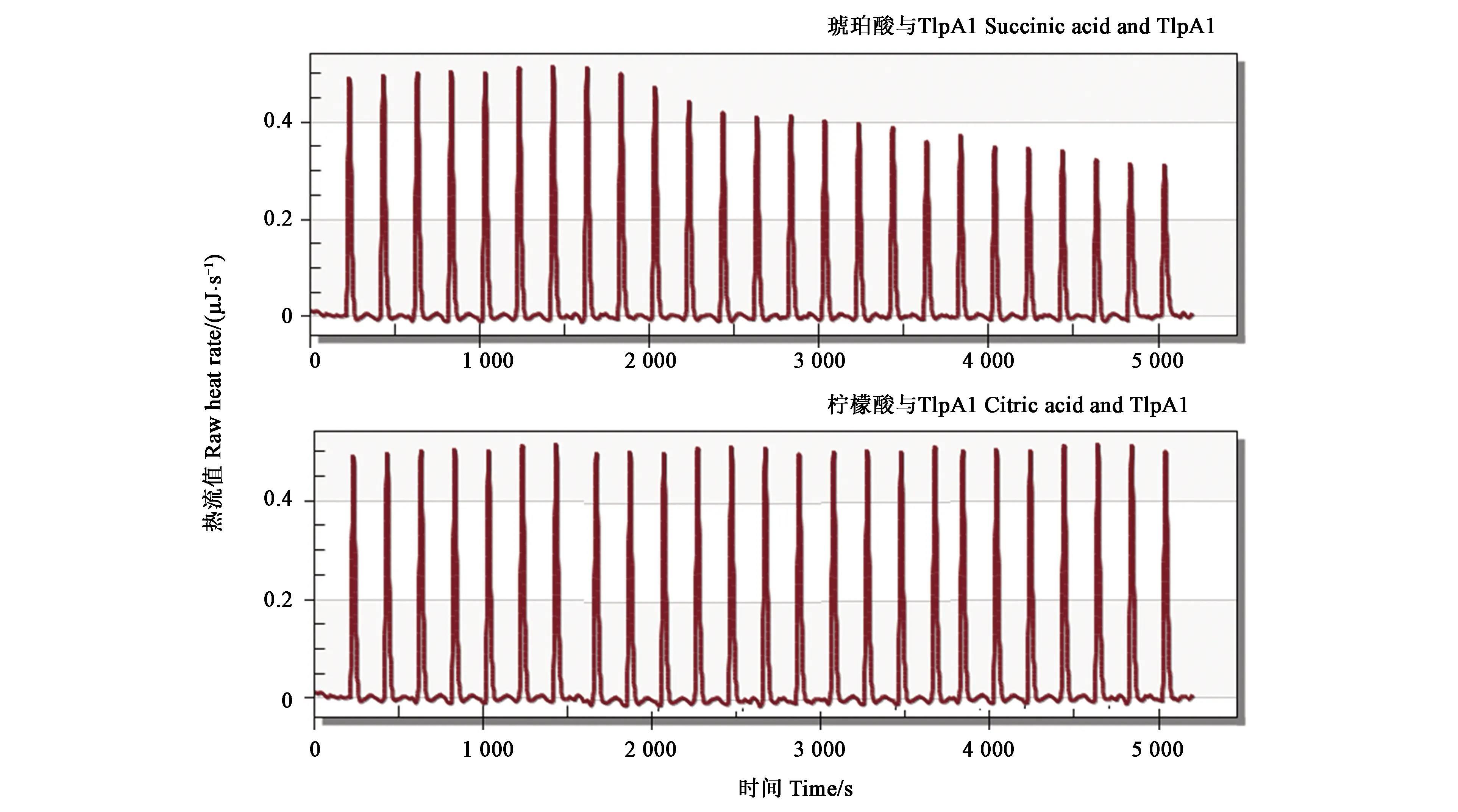
图3 TlpA1 ITC试验结果Fig.3 ITC test results of TlpA1
2.4 野生型与突变株ΔTlpA1生物膜比较分析
为了探究趋化受体基因Tlpa1对茎瘤固氮根瘤菌ORS571生物膜形成的影响。利用L3液体培养基,在无氮的情况下对突变株和野生型的生物膜形成进行定性与定量分析。如图4所示,试管条件下,野生型生物膜形成量多于突变株(白色箭头代表生物膜形成位置),突变株ΔTlpA1生物膜形成能力相比于野生型下降38%。
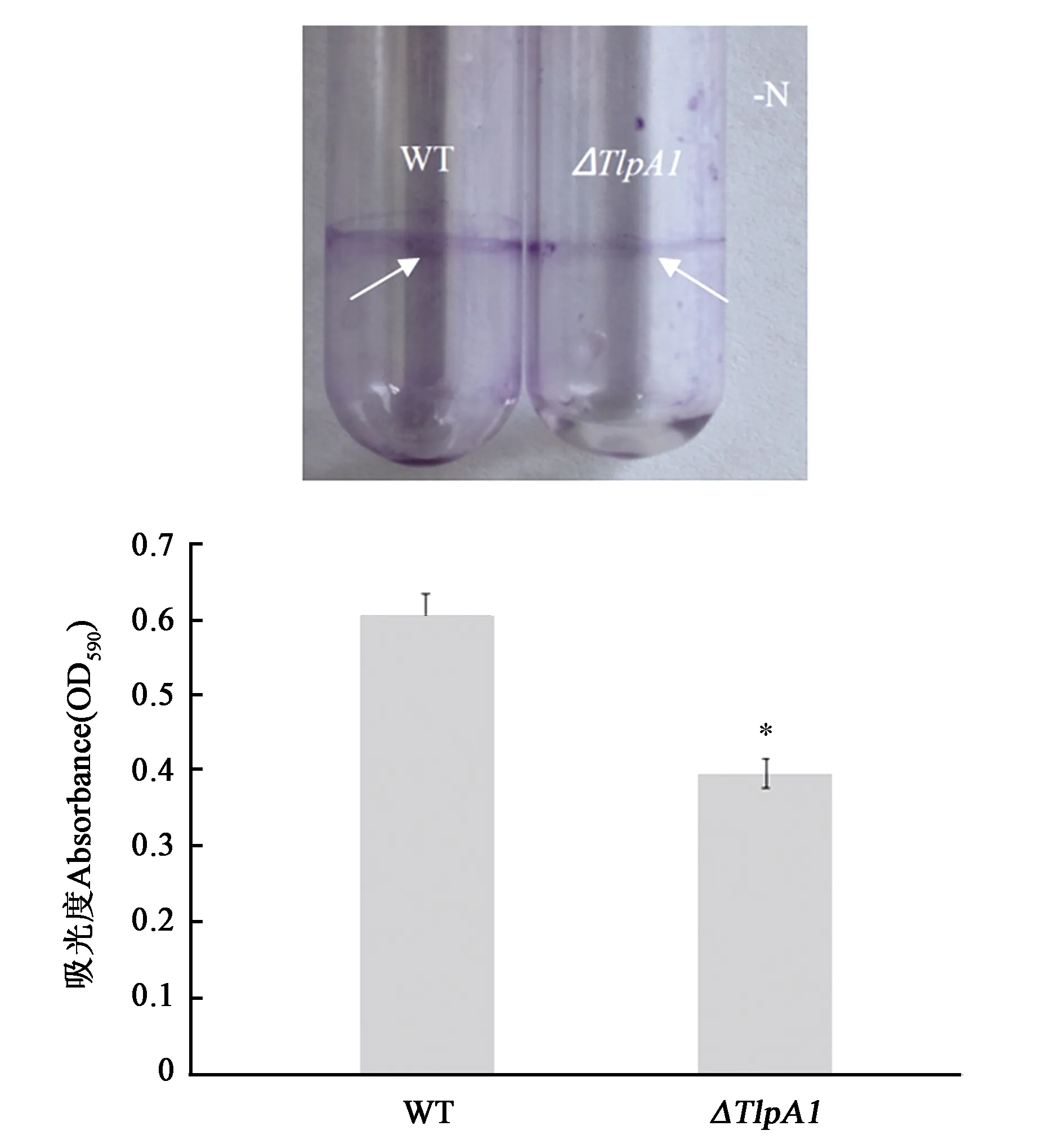
注:白色箭头代表生物膜;*表示与野生型(WT)相比在P<0.05水平差异具有统计学意义。Note: White arrows show biofilm. * indicates significant difference compared with WT at P<0.05 level.图4 ORS571野生型与突变株ΔTlpA1生物膜测定Fig.4 Biofilm formation of wild type and the ΔTlpA1 mutant
2.5 野生型与突变株ΔTlpA1絮凝试验结果
为了研究趋化受体蛋白TlpA1的缺失是否影响凝结能力,对突变株与野生型进行比较。结果(图5)表明,突变株与野生型的细胞絮凝形态(48 h)无明显差异,定量分析结果显示,24和48 h突变株与野生型的凝结量无明显差异,说明趋化受体蛋白TlpA1不影响茎瘤固氮根瘤菌ORS571的凝结能力,生物量随着时间延长增加,故两者在48 h的凝结量高于24 h。
3 讨论
趋化作用是茎瘤固氮根瘤菌ORS571与宿主毛萼田菁建立共生关系的第一步,对宿主植物根系复杂信号的应答依赖于趋化受体信号的输入。本研究利用生物信息学与分子生物学等手段,对茎瘤固氮根瘤菌ORS571趋化受体蛋白TlpA1 与琥珀酸的感应机理进行探究。
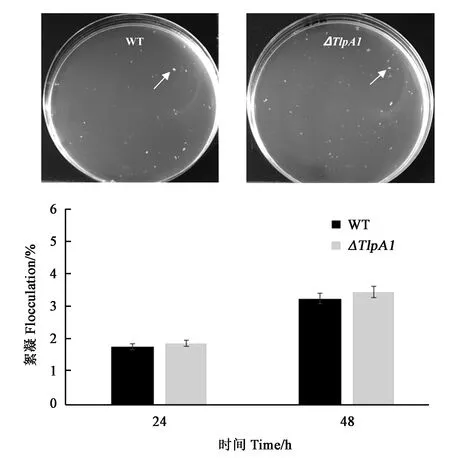
注:白色箭头代表细胞絮凝。Note: White arrows show flocculation.图5 ORS571野生型与突变株ΔTlpA1絮凝Fig.5 Flocculation of wild type and the ΔTlpA1 mutant
趋化受体分为跨膜趋化受体和可溶性趋化受体,对于可溶性受体而言,其感应细胞内信号的结构域常见的有:PAS结构域,负责感应细胞能量代谢[13];锌离子结合域,负责感应锌离子[14];PilZ结构域,负责与细菌第二信使环二鸟苷酸(c-di-GMP)结合[15]。对于跨膜趋化受体来说,其感应胞外信号,主要依赖于其N端胞外部分的周质跨膜配体结合域[16-17]。茎瘤固氮根瘤菌ORS571共有43个跨膜趋化受体,其中37个为跨膜趋化受体,6个为可溶性趋化受体。在基因组中,跨膜趋化受体TlpA1下游为组氨酸激酶CheA,CheA接受外界环境信号后,通过磷酸化将信号向下游传递,是信号转导通路的重要组成部分[18]。在已有研究中,突变株ΔTlpA1对琥珀酸的趋化能力及竞争结瘤能力相比于野生型WT明显降低[10]。本研究从分子层面上解释了TlpA1是通过其N端胞外部分与琥珀酸结合,进而控制茎瘤固氮根瘤菌ORS571对琥珀酸的趋化能力,琥珀酸是植物根系分泌物中常见的有机酸类,有机酸类物质影响细菌对宿主植物的定殖能力[19-21],最近研究表明,琥珀酸也是毛萼田菁种子提取物主要成分之一[22]。
细菌生物膜的形成与其运动能力息息相关。在已有研究中,以琥珀酸为碳源,有氮情况下,突变株ΔTlpA1的生物膜形成能力低于野生型[10]。本研究以琥珀酸为碳源,在无氮情况下,突变株ΔTlpA1生物膜形成能力低于野生型,与有氮条件结果一致,更加充分说明在琥珀酸影响下,TlpA1对茎瘤固氮根瘤菌ORS571生物膜的形成具有调节作用。
细胞絮凝是细菌应对营养匮乏的生长条件而采取的正常生化现象,反映细菌抵抗恶劣生长环境的能力。本研究以琥珀酸作为碳源,在外界存在氮源或固氮条件下,突变株ΔTlpA1絮凝能力与野生型无显著性差别。说明琥珀酸影响下,TlpA1的缺失对ORS571絮凝能力无调控作用。
趋化受体的功能研究在其他根瘤菌中也有较为深入的研究。如豌豆根瘤菌(Rhizobiumleguminosarum),共含有6个跨膜趋化受体(McpB to McpG),McpB负责感应棉子糖,其他趋化受体对常见的有机酸类和氨基酸类无趋化反应[23]。除McpG外,其他趋化受体都参与根瘤菌的结瘤过程[24]。苜蓿根瘤菌(Sinorhizobiummeliloti)趋化研究最为系统,共9个趋化受体,其中7个为跨膜趋化受体,2个为可溶性趋化受体。对于7个跨膜趋化受体(McpS to McpY),McpU的趋化物类型已被分析,负责感应宿主苜蓿根系分泌物中的柠檬酸和所有氨基酸(除了谷氨酸和天冬氨酸),是苜蓿根瘤菌中负责感应氨基酸的重要跨膜趋化受体[25-27]。对ORS571而言,其趋化受体的功能研究还有待进一步探索,本研究方法可用于ORS571其他跨膜趋化受体的研究,以对ORS571跨膜趋化受体更为全面的了解,阐释其与宿主根系分泌物等外界化学物质之间的复杂关系。
