谷子种子高质量总RNA提取方法的优化
2020-03-13王金荣许冰霞尹美强温银元
王金荣 许冰霞 尹美强 温银元
(山西农业大学农学院,山西 太谷 030801)
谷子[Setaria italica(L.) Beauv]属禾本科(Gramineae)植物,谷粒含有丰富的蛋白质、脂肪和维生素[1],营养价值很高[2-3]。随着人们生活方式的改变,市场上对谷子的需求不断增加[4]。种子活力的保持和萌发成苗决定着植物种类的繁衍和生存能力以及生态系统的建成,更直接影响作物的产量,而种子萌发被认为是植物生活周期中最重要和最脆弱的阶段[5],因此研究种子萌发的分子机制有助于提高作物的产量,具有重要的经济和生态意义[6-7]。从植物种子中提取纯度高、完整性好的RNA是进行基因动态表达、cDNA 合成、RNA 序列分析、基因克隆、构建cDNA 文库、体外翻译等分子生物学试验的前提[8]。但谷子中含有较多的蛋白质、多糖和脂质,这些物质会干扰或降解RNA,从而影响RNA的产量和质量[9-11]。其中,多糖表现出与RNA 相似的物理化学性质,并与RNA提取物共沉淀[12]。蛋白质和脂类也会干扰RNA 分离提取,干扰反转录酶- 聚合酶链锁反应(reverse transcription-polymerase chain reaction,RT-PCR),从而影响基因表达研究[13]。
从植物中提取总RNA的方法有很多,主要包括Trizol 法[14]、NAiso Plus 法、SDS 法[15]、异硫氰酸胍法[16]、CTAB 法[17-18]等,但由于植物之间及同一植物不同组织之间的差异,所需的RNA提取方法也不同[19-21]。目前已有报道从蓖麻[8]、甘蓝[10]、花生[11]等植物种子中提取出高质量的RNA,但从谷子中提取RNA的有效方法鲜见报道。本试验以晋谷42、晋谷45、晋谷21、晋谷28、张杂13为材料,通过对现有的RNA提取技术进行结合和改进,同时与NAiso Plus法、CTAB 法进行比较,旨在找出一种能够简单、快速的从谷子干种子中提取出高质量RNA的方法,为谷子萌发相关的后续分子生物学试验奠定基础并为其他禾谷类作物种子的RNA提取提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及前处理试验 试验材料为晋谷42、晋谷45、晋谷21、晋谷28、张杂13,由山西农业大学植物生理实验室提供。
挑选成熟饱满大小均一且谷壳完好无病虫害的5个谷子品种种子,用0.1% HgCl2浸泡消毒10 min,蒸馏水冲洗5~6次[22-23],晾干后用于提取谷子种子总RNA。以晋谷42、晋谷45为萌发材料,消毒后的谷子在蒸馏水中萌发,温度为25℃,相对湿度为60%,分别于萌发6、10、18、24、36、48 h时取萌发种子,直接置于-80℃冰箱保存备用,用于提取不同萌发期谷子的总RNA。
1.1.2 主要试剂 RNAiso Plus 试剂,宝生物工程(大连)有限公司;HCl,成都科龙化工试剂厂;Tris,美国Camycal公司;1%(w/v)聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),美国Camycal公司;2%β-巯基乙醇,上海振品化工有限公司;溴化十六烷基三甲铵(cetyltrimethyl ammonium bromide,CTAB),美国Camycal公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),美国Camycal公司;NaCl,天津凯通化学试剂有限公司;亚精胺(spermidine),上海恒远生物科技有限公司。
RNA提取缓冲液:100 mmol·L-1Tris-HCl(pH值9.0)、1%(w/v)PVP,使用前加入2%β-巯基乙醇。
CTAB 提取液:2%(w/v)CTAB、2%(w/v)PVP、25 mmol·L-1EDTA、100 mmol·L-1Tris-HCl(pH值8.0)、2 mol·L-1NaCl、0.5 g·L-1亚精胺,灭菌,使用前加入2%β-巯基乙醇。
1.2 试验方法
1.2.1 RNAiso Plus 法 按照RNA提取试剂(RNAiso Plus)的操作流程提取谷子的总RNA。
1.2.2 改良RNAiso Plus 法 参照RNAiso Plus 法,并略作修改。每0.1 g 液氮研磨的材料中加入0.7 mL的RNA提取缓冲液,混匀静置15 min,4℃、12 000×g条件下离心10 min,保留上清液;取上清液加入1 mL的RNAiso Plus,混匀室温静置10 min,然后于4℃、12 000×g条件下离心5 min,所得上清液中再加入氯仿(1/5 体积RNAiso Plus)并混合均匀,室温静置5 min,4℃、12 000×g条件下离心15 min,保留上层溶液;将上层溶液转移至另一新的离心管中,加入等体积的异丙醇,充分混匀后在室温静置10 min,4℃、12 000×g条件下离心10 min,弃上清液,加入1 mL 75%乙醇洗涤沉淀后室温干燥,最后加入30 μL RNase-free 水溶解,并置于-80℃保存备用。
1.2.3 CTAB 法 参照陶倩等[24]的方法。
1.2.4 RNA 完整性的检测 取4 μL 总RNA提取产物,利用1.0%琼脂糖凝胶进行电泳,电压为220 Ⅴ,电泳30 min。在Universal Hood Ⅱ凝胶成像仪(美国Bio-Rad公司)上观察RNA 电泳条带,初步分析RNA提取物的清晰度和完整性。
1.2.5 RNA 纯度的检测 取1 μL 总RNA提取产物,以RNase-free 水为空白对照,在BioDrop 上检测RNA的质量和浓度。
1.2.6 RT-PCR检测 以改良RNAiso Plus 法提取的5个谷子品种的总 RNA,参照反转录试剂盒PrimeScript® RT Reagent Kit With gDNA Eraser 反转录说明书[宝生物工程(大连)有限公司]进行反转录合成cDNA,以合成的cDNA为模板,根据谷子actin基因设计引物并进行扩增,上游引物:5′-TGCTCAGTGGAGG CTCAACA-3′;下游引物:5′-CCAGACACTGTACTTGCG CTC-3′,扩增体系为10 μL,包括10×PCR Buffer 1 μL,TaKaPa Tap 0.05 μL,dNTP Mixture(2.5 mmol·L-1)0.8 μL,cDNA(0.1 μg·μL-1) 1 μL,上、下游引物(10 μmol·L-1)各1 μL,ddH2O 5.15 μL。扩增程序:94℃预变性5 min;94℃变性30 s,55℃复性30 s,72℃延伸1 min,共30次循环;72℃延伸10 min。反应完成后,用1%琼脂糖凝胶电泳30 min,用凝胶成像系统观察电泳条带并拍照记录。
2 结果与分析
2.1 谷子种子总RNA的三种提取方法对比分析
由图1可知,RNAiso Plus 法、改良RNAiso Plus 法和CTAB 法均能从晋谷42、晋谷45 中提取出总RNA,28S、18S和5S条带均清晰可见,且28S均比18S 亮,条带也未见弥散现象,说明这3种方法提取的总RNA均没有明显的降解现象且比较完整。此外,改良RNAiso Plus 法提取的RNA 28S和18S条带的亮度和清晰度优于其他2种方法,且28S的亮度约为18S的2倍,说明改良RNAiso Plus 法提取的总RNA 质量和完整性较RNAiso Plus 法和CTAB 法好。
由表1可知,用RNAiso Plus 法和CTAB 法提取的晋谷42、晋谷45的总RNA 浓度相近,晋谷42 总RNA的浓度为237.1~252.0 μg·mL-1,晋谷45 总RNA的浓度为303.7~358.5 μg·mL-1,用改良RNAiso Plus 法提取的晋谷42 总RNA 浓度为443.9 μg·mL-1,晋谷45 总RNA 浓度为416.7 μg·mL-1,明显高于RNAiso Plus 法和CTAB 法提取的总RNA 浓度。理论上RNA的A260/A280值为2,高质量RNA的A260/A280值应介于1.8~2.0 之间[25];A260/A280值超过2.0 则RNA 有降解或含有高盐等杂质的污染,A260/A280值低于1.8 则有蛋白或苯酚存在[26]。RNAiso Plus 法提取的晋谷42总RNA的A260/A280值为1.848,质量和纯度相对较好,而晋谷45 总RNA的A260/A280值低于1.8,说明RNA中含有蛋白质或苯酚;CTAB 法提取的晋谷42、晋谷45 总RNA的A260/A280值均大于2.0,所以RNA可能有轻微的降解或有高盐等杂质的污染;而改良RNAiso Plus 法提取的晋谷42 总RNA的A260/A280值为1.949、晋谷45 总RNA的A260/A280值为1.908,表明改良RNAiso Plus 法提取的RNA 纯度更高,质量更好。

图1 谷子总RNA 凝胶电泳图Fig.1 Total RNA gel electrophoresisof millet

表1 谷子干种子总RNA 纯度分析Table1 Purity analysis of total RNA extracted from dry millet seeds
2.2 改良RNAiso Plus 法提取不同品种谷子干种子总RNA分析
采用改良RNAiso Plus 法提取晋谷42、晋谷45、晋谷21、晋谷28、张杂13 干种子的总RNA。由图2可知,晋谷28 总RNA的5S条带稍亮,有轻微的降解,但总体来看,5个谷子品种的总RNA 图像全部有清晰条带,28S 亮度最高,18S次之,5S 亮度最不明显,表明改良RNAiso Plus 法提取的这5个谷子品种的RNA 质量和完整性良好。
改良RNAiso Plus 法从晋谷21、晋谷28、张杂13中提取的总RNA 浓度分别为344.8、320.1、444.2 μg·mL-1,且A260/A280值均在1.8~2.0 之间(表2),说明这些总RNA的纯度和质量良好。
此外,用改良RNAiso Plus 法提取的5种干种子总RNA 经反转录后,用PCR 扩增actin基因片段,进一步检测所提取的RNA是否可以用于后续研究。由图3可知,5个谷子品种的总RNA均可扩增出单一产物,且带型清晰,说明改良RNAiso Plus 法提取的RNA 能用于RT-PCR 反应等以RNA为基础的研究分析。
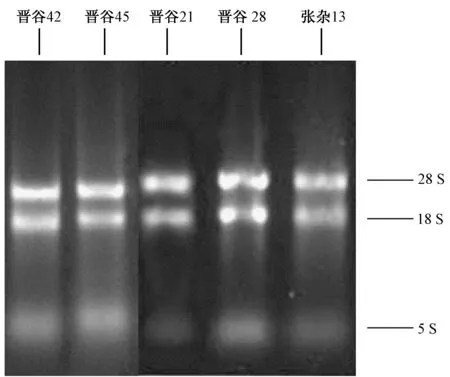
图2 改良RNAiso Plus 法提取的谷子干种子总RNA 凝胶电泳图Fig.2 Total RNA gel electrophoresis of dry millet seeds extracted by modified RNAiso Plus method

表2 改良RNAiso Plus 法提取的谷子干种子总RNA 纯度分析Table2 Purity analysis of total RNA extracted from different varieties of dry millet seeds by modified RNAiso plus method
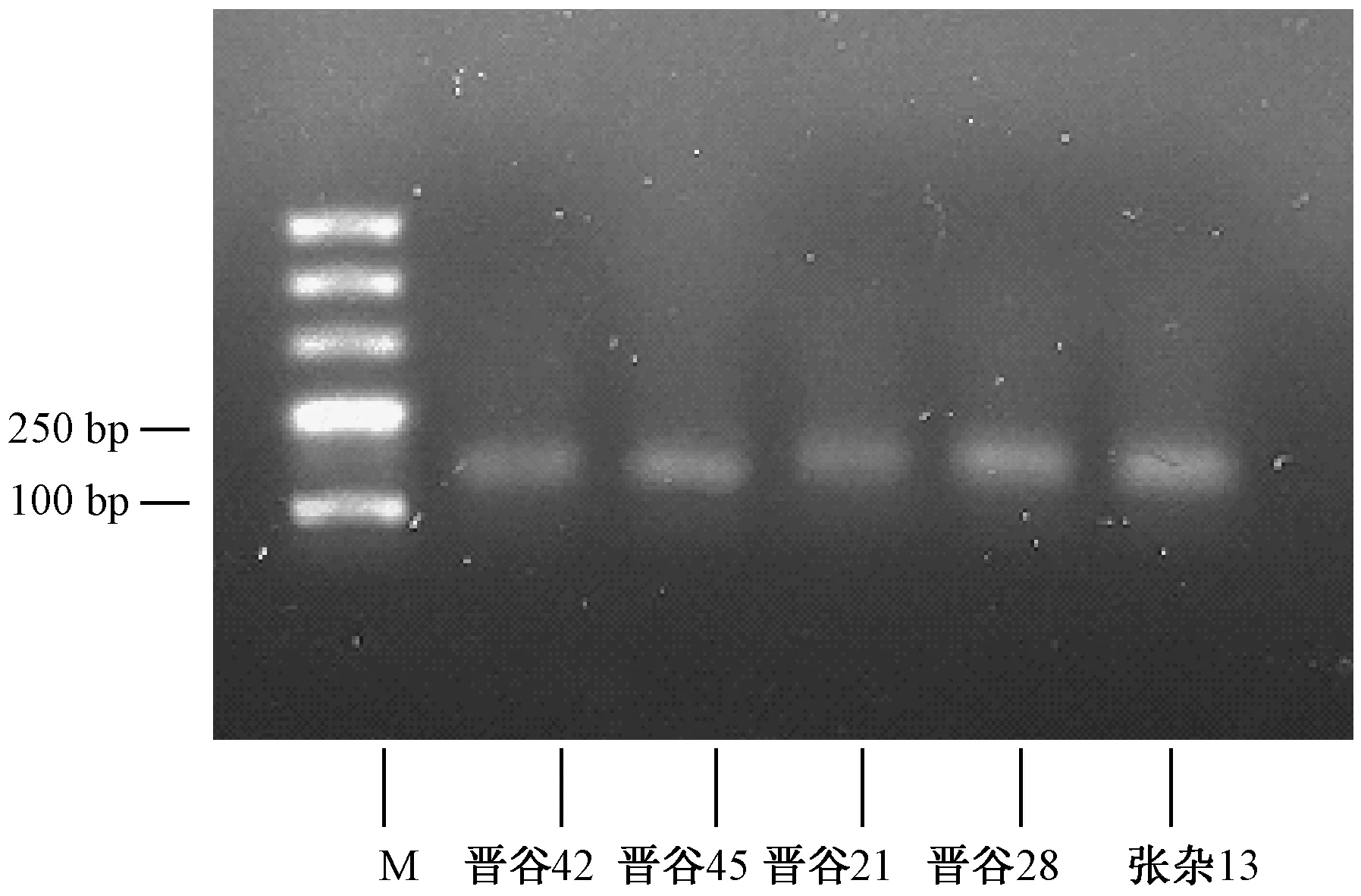
图3 改良RNAiso Plus 法cDNA 扩增结果Fig.3 Results of cDNA amplification by modified RNAiso Plus method
2.3 改良RNAiso Plus 法提取谷子不同萌发期总RNA分析
由图4可知,改良RNAiso Plus 法提取的晋谷42、晋谷45 萌发6、10、18、24、36、48 h时的总RNA,所有条带均清晰可见,且未见拖带弥散现象,各条带中均为28S 最亮,其次是18S,5S 最模糊,说明采用改良RNAiso Plus 法提取的晋谷42、晋谷45 不同萌发期的RNA均完整性好,未发生降解。
由表3可知,用改良RNAiso Plus 法从晋谷42 不同萌发时间提取的总RNA 浓度在290~542 μg·mL-1之间,晋谷45 不同萌发时间提取的总RNA 浓度在450~590 μg·mL-1之间,2个品种的A260/A280值均在1.8~2.0 之间,说明这些RNA的纯度高。
用改良RNAiso Plus 法提取的晋谷42、晋谷45总RNA 经反转录成cDNA,用PCR 扩增actin基因片段,以检测所提取的RNA是否可以用于后续研究。由图5可知,晋谷42、晋谷45 不同萌发时期的总RNA均可扩增出单一产物,且带型清晰,说明该方法提取的RNA 能用于RT-PCR 反应等以RNA为基础的研究分析。

表3 改良RNAiso Plus 法提取的谷子不同萌发期总RNA 纯度分析Table3 Analysis of total RNA purity of millet extracted by modified RNAiso Plus method at different germination time

图4 改良RNAiso Plus 法提取的谷子不同萌发总RNA 凝胶电泳图Fig.4 Electrophoretogram of total RNA gel extracted by modified RNAiso Plus method

图5 不同萌发时间的谷子总RNA的cDNA 扩增结果Fig.5 CDNA amplification of total RNA of millet at different germination times
3 讨论
提取高质量、完整性好的RNA是分子生物学试验的一个关键环节[27],但是在提取过程中微量的RNA酶就会使RNA 降解,磨样时组织的破碎程度,组织中的蛋白质、脂质、多酚等物质的含量也会严重影响RNA的提取质量[28],进而影响下游的试验操作。谷子种子中含有丰富的脂质、蛋白质和酚类等物质,干扰了RNA的提取,而常用的RNA提取方法难以除掉谷子中的杂质。本试验先采用了3种方法提取谷子种子总RNA,其中,RNAiso Plus 法简单快速,但谷子中蛋白质、脂质和糖类等物质较多,此方法除不干净,容易有蛋白质残留;CTAB 法能去除蛋白质、脂质等物质,但其步骤繁琐,用时较长,导致RNA 在提取过程中容易降解并且会有试剂残留,影响RNA 质量;改良RNAiso Plus 法提取的RNA 质量、纯度和浓度明显优于其他2种方法,且步骤简单,用时较短。之后用改良RNAiso Plus 法提取晋谷21、晋谷28、张杂13的干种子总RNA,并提取晋谷42和晋谷45 萌发期的总RNA,发现提取的总RNA 完整性、浓度和质量良好,并对改良RNAiso Plus 法提取的5个谷子品种和不同萌发期的总RNA进行RT-PCR检测,发现所有RNA均可扩增出单一产物且条带清晰,说明采用改良RNAiso Plus法提取的谷子总RNA 质量良好,可用于后续的分子生物学试验。
本试验在前人研究[8,13]的基础上对RNAiso Plus法进行改良,改良缓冲液中含有PVP和β-巯基乙醇。PVP 具有较强的结合酚类化合物的能力,能与多酚形成稳定的复合物,将酚从核酸中游离,PVP和β-巯基乙醇可防止酚类化合物氧化,有效降低了酚类物质的影响[29-30]。β-巯基乙醇还可促进核蛋白复合体的解离,将RNA 释放到溶液中;且这些成分作为还原剂在一定程度上可抑制核酸水解酶的作用,所以改良RNAiso Plus 法提取的RNA 纯度更高。采用CTAB 法可从水稻、豌豆和莲雾等种子中成功提取到高质量的RNA[31-32],但较难在谷子种子里提取成功,容易出现降解,凝胶电泳时经常会出现拖带现象,所以在提取RNA时,应对不同的植物做适当调整。
4 结论
本研究结果表明,RNAiso Plus 法提取的谷子RNA中有蛋白质残留,影响了RNA 质量;CTAB 法提取时间较长且步骤繁琐,容易使谷子RNA 降解;改良RNAiso Plus 法提取谷子RNA 完整性好、浓度和质量高,步骤简单,用时相对较短等优点,且适用于多个谷子品种,可以推广应用于谷子萌发期和不同品种谷子总RNA的提取。
