基于nanoUPLC-MS/MS的螺旋藻游离肽组成分析
2020-03-13褚宁宁陈雨豪陈娟娟陈海敏骆其君
褚宁宁 陈雨豪 陈娟娟 马 斌 陈海敏 骆其君
(宁波大学,农产品质量安全危害因子与风险防控国家重点实验室,浙江 宁波 315211)
钝顶螺旋藻(Spirulina platensis)自上个世纪60年代被发现以来,一直被视为有益健康的食品补充剂。螺旋藻富含蛋白质,其含量高达64.7%以上。此外,螺旋藻还含有大量的必需氨基酸、微量营养素和各种生物活性物质,如维生素B、叶黄素、海胆酮、玉米黄质,以及丰富的矿物质,如钾、钙、磷、铜、铁等[1-2],具有抗氧化、抗过敏、抗菌、抗肿瘤等活性。因此,螺旋藻可为人体提供所需的营养物质,具有较高的营养价值,被广泛应用于食品、医疗、美容、农业等行业,联合国粮农组织推荐其为“全球人类最理想的食品”和“人类21世纪最佳保健品”[3]。可见螺旋藻及其活性成分的研究和开发具有深远的意义。
生物活性肽(biologically active peptide)是一类由氨基酸通过肽键连接而成的化合物,具有溶解性高、黏度低、易消化、易吸收等优点。目前,食用型活性肽包括降压肽、抗氧化肽、抗菌肽、抗肿瘤肽等[4],已成为食品界最热门的话题之一。藻类多肽大部分为二肽到二十肽,分子量分布于300~3 000 Da 之间,如毕秋芸[5]发现裙带菜(Undaria pinnatifida)多肽主要由低分子量的肽段组成,其中低于3 000 Da 分子量肽段部分占总峰面积的95%以上。在椭圆小球藻(Chlorella ellipsoidea)的碱性蛋白酶水解产物中分离获得四肽VEGY,分子量为467 Da[6];在球等鞭金藻(Isochrysis galbana)中水解和纯化获得七肽YMGLDLK[7]。海带(Laminaria japonica)中分离得到8个抗高血压的小肽,分别为二肽到五肽(300~650 Da)[8];在红毛菜(Bangia fusco-purpurea) 中提取出2个血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽:十三肽 ALLAGDPSVLEDR (1 355 Da)和十 七 肽VVGGTGPVDEWGIAGAR(1 640 Da)[9]。早在1992年已有研究证明螺旋藻具有较强的抗氧化作用,其抗氧化作用高于合成氧化剂丁基羟基茴香醚(butyl hydroxy anisd,BHA)和生育酚,且十分稳定[10],其中螺旋藻中的GMCCSR 肽已被证实具有抗氧化活性[11]。Lu 等[12]从螺旋藻的碱性蛋白酶消化物中分离得到ACE 抑制肽Ile-Gln-Pro,自发性高血压大鼠服用剂量为10 mg·kg-1的Ile-Gln-Pro数小时后,收缩压和舒张压明显降低,表明螺旋藻中的ACE 抑制肽可用于高血压的防治。这些活性肽多数为蛋白酶解后的产物,其稳定性受酶解工艺的影响较大。天然存在的活性肽除了可以蛋白质部分水解产生之外,生物体内还有许多的游离活性肽存在。而游离肽是小肽,一般含有2~20个氨基酸,可直接通过提取蛋白之后经超滤离心的方法获得,具有操作简单、稳定性强等特性,因此开发活性游离肽产品有着极大的发展前景。
目前,常见多肽的鉴定方法有非质谱法和质谱法,非质谱法包括DNA 顺序分析法和Edman 化学降解测序法,由于在N 端封闭的蛋白质上很难发生Edman 反应,且这种方法灵敏度低较难实现高通量分析[13],具有一定的局限性,而液相色谱-质谱联用技术具备液相色谱的强分离能力和质谱的高灵敏度等特点,已被广泛应用于蛋白质组学研究。蛋白质组学的概念最早由澳大利亚的科学家Wilkins和Williams 于1994年提出[14],即通过研究机体内所有蛋白质的组成、表达水平、翻译后修饰及其功能揭示生命现象的本质[15-16]。近年来,随着各种高分辨、高灵敏度的质谱仪的出现,结合图谱解析方法和生物信息学相关软件MASCOT、PEAKS Studio、SEQUEST、SWISS-PROT、Tr EMBL和X! Tandem 等[17],使得质谱技术成为研究蛋白质结构和序列鉴定中的一项核心技术[18]。此外,翻译后修饰(posttranslational modification,PTM)分析和定量水平的发展,进一步提高了基于质谱技术的蛋白质组学的实用性[19]。
本研究基于在线纳喷离子源的超高效液相色谱和四极杆-静电场轨道阱高分辨质谱联用(nanoUPLC-Q ExactiveTM-MS)技术,分别采用数据库搜索法和从头测序法,系统分析螺旋藻中游离肽的种类和相对含量,并鉴定相应的蛋白质,试图寻找具有活性的功能肽,以期为螺旋藻游离多肽产品的稳定开发和应用提供理论依据。
1 材料与方法
1.1 试验材料
新鲜的钝顶螺旋藻藻泥,由云南丽江程海保尔生物开发有限公司提供。
1.2 主要仪器与设备
VCX750 超声波细胞破碎仪,美国SONICS公司;1-16K 低温高速离心机,美国Thermo Fisher 科技有限公司;XS-105DU 电子分析天平,梅特勒-托利多国际贸易有限公司;FreeZone 冷冻干燥机,美国Labconco公司;Cascada Ⅰ超纯水系统,美国Pall公司;3KD 超滤离心管,美国Millipore公司;超高效液相色谱Nano ACQUITY UPLC 系统(Waters Corporation,Milford,MA),配备在线纳喷离子源的四极杆-静电场轨道阱Q ExactiveTM质谱仪美国Thermo Fisher 科技有限公司。
1.3 试验方法
1.3.1 游离肽的制备 将新鲜的螺旋藻泥与纯净水按料液比1 ∶30 搅拌均匀,冰浴超声5 min(超声功率为500 W、超声6 s、间隔9 s),超声后的溶液在4℃、10 000 r·min-1条件下离心20 min,取上清液,冻干。冻干粉用超纯水复溶(浓度为3%),经3 kDa 超滤管离心30 min,收集管底溶液,即为游离多肽溶液,冷冻干燥后于-20℃冰箱保存备用。
1.3.2 游离肽含量的测定 游离肽含量按照公式计算:

式中,螺旋藻蛋白质总质量为螺旋藻进行蛋白提取得到蛋白溶液,冻干后称重得到的蛋白质总质量。
1.3.3 nanoUPLC-Q ExactiveTM-MS 分析 采用nanoUPLC-Q ExactiveTM-MS 仪对提取的螺旋藻游离肽进行分析。捕集柱为Thermo Fisher Scientific Acclaim PepMap C18(100 μm×2 cm,5 μm),分析柱为Acclaim PepMap C18(75 μm×25 cm,1.9 μm),流动相:H2O(A)和0.1%甲酸-乙腈(B)。采用梯度洗脱模式:0~120 min,5%~42%B。进样体积6 μL,流速300 nL·min-1。
Q ExactiveTM质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS 采集间切换。一级质谱在70 K质量分辨率下获得全扫描谱图(m/z)= 300~1 800;AGC target=3e6;最大进样时间为60 ms;所带电荷数为2~7;动态排除时间20 s。二级质谱MS/MS:采用高能碰撞解离(high-energy collision dissociation,HCD)模式,分辨率为17.5 K;电喷雾电压2 kV,碰撞能量为27 eV,隔离宽度为2.2;AGC target=5e5;最大进样时间为50 ms;采用ESI(纳米喷雾)离子源,碎片模式:高能(collision induced dissociation,CID)(y和b 离子)。电喷雾电压2 kV。其中,高能诱导裂解技术(higher energy collision induced dissociation,HCD)是一项新型的质谱裂解技术,与离子阱质谱常用的碰撞诱导解离技术CID相比,HCD 技术提供了稳定的高能裂解方式,并可改善CID 裂解中产生的低质量碎片丢失(cutoff)效应。
1.3.4 数据库搜索 串联质谱图经过PEAKS Studio version X (Bioinformatics Solutions Inc.,滑铁卢,加拿大)分析。PEAKS DB 对数据库(21494 entries)搜库,设置非酶切。碎片离子质量容许误差:0.05 Da,母离子质量容许误差:7 ppm,可变修饰:氧化(M) 15.99、脱酰胺(NQ) 0.98、乙酰化42.01。蛋白卡值为-10lgP≥20,至少含1 特异性肽段;肽段卡值为-10lgP≥20。
1.3.5 从头测序(de novosequencing) 软件PEAKS先将得到的图谱进行预处理,将噪声过滤,图谱峰聚合,列出候选肽段。然后依据每个峰的碎片离子,计算y 离子和b 离子的匹配分值。最后通过计算该峰附近的氨基酸残基使总分值最大,保留最好的候选肽段,同时加入亚胺离子、中性丢失离子和内部解离离子的分值进行评估[20]。
2 结果与分析
2.1 螺旋藻多肽鉴定与分析
游离肽含量占螺旋藻蛋白质质量的13.96%,占螺旋藻总量的10.24%,说明螺旋藻游离肽在螺旋藻粗蛋白中含量较高,可作为食品或药品的有效成分进行开发利用。
经分析螺旋藻游离肽样品,分别获得游离肽的分子量、电荷和保留信息,再通过二级质谱分析,获得二级碎片离子。根据母离子分子量和碎片离子的打分值,在数据库里筛选出一个与该二级谱图匹配度最高的多肽序列,该方法为多肽数据库比对法。对于数据库中未匹配到的多肽,可利用多肽从头测序技术,即利用碎片离子的质量差,得知对应的氨基酸残基。因此分别采用数据库比对和从头测序两种多肽检测技术,可以对螺旋藻游离肽进行全面筛选。经过前期肽段质控(false discovery rate,FDR)或得分,检测到所有的肽段数量为4 485个;利用从头测序技术鉴定得到多肽序列有20 597个。
2.1.1 数据库比对结果分析 采用数据库比对法一般对肽段的序列长度有一定要求,如果肽段序列过短(如小于7个氨基酸长度),即使得到有效匹配也会被数据库匹配法认为随机性过高而舍弃。结果显示,通过数据库匹配后得到的螺旋藻游离肽共有4 485个,分别含有7~37个氨基酸,即最小的游离肽为七肽,最大的游离肽为三十七肽,分子量分布在500~3 000 Da之间,电荷数为1~7,游离肽中峰面积最大为3.02×109。将数据库匹配得到的游离肽按照氨基酸序列分类,并利用面积归一化法计算游离肽的百分含量。结果如图1-A所示,十肽的百分含量最高,为15.95%,共有631个;其次为十一肽,共有600个,百分含量为14.51%;第三是九肽,共有616个,百分含量为14.09%。此外,还检测到七肽350个、八肽495个、十二肽565个、十三肽423个、十四肽270个、十五肽191个、十六肽126个、十七肽84个、十八肽38个、十九肽27个以及二十肽24个,其百分含量依次为6.58%、14.48%、11.38%、9.62%、5.17%、4.35%、2.19%、0.72%、0.56%、0.41%、0.27%。其余二十肽以上的游离肽较少,仅有38个,其百分含量为0.68%。指标-10lgP 定义了对应谱图鉴定的可信度,数值越大表明匹配结果越好。因此,根据游离肽的百分含量和-10lgP值,表1列出了百分含量最多的20个游离肽相关信息。17个游离肽带2个电荷,其余3个游离肽带3个电荷,它们总的百分含量高达15.94%,分别为八肽到十五肽,分子量范围为890~1 500 Da。此外,百分含量最高的游离肽为九肽AIESPQRPL,分子量为1 009 Da,占比高达1.98%。
2.1.2 从头测序结果分析 利用从头测序法共鉴定出20 597种游离肽,且结果与数据库比对法得到的游离肽数据无重叠,但与数据库比对法结果中不同的是,从头测序中最短的游离肽是二肽,最长的是三十六肽。利用面积归一化法计算游离肽的百分含量(图1-B),98.35%的游离肽均小于十五肽,分别为二肽19个、三肽374个、四肽1 289个、五肽2 658个、六肽3 465个、七肽2 718个、八肽2 178个、九肽1 886个、十肽1 776个、十一肽1 373个、十二肽1 044个、十三肽712个、十四肽489个、十五肽349个,而十六肽到三十六肽共有367个。含量排在前三位的分别为五肽、六肽和四肽,其中,五肽的百分含量最高,占多肽总含量的24.09%。
ALC(amino acid local confidence)为从头测序数据结果的置信度,一般ALC>80%较为可信,ALC>95%表示非常可信。基于此,表2列举了从头测序结果中ALC>95%、百分含量最高的20个游离肽信息(表2)。结果显示,这20个游离肽分布于四肽到六肽,其中四肽有7个,分子量在400~500 Da 范围内;五肽有10个,分子量大小介于469~570 Da 之间;六肽有3个,分子量分别为717、719、672 Da。此外,有19个多肽均带有1个电荷,仅VFADLR 带有2个电荷。
2.2 蛋白质分析
通过上述游离肽分析结果,结合PEAKS Studio 蛋白质组学分析软件,设置整体质控参数。对于大规模蛋白质鉴定,通过对用于蛋白质搜索的原始数据库的氨基酸序列进行倒排或置乱,生成一个错误数据库,对数据进行重新搜索建立错误发现率(false discoveryrate,FDR),来自错误数据库的任何命中都将对FDR有影响,这个值通常在1%左右。在鸟枪蛋白质组学试验中,通过去除仅由一个肽段识别的所有蛋白质,可以增加其置信度。本试验设置FDR<1%,得到了高可信的鉴定图谱。
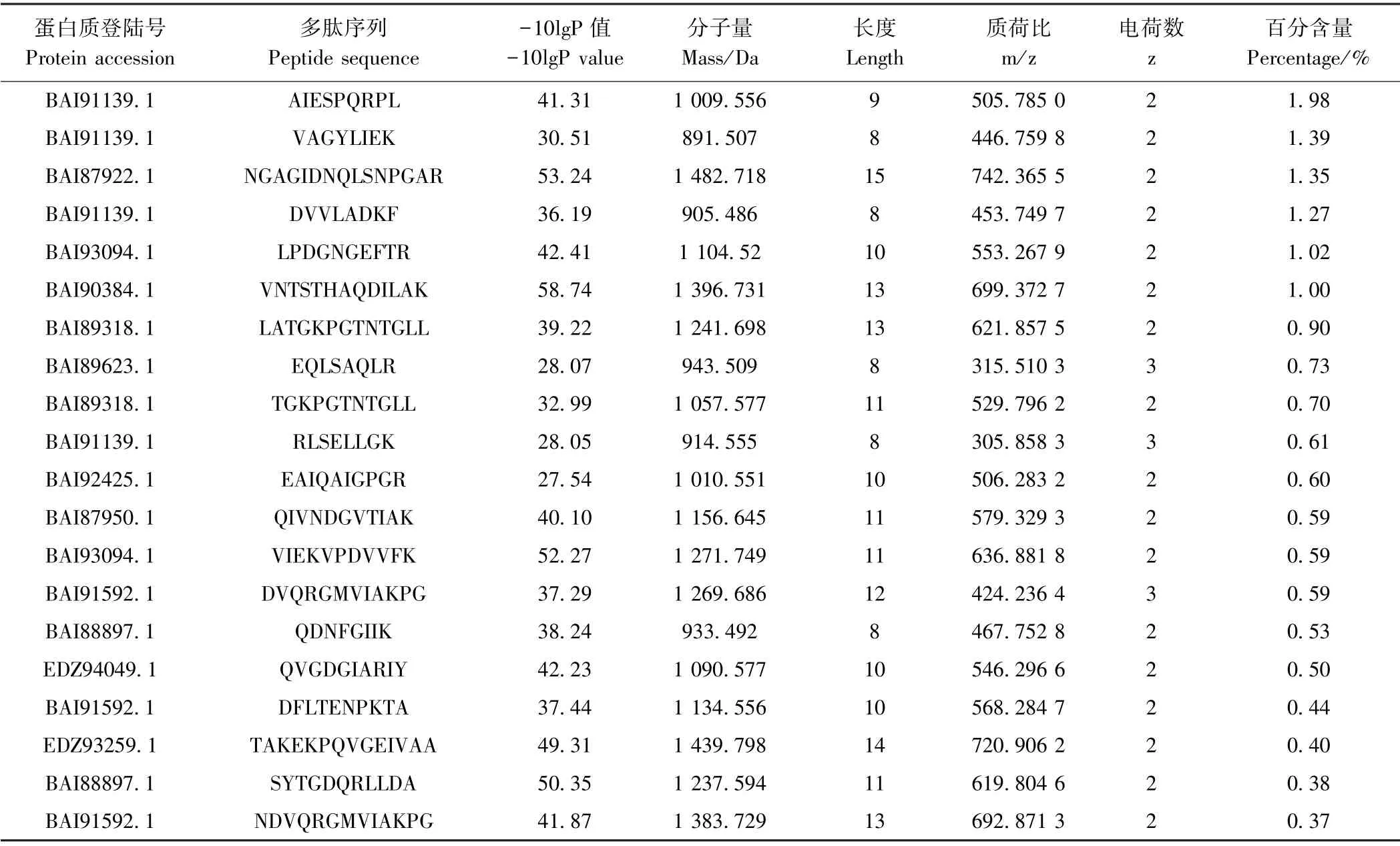
表1 数据库比对法中百分含量最高的20个游离肽Table1 The highest percentage of 20 kinds of using database search method
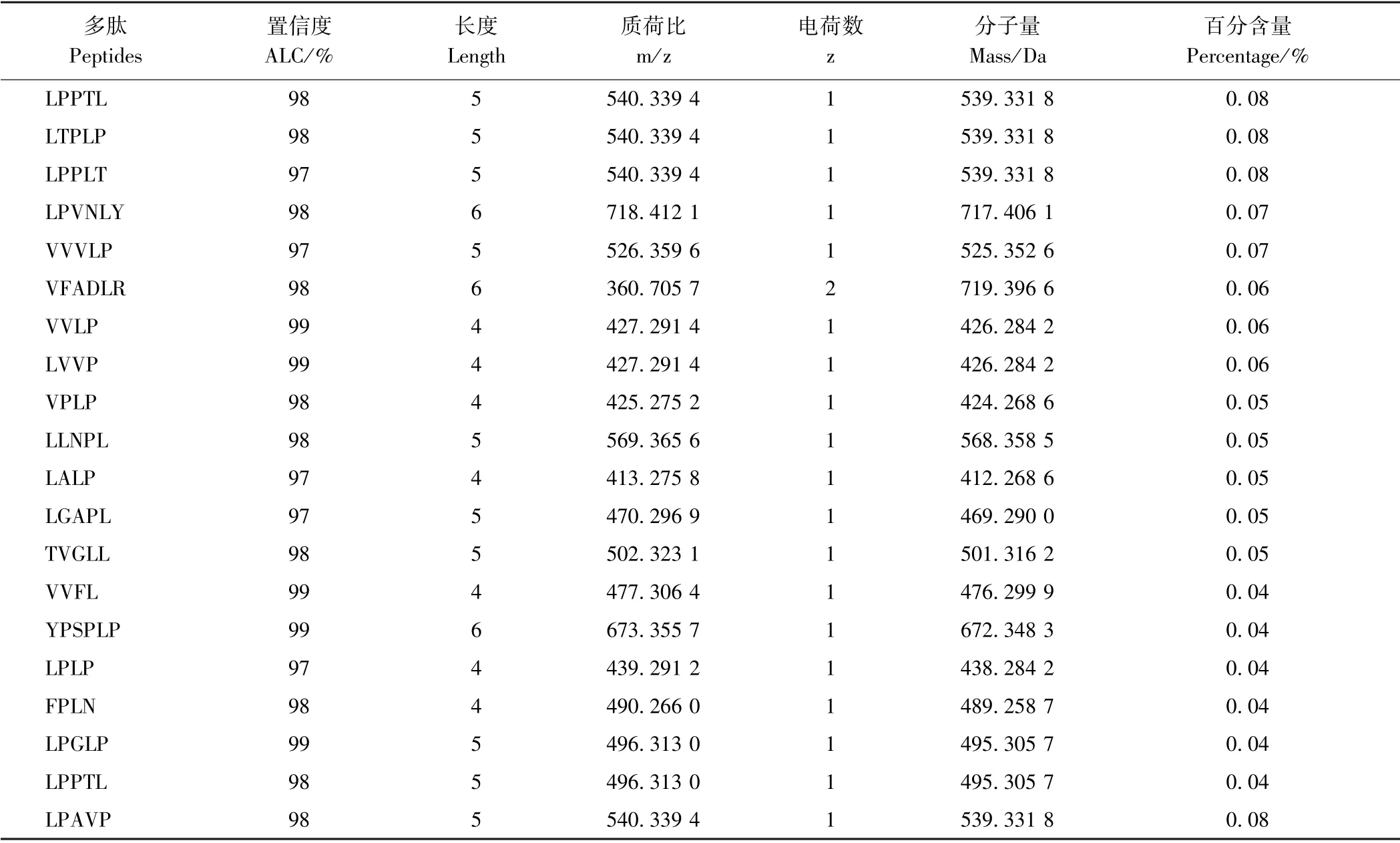
表2 从头测序法中百分含量最高的20个游离肽Table2 The highest percentage of 20 free peptides using de novo sequencing methods
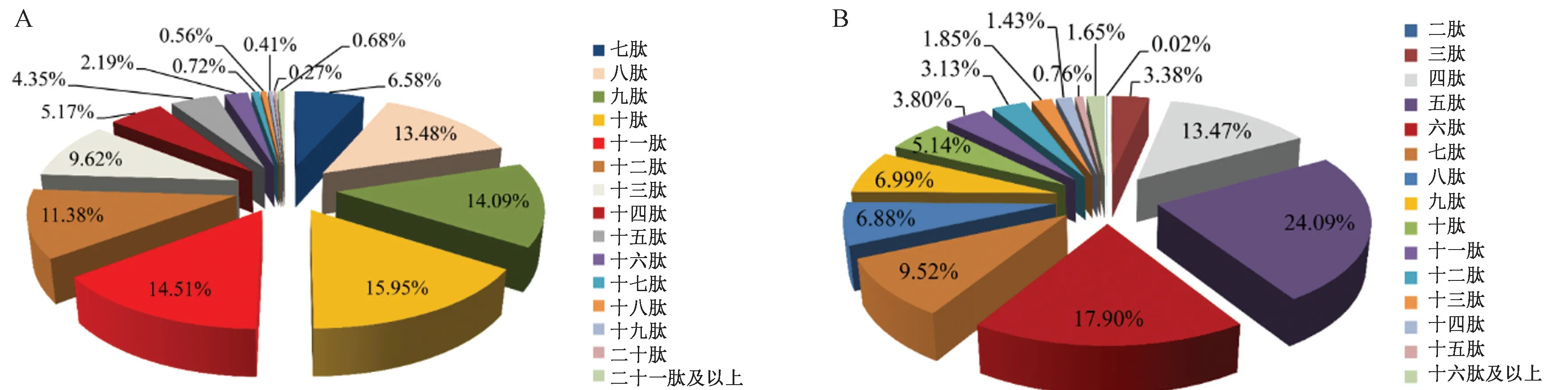
图1 利用数据库比对(A)和从头测序法(B)分析螺旋藻中游离肽分布Fig.1 Peptide profiling through database search(A) and de novo sequencing methods(B)
肽段覆盖率是指检测到的肽段氨基酸数量占该蛋白质总氨基酸数量的比例。图2显示了螺旋藻中所鉴定的蛋白质覆盖率,结果表明,蛋白质覆盖率超过10%的占比为43.15%,具有较高的置信度。以百分含量最高的多肽序列AIESPQRPL为例,其与检测到的其余141个多肽(蓝线所示)共同组装成磷酸甘油酸激酶蛋白质(phosphoglycerate kinase),登录号为BAI91139.1(图3)。多肽AIESPQRPL 开始于蛋白序列的第185位氨基酸,结束于第193位氨基酸,为九肽。图3中粗体灰色背景的序列即为可靠的鉴定序列,序列上方的修饰、突变即为符合区域右侧可信度过滤阈值的位点,下方蓝色条标注的是每一条可靠定性肽段的序列匹配情况。彩色底的方块代表该蛋白检测到的修饰类别,不同颜色加字母组合代表不同类型的修饰。磷酸甘油酸激酶蛋白质中共发现2个乙酰化修饰、2个胱氨酸化修饰、2个甲基化修饰、9个氧化修饰、2个丙酰胺化修饰以及11个钠加合物修饰。乙酰化修饰分布于371位氨基酸;胱氨酸化分布于169位氨基酸;甲基化修饰主要分布于139位氨基酸;氧化修饰主要分布在109位、225位、264位、172位氨基酸;丙酰胺化修饰分布于260位氨基酸,钠加合物修饰主要分布于160位、210位、274位、302位、397位氨基酸。磷酸甘油酸激酶是生物体生存的必需酶,是糖酵解过程中的关键酶,由2个球形的结构阈组成,其主要功能是将1,3-二磷酸甘油酸转化为3-磷酸甘油酸[21]。
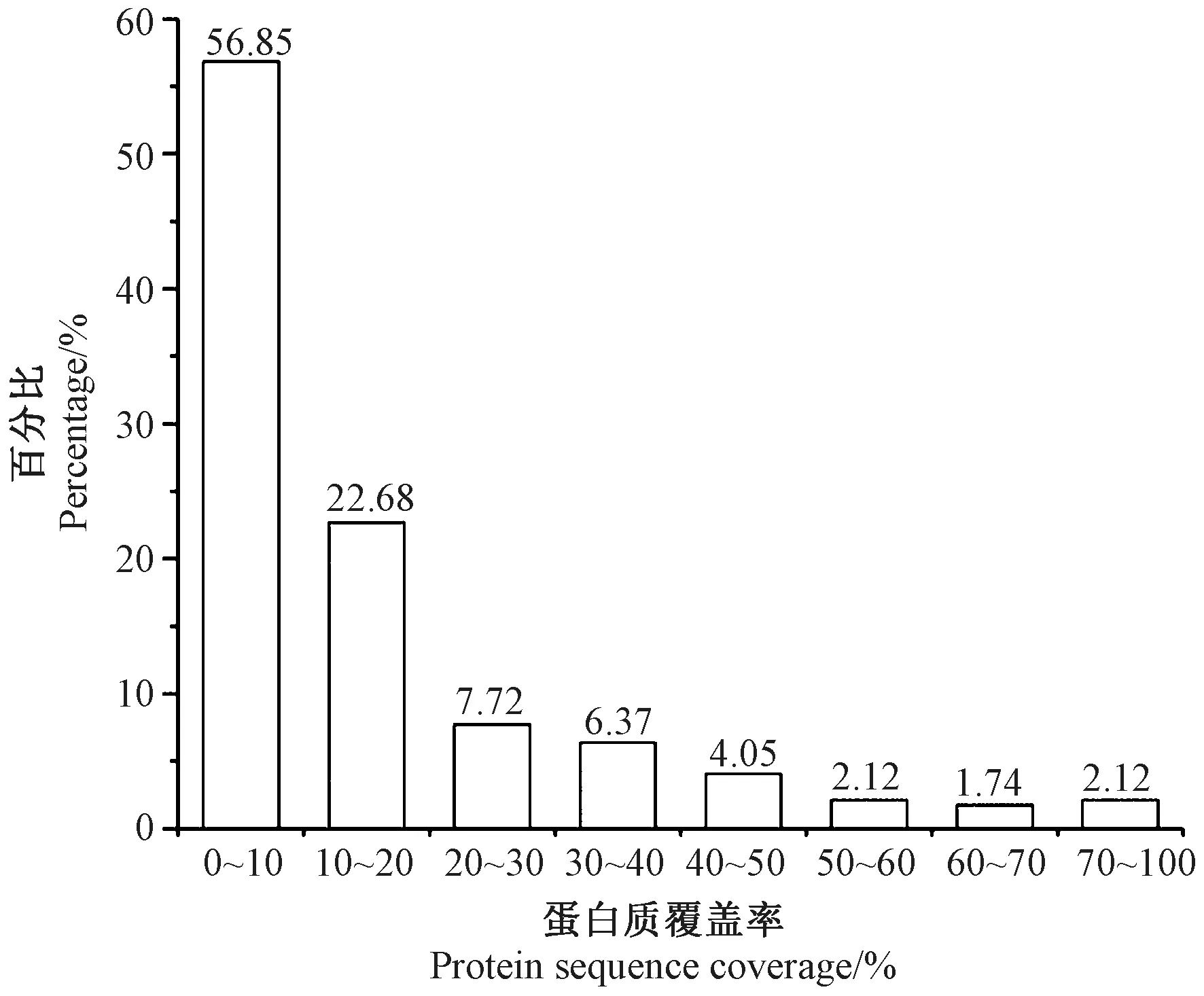
图2 蛋白质覆盖率的分布Fig.2 Distributin of protein sequence coverage
利用上述数据库搜索法和从头测序法获得的螺旋藻多肽,通过前期质控筛选共得到1 036种蛋白质和667种蛋白质组。蛋白质质量分布如图4所示,大部分蛋白质质量大于10 kDa,有良好的覆盖度。其中质量为10~20 kDa的蛋白质种类最多,有218种,约占蛋白质总量的五分之一,其次是质量为30~40 kDa和40~50 kDa的蛋白质,分别有179种和145种,质量为80~90 kDa的蛋白质种类最少,仅有26种。表3列举了百分含量前20的蛋白质种类,这些不同的蛋白质在生物体中发挥着不同的作用,其中蛋白质putative peroxiredoxin(假定的过氧化物酶)的相对含量最高,过氧化物酶(peroxiredoxin,PRX)是一种重要的蛋白质,在保护自身细胞抵抗活性氧(reactive oxygen species,ROS)方面发挥着重要作用。
3 讨论
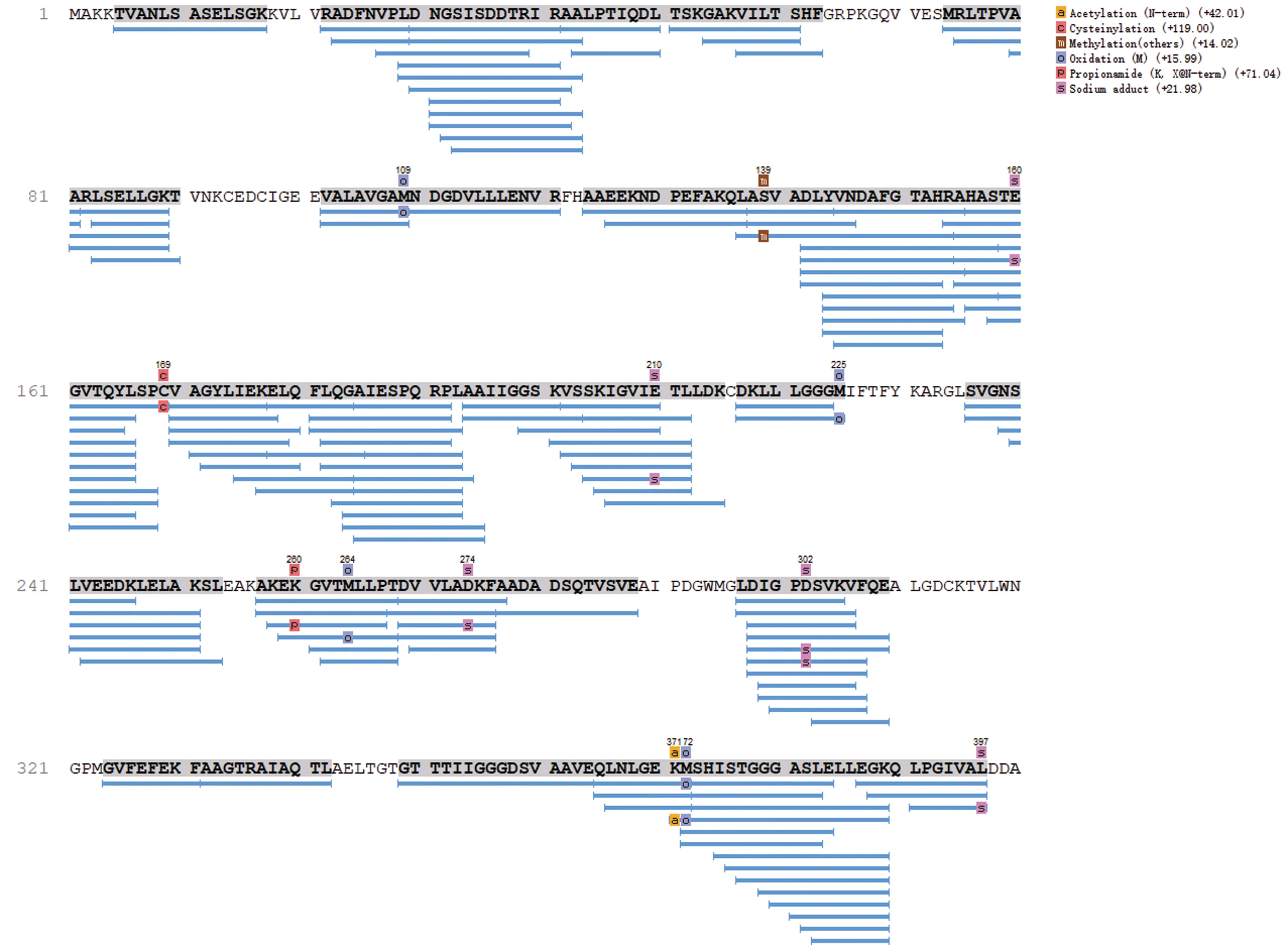
图3 磷酸甘油酸激酶蛋白质序列覆盖图Fig.3 Phosphoglycerate kinase protein sequence map
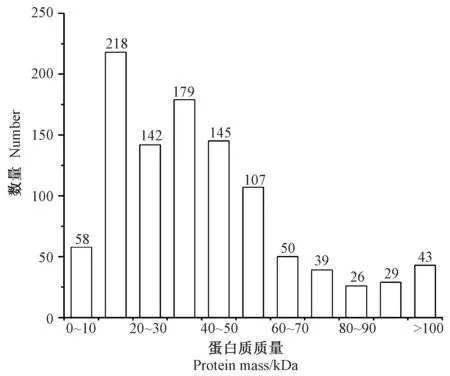
图4 蛋白质质量分布Fig.4 Protein mass distribution
曾巧辉[11]运用基质辅助激光解析电离质谱(matrix assisted laser desorption ionization time-of-fight mass spectrometry,MALDI-TOF-MS/MS)仪和PEAKS 软件鉴定出螺旋藻蛋白酶解后纯化的活性成分中6个具有抗氧化 活 性 多 肽 序 列,分 别为GMCCSR、FFEFF、EYFDALA、VTAPAASVAL、ANAAFRPR、WVAGLGYFTKNGGPK,但是纯化过程耗时耗力,且大量未纯化到的多肽则无法开展深入研究;王竹君[22]采用MALDITOF/TOF-MS 质谱仪进行螺旋藻多肽的鉴定,仅得到5条可信肽段。这是因为MALDI-TOF 质谱测量多肽混合物时,待测组分不能完全离子化,导致部分多肽组分未被检测到,特别是对于成分复杂、含量分布范围广的样品更难检测[23];而蛋白匹配时,如果得不到足够的肽段信息,则无法搜索肽数据库进行蛋白的识别。为了解决检测灵敏度和检测范围,本研究使用液相色谱进行多肽组分分离,可降低多肽混合物间的离子抑制率,有利于复杂多肽成分的检测,获得足够多的多肽片段信息进行蛋白质识别和组装。此外,孙宜君[24]采用MALDI-TOF/TOF-MS和液质联用方法(liquid chromatography tandem massspectrometry,LC-MS/MS)分别测定了螺旋藻抗菌肽的分子量和一级结构,并采用数据库搜索得到该肽所属的蛋白质种类,但是该结果仅针对目前已有的数据库结果进行匹配分析,而大量未被收录于数据库的多肽片段信息,则无法识别分析。因此,为了更广泛地获得螺旋藻中多肽和蛋白信息,本研究综合利用数据库比对法和从头测序法,分别获得了4 485个和20 597个肽段。其中,从头测序法获得的肽段信息高于数据库匹配法3~4倍,使得螺旋藻中游离多肽的分析更加全面,弥补了高可信肽段在数据库搜索结果中没有理想的匹配情况,可以找到大量未知的、全新的多肽,且进一步探究翻译修饰、氨基酸突变等信息。
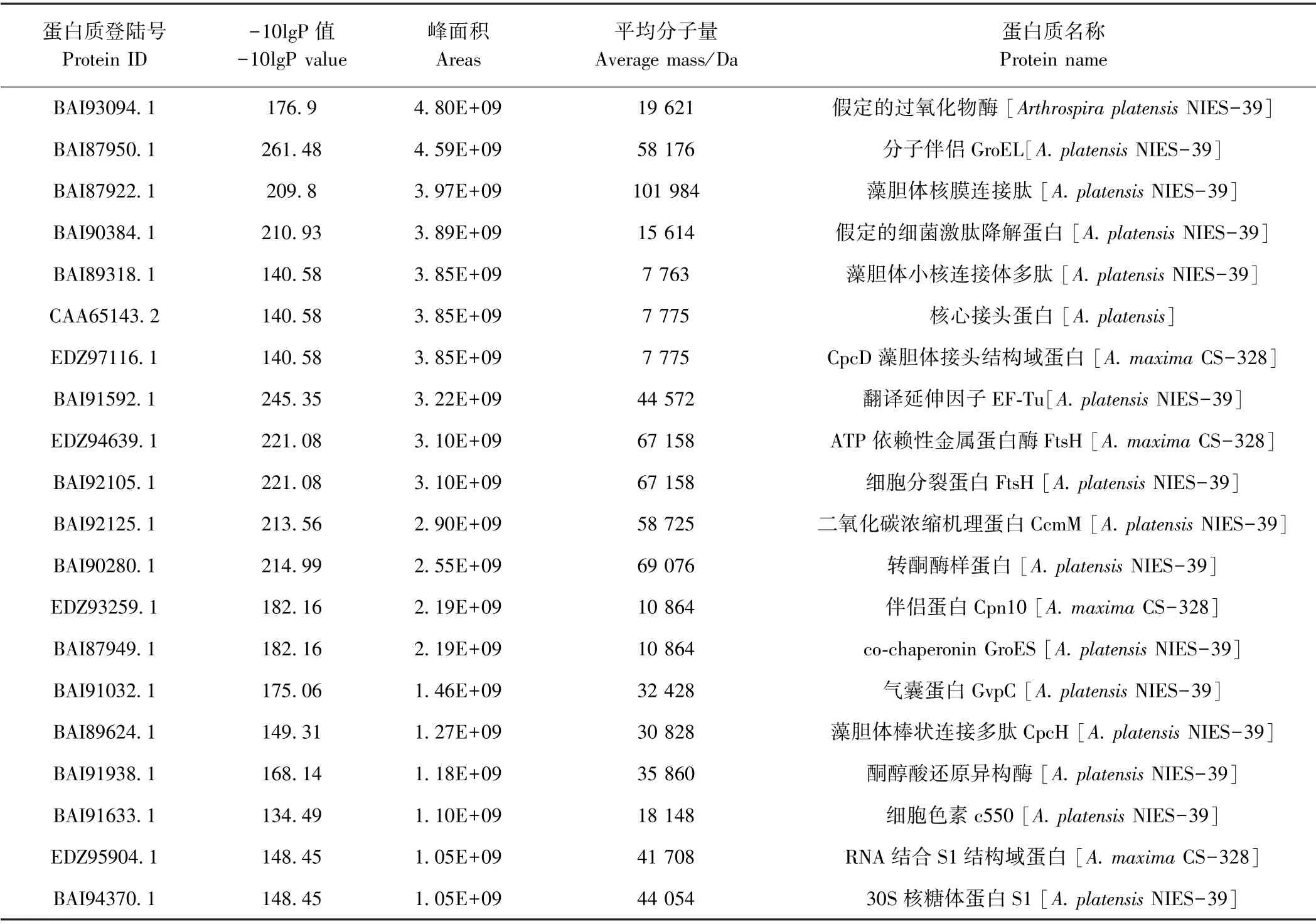
表3 峰面积排序前20的蛋白Table3 Top 20 proteins in peak area sorting
目前,已有文献报道螺旋藻及其他藻类中的抗高血压、抗氧化、抗肿瘤等相关的活性肽。Suetsuna等[25]报道了螺旋藻(S.platensis)和小球藻(Chlorella vulgaris)中的ACE 抑制肽,其中,螺旋藻中检出5条ACE 抑制肽,分别为Ile-Ala-Glu(IAE,IC50为34.7 μmol · L-1)、Phe-Ala-Leu (FAL,IC50为26.3 μmol·L-1)、Ala-Glu-Leu (AEL,IC50为57.1 μmol·L-1)、Ile-Ala-Pro-Gly (IAPG,IC50为11.4 μmol·L-1)和Val-Ala-Phe (VAF,IC50为35.8 μmol·L-1);小球藻中检出5种ACE 抑制肽,分别为Ile-Val-Val-Glu(IVVE,IC50为315.3 μmol·L-1)、Ala-Phe-Leu(AFL,IC50为63.8 μmol·L-1)、FAL、AEL和Val-Val-Pro-Pro-Ala(VVPPA,IC50为79.5 μmol·L-1)。本研究在螺旋藻游离肽的从头测序的结果中也检出了三肽FAL和AFL,分子量均为349 Da。裙带菜(U.pinnatifida)中共得到15个活性肽段,其中有二肽11个,分别为VY、IY、AW、FY、VW、IW、LW、YH、KY、FY 及IY[26-27];四肽有4个,分别为AIYK、YKYY、KFYG、YNKL,它们的分子量范围为400~700[28]。而本检测到的25 082个肽段中,仅发现了一个二肽LW(IC50=23.6 μmol·L-1),分子量为359 Da。因此,推测螺旋藻游离肽中检测到的LW、FAL和AFL 三种小肽可能含有抗高血压的活性肽。
螺旋藻的藻蓝蛋白的胃蛋白酶消化物中分离出具有抗氧化活性的氨基酸Cys-Leu(CL)[29]。Yu 等[30]通过超滤、凝胶色谱和反相高效液相色谱法获得抗氧化肽Pro-Asn-Asn(PNN)(343.15 Da),并通过合成获得PNN 多肽,确定其DPPH 清除活性(100 μg·mL-1)为81.44%。本研究基于此,以CL和PNN 作为螺旋藻中的抗氧化活性肽的多肽片段进行搜索并未发现CL和PNN,然而,在从头测序结果中得到含有PNN片段的游离肽有12个,含有CL片段的游离肽有315个;数据库搜索得到的多肽结果中筛选到含有CL 序列的游离肽有10个,含有PNN 序列的游离肽有4个。
Du 等[31]研究发现三肽Arg-Gly-Asp(RGD)具有改善肝纤维化的作用;Bartlett 等[33]研究发现含有Pro-Arg-Pro(PRP)序列的多肽可能具有抗微生物活性。本研究未发现RGD和PRP 两种三肽,但发现含有RGD 序列的游离肽15个,含有PRP 序列的游离肽20个,这些含有活性序列的肽段具有潜在的生物活性。此外,本研究基于螺旋藻25 082个游离肽,可匹配到的蛋白质主要分为几大类:藻胆体内的连接肽、藻体内的各类蛋白(气囊蛋白,结构域蛋白等)、分子伴侣、各类酶等。它们主要参与藻体的基本组成、蛋白质合成及转运、脂类糖类物质的代谢。如30 S 核糖体蛋白S1,参与了蛋白质的合成过程;翻译延伸因子EF-Tu,是原核细胞进行翻译时需要的三种延伸因子之一,其介导氨基酰-tRNA 进入核糖体空出的A位,进位过程需消耗EF-Tu 水解其复合的GTP 产生的能量来完成;蛋白质分子伴侣GroEL(chaperonin GroEL)属于Hsp60 分子伴侣系统,是一种由14个相对分子质量58×103的亚基组成的同型寡聚复合物,在新生蛋白质的折叠和组装、变性蛋白的复性以及蛋白质的跨膜运输中起着重要作用[33]。本研究中,螺旋藻提取物中上述蛋白质的功能主要参与藻体的基本组成、蛋白质合成及转运、脂类糖类物质的代谢,所以当上述蛋白质完成其基本功能被降解,从而有可能在螺旋藻游离肽提取物中检测到相应的多肽成分。
4 结论
本研究基于Nano-UPLC-Q ExactiveTM-MS 蛋白质组学技术分析了螺旋藻中分子量小于3 kDa的游离肽,采用数据库搜索法和从头测序法分别检测得到螺旋藻多肽4 485个和20 597个,并匹配组装成蛋白质1 036种。在数据库搜索结果中,游离肽主要为七肽到二十一肽,其中十肽含量最高,达到15.95%;从头测序结果中,游离肽主要为二肽到十六肽,其中五肽含量最高,为24.09%。此外,依据文献报道的活性肽数据,在螺旋藻游离肽中共检索到3种ACE 抑制肽,分别为FAL、AFL、LW,说明螺旋藻中游离肽中可能含有血管紧张素转化酶抑制的成分。基于多肽组成的分析结果,本研究可为螺旋藻多肽产品的生产和开发提供理论依据。
