禾谷镰刀菌Fgap1 转录因子调控Tri基因表达及DON 毒素合成
2020-03-13王龑王琦刘阳
王 龑 王 琦 刘 阳
(1浙江工业大学食品系,浙江 杭州 310018;2中国农业科学院农产品加工研究所,北京 100193)
我国是全世界最大的小麦生产国和消费国。据统计,我国目前小麦生产量和消费量分别占全世界小麦总量的17%和16%,小麦种植面积和总产量仅次于水稻,小麦种植面积和产量均占世界总种植面积和总产量的21%[1],小麦对国民经济和粮食安全起着至关重要的作用。近年来,由于气候和耕作制度的变化,小麦赤霉病在我国愈演愈烈,给小麦生产造成了巨大损失,严重影响籽粒品质[1]。禾谷镰刀菌(Fusarium graminearum)是引起赤霉病的主要菌种,由该病菌产生的脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)严重威胁食品安全[1]。DON是一种无色针状结晶,结构式为3α,7α,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮,分子量为296.3,分子式为C15H20O6,熔点为151~153℃,易溶于水、乙醇等溶剂,具有较强的热抵抗力和耐酸性[2]。DON 毒素能够抑制蛋白质合成和核酸的复制,抑制线粒体功能,破坏细胞膜完整性,具有很强的细胞毒性和胚胎毒性,能引起腹泻、呕吐、肠道坏死等病症。DON 毒素已被世界卫生组织和联合国粮农组织确定为食品中最危险的生物污染物之一[2]。DON 毒素的生物合成酶和直接调节蛋白是由位于染色体3个不同位点的15个基因编码,即12个基因核心Tri簇、Tri1~Tri16位点和单基因Tri101位点[3-5]。
禾谷镰刀菌在侵染小麦的过程中会引起寄主小麦的一系列防御反应,最初的防御反应就是植株体内活性氧(reactive oxygen species,ROS)的积累,如H2O2,其中由质膜NADPH 氧化酶产生的ROS是众多防御反应中较快的一种[6-7]。酵母作为真菌研究的模式菌株,氧化压力能够诱导酵母71个蛋白差异表达,其中一半以上受到Yap1的调控,氧化胁迫下,Yap1 蛋白C端的半胱氨酸残基内部形成二硫键,继而使其NES 序列改变而失活,导致Yap1 蛋白在细胞核中积累,调控下游基因表达以适应氧化压力的变化,分析小麦赤霉病菌的基因组发现,该禾谷镰刀菌中存在一个Yap1同源蛋白Fgap1[8-9]。但目前尚未有Fgap1 在氧化压力下调控禾谷镰刀菌Tri基因表达和DON 毒素合成的研究报道。前期研究通过同源重组的方法构建了Fgap1基因缺失突变株⊿Fgap1,本研究以禾谷镰刀菌野生型PH-1和突变株⊿Fgap1为试验材料,分析氧化压力敏感性、DON 毒素合成、Tri基因表达等,旨在明确转录因子Fgap1 与氧化压力下Tri基因表达和DON 毒青合成的相关性,以期阐释镰刀菌中Fgap1 调控毒素合成的作用机制,为建立安全高效的赤霉病及DON 毒素的防控技术提供理论基础和技术支撑。
1 材料与方法
1.1 材料
本试验中所用禾谷镰刀菌野生型PH-1是由浙江大学马忠华教授赠予;禾谷镰刀菌Fgap1的缺失突变株⊿Fgap1是由本试验通过同源重组的方法构建获得的Fgap1基因缺失纯合子。孢子悬液置于甘油管中-80℃保存,使用时在PDA 平板上复苏,28℃培养3 d备用。
1.2 方法
1.2.1 禾谷镰刀菌培养及其孢子悬液制备 禾谷镰刀菌PH-1和⊿Fgap1,保存于-80℃甘油管中,使用前在PDA 上复苏,28℃培养6~8 d后,用无菌棉棒刮下,在无菌水中悬浮制成孢子悬液,并用血球计数板计数稀释至107CFU·mL-1。
1.2.2 生长速率、氧化渗透压敏感性测定 将禾谷镰刀菌野生型菌株PH-1 在PDA 平板活化2 d后,用打孔器取下直径0.5 cm 菌饼,接种到添加0.1 mmol·L-1甲萘醌(menadione)、0.007 mmol·L-1过氧化叔丁醇(tertbutyl hydroperoxide,TBHP)、24 mmol·L-1过氧化氢(H2O2)和0.001 mmol·L-1重铬酸钾(K2Cr2O7)的平板中,28℃避光培养3 d后用十字交叉法测定菌落直径[10],计算菌丝生长抑制率。其中,在培养60 h时,测定各氧化剂处理下菌落直径和菌丝生长抑制率;在培养72 h时,测定空白组(不加氧化剂)和0.1 mmol·L-1甲萘醌处理下菌落直经和菌丝生长抑制率,以及0.05、0.10、0.20 mmol·L-1甲萘醌处理下菌丝生长抑制率。每组设3次生物学重复,每次试验重复3次。
1.2.3 扫描电镜观察菌丝结构 菌株培养2 d后,用敲碎的盖玻片小碎片轻轻斜插入PDA 培养基,再继续培养12~18 h 至菌丝爬上玻璃碎片。收集碎片,用2.5%戊二醛-2%多聚甲醛混合液固定菌丝,4℃过夜。将固定好的菌丝用乙醇梯度溶液脱水,二氧化碳临界点干燥,粘在金属台上,喷金镀膜,S-750型扫描电镜(Hitachi,日本)下观察,拍照[11]。
1.2.4 DON 毒素含量测定 DON 提取:刮取约1 g菌丝至1.5 mL 离心管中,加入约1 mL 乙腈∶水(84 ∶16,v ∶v)溶剂,冰上研磨,25℃、170 r·min-1条件下震荡提取,再用免疫亲和柱净化。
DON 毒素含量分析:Waters 高效液相色谱分析系统,C18反向色谱柱(25 cm×4.6 mm,粒径5 μm),流动相为甲醇∶乙腈∶水(90 ∶5 ∶5,v ∶v ∶v),流速1.0 mL·min-1,紫外检测波长218 nm,检测时间20 min,进样量20 μL。
1.2.5 基因表达分析 禾谷镰刀菌培养48 h后,加入0.01 mol·L-1甲萘醌继续培养24 h,收集菌丝,称量约100 mg 菌丝至1.5 mL 离心管中,按照E.Z.N.A.Fungal RNA Kit 试剂盒(Omega Bio-Tek,美国)进行后续提取,RNA 电泳验证无降解,cDNA 合成试剂盒(TaKaRa,日本) 反转录得到cDNA,SYBR Green Supermix 试剂盒荧光标记,ABI 7500型荧光定量PCR仪(ABI,美国)分析基因表达量。采用2-ΔΔCt法[12]计算目的基因的相对表达量。

表1 实时定量荧光PCR 引物Table1 Primers of quantitative real-time PCR
1.3 数据分析
采用Microsoft Excel Office 2013 软件对试验测得的数据进行处理,采用SPSS 22.0 对数据进行显著性分析。
2 结果与分析
2.1 不同渗透氧化压力下禾谷镰刀菌PH-1的敏感性分析
由图1可知,在PDA 平板培养60 h后,添加不同种类不同浓度的氧化剂培养后,禾谷镰刀菌PH-1 生长速率与空白相比有明显变化,其中0.007 mmol·L-1过氧化叔丁醇对PH-1的抑制作用最明显,菌丝生长抑制率达到78%;其次是0.001 mmol·L-1重铬酸钾,菌丝抑制率达到44%,24 mmol·L-1过氧化氢对PH-1 菌丝生长率抑制率为32%,0.1 mmol·L-1甲萘醌对PH-1菌丝生长率抑制率为20%。

图1 不同渗透氧化压力下禾谷镰刀菌PH-1的敏感性分析Fig.1 Sensitivity of F.graminearum PH-1 under osmotic and oxidative stresses
2.2 甲萘醌胁迫下禾谷镰刀菌PH-1、突变体⊿Fgap1的长势情况
由于甲萘醌处理重复性好,选取0.05、0.1、0.2 mmol·L-1甲萘醌作为氧化剂添加到PDA 培养基中培养禾谷镰刀菌,在24~72 h 之间每隔12 h 拍照并记录菌落生长情况。突变体⊿Fgap1的菌落在正常条件下与野生型PH-1的长势一致,添加氧化剂后,突变体⊿Fgap1的菌落生长较PH-1 缓慢,且色素沉积减慢(图2-A)。在添加0.05、0.1、0.2 mmol·L-1甲萘醌的处理中,培养72 h后,野生型PH-1 菌丝生长抑制率分别为30%、53%、75%;突变体⊿Fgap1的菌丝生长抑制率分别为46%、78%、88% (图2-B)。综上,⊿Fgap1 突变体在氧化压力下的生长明显滞后,转录因子Fgap1 对禾谷镰刀菌在氧化压力下的菌丝生长有正调控作用。
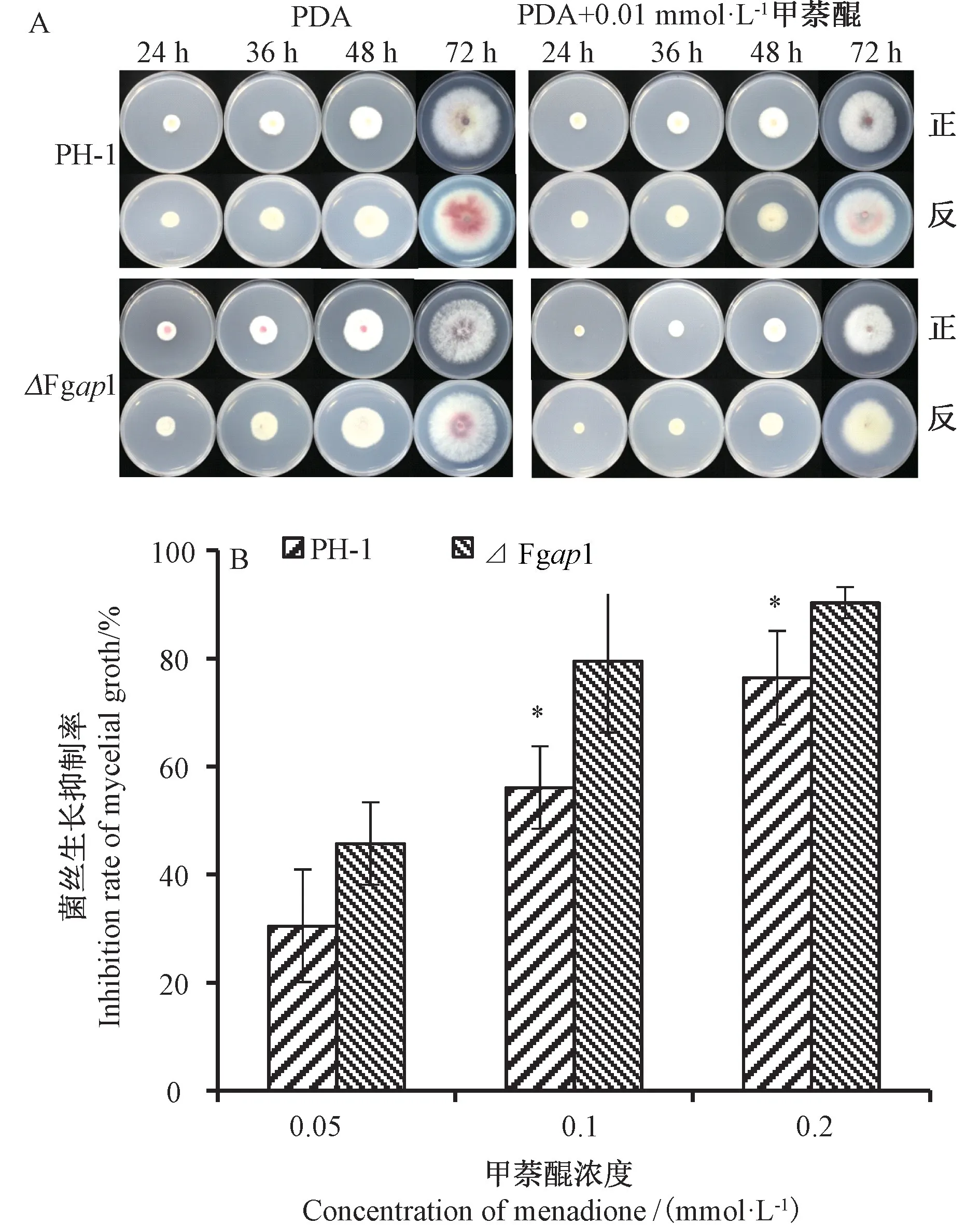
图2 禾谷镰刀菌在添加甲萘醌平板上的生长情况Fig.2 Growth of F.graminearum in culture supplemented with menadione
2.3 甲萘醌胁迫下禾谷镰刀菌PH-1、突变体⊿Fgap1的菌丝形态
通过扫描电镜观察,PH-1 菌丝表面光滑(图3-A),甲萘醌胁迫处理后菌丝表面出现轻微的萎缩(图3-B);与野生型PH相比,Fgap1基因敲除突变株⊿Fgap1菌丝表面光滑度略有下降(图3-C),在甲萘醌胁迫处理后菌丝纤细没有光泽度,萎缩明显,部分菌丝断裂、细胞壁破损(图3-D)。
2.4 不同氧化压力下禾谷镰刀菌PH-1、突变体⊿Fgap1的产毒情况
选取24 mmol·L-1过氧化氢、0.01 mmol·L-1甲萘醌、0.007 mmol·L-1过氧化叔丁醇作为氧化剂添加到PDA 培养基中培养96 h,收集菌丝测定DON 毒素含量。由图4可知,野生型PH-1 在不同氧化剂处理下,DON 毒素含量均有不同程度的上升,尤其是在甲萘醌和过氧化叔丁醇处理下,DON 毒素含量显著增加了18倍;突变体⊿Fgap1在不同氧化剂处理下,DON 毒素含量无明显变化。表明Fgap1基因的缺失显著影响了DON 毒素的产生,Fgap1基因调节氧化压力下DON 毒素的合成。

图3 甲萘醌处理下禾谷镰刀菌的菌丝形状(3 000×)Fig.3 Mycelial morphology of F.graminearum under menadione treatments (3 000×)

图4 不同氧化空白压力处理对禾谷镰刀菌产毒的影响Fig.4 Effect of different oxidative stress on the DON content produced F.graminearum
2.5 甲萘醌处理下禾谷镰刀菌Fgap1、Tri基因的表达情况
由图5可知,野生型PH-1 在0.01 mmol·L-1甲萘醌处理后,Fgap1基因表达量显著升高,突变体⊿Fgap1中Fgap1基因不表达。Fgap1的DNA 结合位点TTACTAA,在Tri5和Tri10基因启动子区域具有结合位点。Tri5——单端孢霉烯合酶,是DON 合成途径中的第一步限速酶[5,13],Tri6、Tri10 这2个转录因子调控多个DON 合成基因的表达[14]。采用实时定量PCR技术检测Tri基因的表达,野生型PH-1 经0.01 mmol·L-1甲萘醌处理后,Tri5、Tri6、Tri10基因表达量均有不同程度的升高;与野生型PH-1相比,Fgap1基因缺失突变体中DON 毒素合成调控基因Tri5、Tri6、Tri10、Tri101均下调表达(图5)。

图5 甲萘醌处理下禾谷镰菌Fgap1、Tri基因的表达Fig.5 The expression of Fgap1 and Tri in F.graminearum treated with menadione
3 讨论
植物病菌在侵染过程中能引起寄主植物一系列的防御反应,氧化应激是一种首要的防御反应,且ROS能够作为第二信使传递放大反应信号,ROS的积累使得病菌在侵染部位受到更多的氧化压力从而影响病菌的侵染过程[6-7]。禾谷镰刀菌侵染小麦的过程中会产生ROS 信号,激发小麦的氧化应激反应。禾谷镰刀菌会产生单端孢霉烯毒素,包括HT-2 毒素、T-2 毒素、DON、玉米赤霉烯酮(zearalenone,ZEN)等60 多种毒素,其中主要组分是DON。大量研究表明,赤霉病菌的DON 毒素的产生受到多个Tri基因的调控[4-5,13],且与致病性相关[15]。病原菌侵染麦穗的过程中产生的DON 毒素能够引起胼胝质的积累和抑制麦穗细胞壁的增厚,从而影响病菌的侵染过程[16]。在外源H2O2充足的环境下,离体培养赤霉病菌菌体能够产生更多的DON 毒素,当添加过氧化氢酶将外源的H2O2降解后,DON 毒素的积累剧烈下降。H2O2引起的氧化压力能够诱导多个Tri基因表达上升,而过氧化氢酶减弱了H2O2引起的氧化压力,抑制了Tri基因的表达[7]。此外,酚酸等抗氧化剂能够通过抑制Tri基因的表达从而控制禾谷镰刀菌中单端孢霉烯B 族毒素的合成[17],且麦麸中提取的酚酸,同样也能很好地抑制Tri基因的表达[18]。Yap1的同源蛋白被初步证实参与调控菌体对外界胁迫的感应,但是不同病菌中Yap1的生物学功能有所差别[16,19-22]。稻瘟病菌(Magnaporthe oryzae)中MoAP1的缺失突变体对H2O2敏感,影响菌丝分支、分生孢子形成、黑色素形成及致病力[19]。链格孢菌(Alternaria alternata)中AP-1 对氧化胁迫敏感,AP-1 缺失后的菌株致病力减弱[20-21]。隐球酵母(Cryptococcus neoformans)YAP1基因敲除后,其对大范围的氧化胁迫敏感,同时也对抗真菌氟康唑高度敏感[22]。本研究中禾谷镰刀菌在甲萘醌、过氧化叔丁醇、过氧化氢、重铬酸钾4种不同氧化剂处理下菌落生长受到明显抑制,表明Fgap1 缺失突变体对过氧化氢、过氧化叔丁醇、甲萘醌敏感,氧化剂影响了菌丝结构及色素形成,这与前人研究一致。
氧化胁迫相关的转录因子能够调控真菌次生代谢产物,包括毒素的形成[23-24]。目前已有关于丝状真菌中Yap1 调控毒素合成的研究报道[25-26]。在酵母中,Yap1 作为转录调控因子,其DNA的结合序列已确认为TGACTAA[27]。单端孢霉烯毒素生物合成基因包括一个含有12个基因的核心Tri簇,Tri1、Tri16基因,以及1个单基因Tri101位点[5,13,28]。单端孢霉烯首先由焦磷酸法尼酯经多步反应合成曲古二烯(该步反应由Tri5基因编码酶催化),曲古二烯在Tri4 编码的多功能的P450 单加氧酶催化下经由4 步反应合成异构单端孢霉三元醇,而后经无酶催化作用的两步异构化反应(C9的羟基异构成C11的羟基,C2 上氧原子与C11之间经环化作用形成-CO 键),生成异构木霉菌醇,异构木霉菌醇在Tri101 编码的乙酰基转移酶催化[C3上的羟基被乙酰化,3-乙酰异构木霉菌醇C15位在P450 单加氧酶(由Tri11 编码)]下羟基化生成15-脱乙酰丽赤壳菌素(DON 生成的直接底物),继而经过C3位和C7位的羟基化作用及C8位变为酮基后,最终生成DON[13]。通过分析已经确定Fgap1 在赤霉的Tri5和Tri10基因的启动子区域存在相应的结合位点。本研究发现,Fgap1基因缺失突变体在甲萘醌引起的氧化压力下DON 毒素含量显著降低,Tri5、Tri6、Tri10及Tri101基因表达受到抑制,表明Fgap1 调控Tri基因表达和DON 毒素合成,但不能影响禾谷镰刀菌的致病力[25]。此外,在寄生曲霉(Aspergillus parasiticus)中也存在Yap1的同源蛋白,ApyapA 能调控AflR基因的表达及黄曲霉毒素B1的合成[26]。综上表明,病原菌引起的氧化压力会反过来干扰病原菌的次生代谢和调控毒素基因的合成,与寄生曲霉类似,禾谷镰刀菌PH-1 能够通过转录因子Fgap1 调节下游效应因子的改变、DON 合成基因的表达等以适应氧化压力的变化,从而更好地完成侵染过程。
4 结论
本研究结果表明,4种不同氧化剂(甲萘醌、过氧化叔丁醇、过氧化氢、重铬酸钾)处理下禾谷镰刀菌菌落生长受到明显抑制,⊿Fgap1 突变体对过氧化氢、过氧化叔丁醇、甲萘醌敏感,氧化剂影响菌丝结构及色素形成,在氧化压力下⊿Fgap1 突变体的DON 毒素合成能力下降,Tri5、Tri6、Tri10 及Tri101基因表达受到抑制。本研究明确了转录因子Fgap1 与氧化压力下Tri基因表达和DON 毒素合成的相关性,禾谷镰刀菌中Fgap1 转录因子能够感受并传递氧化压力信号,调控Tri基因的表达和DON 毒素的合成,下一步可对Fgap1调控合成基因Tri基因表达的机理进行研究。
