白芍总苷联合环磷酰胺治疗系统性红斑狼疮及对外周血CD4+CD25+T细胞表达水平的影响
2020-03-12吴霞石帅陈庆云焦林娟
吴霞,石帅,陈庆云,焦林娟
(南阳市第二人民医院,河南南阳473012)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是常见的弥漫性、全身性自身免疫性疾患。临床表现多种多样,病情极易反复,不仅导致心肺、血液等多器官受累,还会合并一系列继发性损伤。因此需要短时间内对SLE确诊及行治疗方案。临床治疗方法有限,常规治疗措施多以糖皮质激素、免疫抑制剂为基础,然而多发的不良反应限制了临床应用范围[2]。现阶段在SLE的治疗方案中,环磷酰胺有不可或缺的重要作用[3],诸多指南中均推荐其为常规治疗而应用。近年来随着生物学和分子生物学的进展,研究人员从中药白芍根部提取的多苷成分被称为白芍总苷,有双向免疫调节作用,其在皮肤疾病方面得到广泛应用。研究发现白芍对SLE有独特的辅助治疗作用,不良反应轻,患者易于接受[4]。这为白芍总苷联合环磷酰胺治疗SLE提供了很好的基础。近几年来我院采用白芍总苷联合环磷酰胺治疗SLE取得了一定疗效,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 临床资料 研究对象为2012年1月—2014年11月我院确诊的SLE患者74例,按随机数字表法分为对照组和研究组,对照组37例予以环磷酰胺联合糖皮质激素治疗,其中男9例,女28例,年龄20~48岁,平均(29.12±5.64)岁,病程8个月~11年,平均(3.19±1.02)年;研究组37例在对照组基础上予以白芍总苷治疗,其中男10例,女27例,年龄21~49岁,年龄(30.11±6.05)岁,病程7个月~12年,病程(3.24±1.20)年,2组间性别、年龄、病程等基本资料对比,有可比性(P>0.05)。
1.1.2 纳入标准 ①参照《SLE诊断及治疗指南》[5]和美国风湿病学会1997年推荐的SLE分类标准,包括颊部红斑、盘状红斑、光过敏、口腔溃疡、关节炎、浆膜炎、肾脏病变、神经病变、血液学疾病、免疫学异常及结核抗体等11项,符合4项或4项以上者,排除存在感染、肿瘤和其他结缔组织病,可确诊;②年龄20~49岁;③患者或家属对研究方案知情并签字同意,积极配合此次研究;④资料完整,遵医嘱服药,治疗过程中配合检查者;⑤经本院医学伦理委员会审核通过。
1.1.3 排除标准 ①年龄>49岁或<20岁;②存在肝肾功能不全或恶性肿瘤、血液病、甲状腺功能减退症者;③重症狼疮或存在严重结核、真菌重症感染患者;④对环磷酰胺或白芍总苷等药物过敏者;⑤长期使用免疫抑制剂治疗者;⑥妊娠或哺乳期妇女、精神障碍不能正常交流者;⑦难以配合治疗或随访者。
1.1.4 剔除标准 ①不符合纳入标准而被误纳入的病例;②研究过程中,病情变化或其他原因不能接受治疗者;③研究过程中,有严重临床不良事件,不宜继续接受实验者;④研究过程中不能坚持或自动放弃规定的治疗方案者。
1.2 方法 参照中华医学会风湿病学分会制定的《SLE诊治指南(草案)》[6]的治疗标准,对照组患者予以环磷酰胺联合糖皮质激素治疗,醋泼尼松片(天津力生制药股份有限公司,国药准字H12020123)0.8 mg/(kg·d)晨起口服,1次/d,参照患者病情6周后逐渐减少剂量,以每周下降5 mg速度递减,降至5~10mg/d时维持该服药量,采用复方环磷酰胺片(通化茂祥制药有限公司,国药准字H22026738)冲击治疗,每次持续2 d,第1天0.2 g,第2天0.3 g,加入0.9%氯化钠注射液250 mL静脉滴注,每2周1次,治疗6周后改为每4周1次;研究组患者予以白芍总苷联合环磷酰胺治疗,环磷酰胺联合糖皮质激素治疗同对照组,白芍总苷胶囊(宁波立华制药有限公司,国药准字H20055058)口服0.6 g/次,2~3次/d,2组共治疗90 d,治疗期间加强病情观察。
1.3 血清学检测指标 ①抽取肘静脉血,离心机分离取上层血清,低温下保存,30 min内必须送检,测定血清免疫球蛋白(IgA、IgG、IgM)和补体(C3、C4)水平,免疫球蛋白和补体均采用免疫比浊法测定,试剂盒由上海科华生物工程股份有限公司提供;②抽取肘静脉血,置于抗凝管中,离心机分离取上层血清,低温下保存,30 min内必须送检,采用流式细胞术检测CD4+CD25+T、CD40+细胞百分率,试剂盒由德国美天旎生物技术有限公司提供;③采用双抗体夹心酶联免疫吸附试验(ELISA)法测定血清人可溶性血管细胞黏附因子(sVCAM)-1、白细胞介素(IL)-18和血管内皮生长因子(VEGF)水平,IL-18由日本MBL公司提供,sVCAM-1、VEGF试剂盒由美国R&DSystems公司提供;④采取ELISA测定血清基质金属蛋白酶(MMP)水平,包括MMP-3、MMP-9含量,试剂盒由上海研卉生物科技有限公司提供,以上指标均由我院培训的专业人员于治疗第1天、治疗第90天测定,严格按试剂盒说明书操作进行。
1.4 疗效判定标准[7]①显效:主要化验指标趋于正常,以上主症好转;②好转:上述主症有改善,各项化验指标数值亦有好转迹象;③无效:未及有效标准者。总有效率=(显效例数+好转例数)/总病例数×100%。
1.5 安全性分析 治疗期间查血/便常规,肝、肾功能,心电图检査,观察不良反应状况。同时进行随访1年记录复发率状况,均由我院培训的专业人员统一记录。
1.6 统计学分析 采用SPSS17.0软件包对所有统计结果进行分析,正态性计量资料采用均数±标准差(±s)表示,2组治疗不同时间点血清学检测指标对比予以配对样本t检验,2组间血清学检测指标对比予以独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 免疫球蛋白和补体水平 相对于治疗前,2组患者治疗后IgA、IgG、IgM含量均降低,C3、C4含量均升高,相对于对照组,研究组治疗后IgA、IgG、IgM含量较低,C3、C4含量较高,数据对比,差异有统计学意义(P<0.05)。见表1。
2.2 CD4+CD25+、CD40+T细胞水平 相对于治疗前,2组患者治疗后CD4+CD25+含量均升高,CD40+含量均降低,相对于对照组,研究组治疗后CD4+CD25+含量较高,CD40+含量较低,数据对比,差异有统计学意义(P<0.05)。见表2。
2.3 sVCAM-1、IL-18和VEGF水平 相对于治疗前,2组患者治疗后sVCAM-1、IL-18和VEGF含量均降低,相对于对照组,研究组治疗后sVCAM-1、IL-18和VEGF含量较低,数据对比,差异有统计学意义(P<0.05)。见表3。
2.4 基质金属蛋白酶含量 相对于治疗前,2组患者治疗后MMP-3含量降低,MMP-9含量升高,相对于对照组,研究组治疗后MMP-3含量较低,MMP-9含量较高,数据对比,差异有统计学意义(P<0.05)。见表4。
表1 2组间治疗不同时间点IgA、IgG、IgM和C3、C4含量分析 (±s)
注:*相对于治疗前,P<0.05;#相对于治疗后对照组,P<0.05,t1为对照组患者治疗前后对比,t2为研究组患者治疗前后对比,t3为2组患者治疗后对比。
组别 n 时间点 免疫球蛋白(g/L) 补体(mg/L)IgA IgG IgM C3 C4对照组 37 治疗前 3.51±0.68 19.56±3.26 2.57±0.35 0.39±0.18 0.12±0.07治疗后 3.04±0.56* 14.89±2.75* 2.24±0.32* 0.60±0.25* 0.19±0.08*研究组 37 治疗前 3.49±0.65 19.47±3.18 2.59±0.36 0.41±0.19 0.13±0.09治疗后 2.57±0.54*# 12.14±2.53*# 1.83±0.30*# 0.83±0.27*# 0.27±0.10*#t1 3.245 6.660 4.233 4.417 4.006 t2 6.622 10.972 9.865 7.738 6.330 t3 3.675 4.476 5.686 3.803 3.799
2.5 临床疗效 与对照组比较,观察组总有效率显著高于对照组,差异有统计学意义(P<0.05)。见表5。
表2 2组间治疗不同时间点CD4+CD25+、CD40+T细胞百分率状况分析 (±s)
注:*相对于治疗前,P<0.05;#相对于治疗后对照组,P<0.05,t1为对照组患者治疗前后对比,t2为研究组患者治疗前后对比,t3为2组患者治疗后对比。
组别 n 时间点 CD4+CD25+(%) CD40+(%)对照组 37 治疗前 7.53±1.29 93.26±3.14治疗后 8.86±1.52* 90.10±3.07*研究组 37 治疗前 7.61±1.34 93.41±3.08治疗后 10.32±1.67*# 88.22±2.86*#t1 4.058 4.377 t2 7.699 7.511 t3 3.933 2.726
表3 2组间治疗不同时间点sVCAM-1、IL-18和VEGF水平分析 (±s)

表3 2组间治疗不同时间点sVCAM-1、IL-18和VEGF水平分析 (±s)
注:*相对于治疗前,P<0.05;#相对于治疗后对照组,P<0.05,t1为对照组患者治疗前后对比,t2为研究组患者治疗前后对比,t3为2组患者治疗后对比。
组别 n时间点sVCAM-1(ng/mL)IL-18(pg/mL) VEGF(pg/mL)对照组37治疗前 1123.69±215.56 519.36±54.21 196.35±24.35治疗后 922.69±200.85* 427.83±49.95* 175.33±20.57*研究组37治疗前 1086.37±201.42 511.28±58.76 197.82±23.31治疗后 719.40±189.97*#324.69±48.67*#152.83±19.96*#t1 4.150 7.553 4.013 t2 8.062 14.875 8.916 t3 4.473 8.996 4.775
表4 2组间治疗不同时间点MMP-3、MMP-9含量分析 (±s)
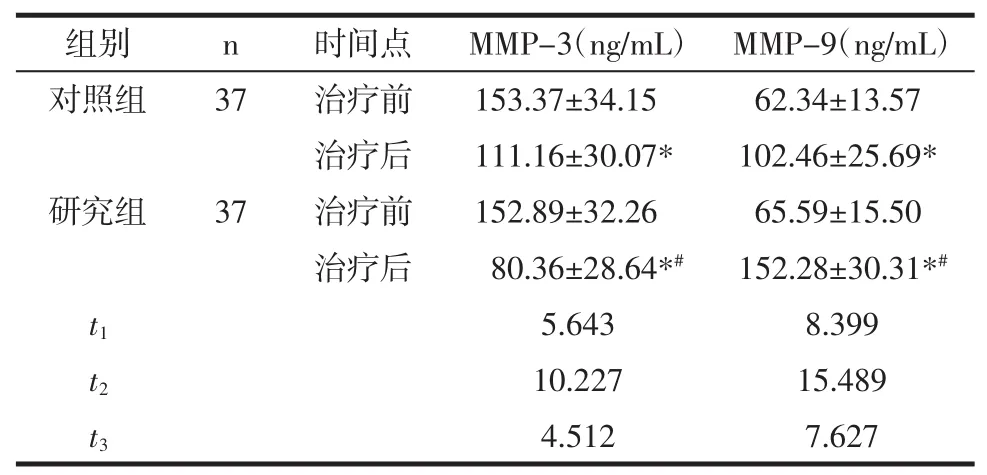
表4 2组间治疗不同时间点MMP-3、MMP-9含量分析 (±s)
注:*相对于治疗前,P<0.05;#相对于治疗后对照组,P<0.05,t1为对照组患者治疗前后对比,t2为研究组患者治疗前后对比,t3为2组患者治疗后对比。
组别 n 时间点 MMP-3(ng/mL) MMP-9(ng/mL)对照组 37 治疗前 153.37±34.15 62.34±13.57治疗后 111.16±30.07* 102.46±25.69*研究组 37 治疗前 152.89±32.26 65.59±15.50治疗后 80.36±28.64*# 152.28±30.31*#t1 5.643 8.399 t2 10.227 15.489 t3 4.512 7.627
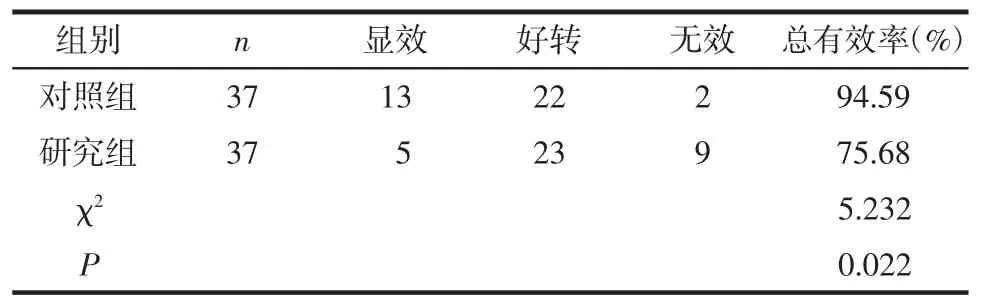
表5 2组临床疗效比较 例
2.6 安全性及复发率状况 所有患者均获得随访,无病例脱落现象,血、尿、便常规及肝肾功能无明显变化,对照组治疗期间出现月经失调2例、肠道反应2例、高血压1例,不良反应发生率为13.51%(5/37);研究组治疗期间出现月经失调3例,肠道反应2例,高血压1例,不良反应发生率为16.22%(6/37),2组间不良率对比,差异无统计学意义(P>0.05)。随访1年,研究组复发率18.92%(7/37)低于对照组复发率40.54%(15/37),2组间复发率对比,差异有统计学意义(χ2=4.140,P<0.05)。
3 讨论
SLE是风湿病中常见的皮肤损害疾患,主要表现为自身免疫介导,可导致机体多器官系统损伤。一旦表现出临床症状,需要及时采取治疗方案。目前其病因及发病机制尚未完全清楚,发病机制复杂,有学者认为其发生可能与环境、遗传、内分泌及感染等因素关系密切[8]。现阶段SLE尚不能完全根治,经过系统治疗后可缓解症状,尤其对于早期患者[9]。临床SLE多以药物治疗为主,多选用激素类药物和免疫抑制剂等,然而治疗后病情易反复,给临床治疗带来较大的难题。随着科学技术的进步,临床对SLE的发病机制进行深入探讨,SLE的诊断与治疗相比于之前已有显著的进展[10]。徐芳[11]研究发现采用环磷酰胺联合白芍总苷治疗SLE的治疗方案,临床疗效较为显著,长期服用可有效改善临床症状,提高预后。然而临床关于白芍总苷联合环磷酰胺对SLE血清学指标影响研究较少。
SLE患者血清免疫球蛋白及补体含量均存在相应变化,免疫球蛋白水平升高和C3、C4水平降低[12]。白芍总苷可以从多个环节对细胞免疫、体液免疫和炎性反应产生影响,因此其对SLE的自身免疫介导有抑制效应[13]。另外环磷酰胺为细胞周期非特异性药物,可以杀死或抑制增殖期和静止期的淋巴细胞。对本次研究结果进行分析,经白芍总苷联合环磷酰胺治疗后IgA、IgG、IgM含量较低,C3、C4含量较高,说明白芍总苷联合环磷酰胺合用可以减少血液循环中的B淋巴及T淋巴细胞,进而降低血清免疫球蛋白和免疫复合物水平。
人体内CD4+CD25+T细胞约占CD4+T细胞总数10%,是调节性T细胞的亚群之一。研究发现SLE患者外周血CD4+CD25+T细胞表达水平与SLE的发病关系密切,并与病情活动程度有明显的相关性[14]。据报道SLE患者经过白芍总苷辅助治疗后CD4+CD25+T细胞表达率显著提高[15]。对本次研究结果进行分析,经白芍总苷联合环磷酰胺治疗后CD4+CD25+含量较高,CD40+含量较低,说明白芍总苷联合环磷酰胺合用可以提高CD4+CD25+含量,提高自身免疫反应和维持免疫耐受,从而抑制各种免疫反应。
基质金属蛋白酶能够修复和重构正常生理过程中ECM,据此MMP可以作为炎性介质参与到SLE的发病及组织损伤过程[16]。基质金属蛋白酶9和基质金属蛋白酶3主要参与细胞外基质重塑、炎症反应、免疫反应等多个过程,对SLE患者的发病有一定的影响[17]。因此检测金属基质蛋白酶水平对判断SLE患者预后并进行及时治疗有重要意义。对本次研究结果进行分析,经白芍总苷联合环磷酰胺治疗后MMP-3含量较低,MMP-9含量较高,说明二者合用可以避免血管屏障遭到破坏,直接和间接减轻SLE患者血管炎性反应出现或加重,促进预后。
近年来较多研究证实,SLE发病及病情进展过程中,多种细胞因子及黏附分子含量升高有重要的作用[18-19],血清VEGF及s-VCAM水平可以用来评价SLE病情活动程度,并且二者与SLE的活动性关系密切[20]。对本次研究结果进行分析,经白芍总苷联合环磷酰胺治疗后sVCAM-1、IL-18和VEGF含量较低,说明二者合用可以调节SLE患者血管生成,阻断病情进展。另外相对于常规治疗,经白芍总苷联合环磷酰胺治疗后复发率降低,对于远期疗效方面,白芍总苷联合环磷酰胺的治疗方案具有更高的使用性及安全性。
本次研究发现采用白芍总苷联合环磷酰胺治疗SLE疗效确切,CD4+CD25+T细胞表达率提高,值得推广。然而本次研究时间、样本数有限,关于白芍总苷联合环磷酰胺对SLE外周血CD4+CD25+T细胞表达水平的影响需要循证医学来证实。
