新疆毛菊苣不同部位中山莴苣素和山莴苣苦素的含量测定
2020-03-12马晓丽刘照胜阿吉艾克拜尔艾萨
杨 建, 何 倩, 马晓丽, 刘照胜, 阿吉艾克拜尔·艾萨
(1新疆医科大学药学院;2中国科学院大学新疆理化技术研究所,乌鲁木齐 830011)
毛菊苣(CichoriumglandulosumBoissetHout)为菊科(Compositae)菊苣属(Cichorium)植物,主要生长于我国新疆[1-2]。研究表明毛菊苣主要化学成分为倍半萜类[3]、黄酮类[4]、香豆素类[5]、三萜类[6]、生物碱[7]、甾醇[8]等,具有较强的生物活性和药用价值[9-10]。毛菊苣的根、茎、种子均可入药[11],具有利尿消肿、清肝利胆、健胃消食等功效[12-15]。研究发现毛菊苣中的山莴苣素、山莴苣苦素等倍半萜内酯类成分具有良好的保肝和抗肿瘤活性[16-18]。本研究采用高效液相色谱(HPLC)法测定毛菊苣不同药用部位中山莴苣素和山莴苣苦素的含量,现报道如下。
1 仪器与试药
1.1 仪器Waters-e2695型高效液相色谱仪(美国Waters公司),R1001-VN型旋转蒸发仪(郑州长城科工贸有限公司),SHB-A型真空泵(郑州长城科工贸有限公司),KQ3200DE型超声波清洗器(昆山市超声仪器有限公司),Model AB-135s型分析天平(瑞士METTLER TOLEDO公司)。
1.2 试药毛菊苣药材2017年3月购买于新疆和田地区墨玉县,经新疆医科大学药学院天药教研室胡君萍教授鉴别为菊科(Compositae)菊苣属(Cichorium)植物毛菊苣(CichoriumglandulosumBoissetHout)的全草,标本保存于中国科学院新疆理化技术研究所。山莴苣素对照品、山莴苣苦素对照品(中国科学院新疆理化技术研究所提供,纯度>95%,),甲醇(美国Sigma公司,色谱纯), 甲酸为分析纯试剂, 蒸馏水(屈臣氏), 超纯水(艾柯超纯水)。
2 方法与结果
2.1 样品溶液的制备分别称取过40目筛的毛菊苣根茎和种子粉末4.0 g,置于具塞锥形瓶中,加入甲醇40 mL,超声提取 30 min(功率100 W,频率50 KHz),3 000 r/min离心10 min,收集上清液,残渣按上述方法重复提取1 次,合并2次提取液,减压浓缩,用甲醇溶解定容至100 mL,即得样品溶液。
2.2 对照品溶液的制备称取山莴苣素、山莴苣苦素标准品适量,分别置于5 mL容量瓶中,用甲醇定容至刻度,得到浓度为31.8 μg/mL山莴苣素和浓度为29.4 μg/mL山莴苣苦素对照品溶液,置于4℃冰箱冷藏,备用。
2.3 色谱条件采用Inertial ODS-SP色谱柱(4.6 mm×250 mm,5 μm),流动相:甲醇(A)-0.2%甲酸(B),洗脱梯度:0~10 min,30% A~40% A; 10~20 min,40%~50% A;20~40 min,50%~70% A,流速1.0 mL/min,柱温30℃,检测波长254 nm,进样量10 μL。
2.4 系统适应性实验按“2.3”项下色谱条件,山莴苣素和山莴苣苦素的保留时间分别为7.25 min 和24.15 min,两个峰的理论塔板数均>3 000,供试品中两个色谱峰与其他相邻峰分离度>1.5,无干扰,表明本色谱条件系统适应性良好,见图1~3。
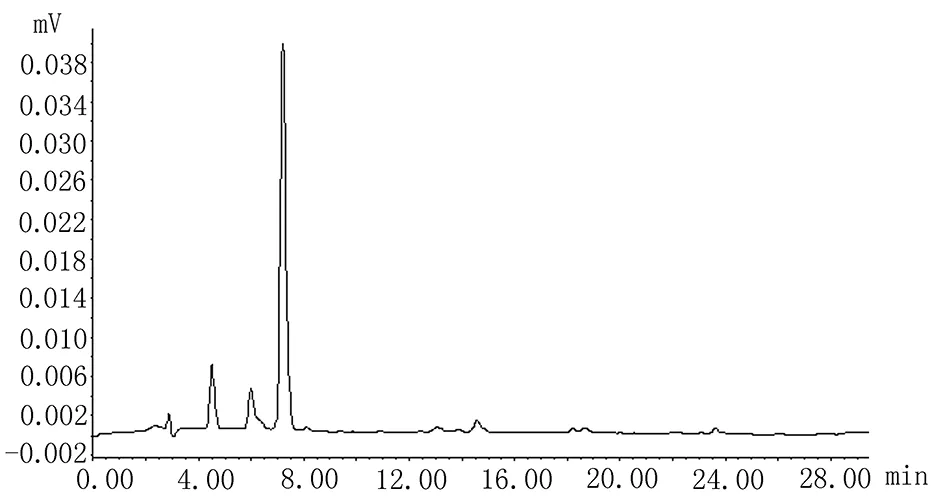
图1 山莴苣素对照品HPLC色谱图
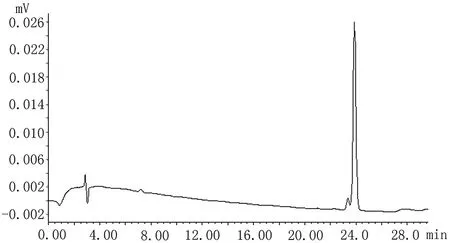
图2 山莴苣苦素对照品HPLC色谱图

图3 样品HPLC色谱图
2.5 回归方程建立分别吸取“2.2”项下山莴苣素、山莴苣苦素对照品溶液适量,置于 10 mL 量瓶中,用甲醇定容至刻度,分别得到3.18、6.36、15.91、31.81、47.70 μg/ mL系列浓度的山莴苣素溶液和2.94、5.88、7.35、14.70、44.11、73.52 μg/mL系列浓度的山莴苣苦素溶液。按“2.3”项下色谱条件进行测定,记录峰面积,以峰面积(X)对对照品浓度(Y)进行线性回归,得到山莴苣素的回归方程为:Y=18 472X-8 443.9,r=0.999 8,山莴苣素的浓度范围在3.18~47.70 μg/mL线性关系良好;山莴苣苦素的线性回归方程为:Y=10 753X-11 112,r=0.999 9, 山莴苣苦素的浓度范围在2.94~73.50 μg/mL,线性关系良好。
2.6 精密度试验吸取“2.2”项下山莴苣素、山莴苣苦素对照品溶液各10 μL,按照“2.3”项色谱条件连续进样6次,以山莴苣素和山莴苣苦素峰面积进行计算,山莴苣素的RSD为1.2%,山莴苣苦素的 RSD为1.6%,表明本方法精密度良好。
2.7 重复性试验取同一样品按“ 2.1” 项方法平行制备6份样品溶液,按“2.3”项下色谱条件测定,经计算样品中山莴苣素含量变化的RSD为1.2%,山莴苣苦素含量变化的RSD为1.6%,表明本法重复性良好。
2.8 稳定性试验分别吸取“2.1”项下样品溶液10 μL,按“2.3”项下色谱条件分别在0、2、4、6、12 h时测定样品中山莴苣素、山莴苣苦素的含量,以峰面积计,经计算样品中山莴苣素RSD为3.1%,山莴苣苦素RSD为2.6%,表明样品在12 h内稳定性良好。
2.9 加样回收率试验称取同一批已知含量的毛菊苣药材9份,分别加入高、中、低剂量的对照品溶液,按“2.1”项下方法制备样品溶液,按“2.3”项下色谱条件测定山莴苣素、山莴苣苦素含量,经计算山莴苣素和山莴苣苦素的平均回收率分别为100.8%和97.3%,RSD分别为2.5%和3.1%,表明方法准确度良好,见表1、2。
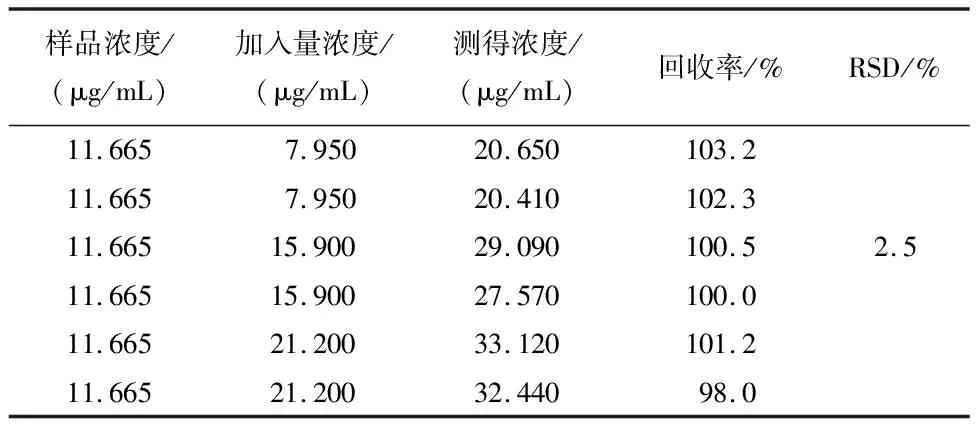
表1 山莴苣素加样回收率实验结果
2.10 含量测定分别称取毛菊苣样品按“2.1”项下方法制备样品溶液,按“2.3”项下色谱条件测定,毛菊苣根茎部位中山莴苣素、山莴苣苦素含量分别为0.378 0、0.172 0 mg/g,种子部位中山莴苣素、山莴苣苦素含量0.381 5、0.331 8 mg/g。

表2 山莴苣苦素加样回收率实验结果
3 讨论
本研究建立了一种HPLC法测定新疆毛菊苣中山莴苣素、山莴苣苦素含量的方法,系统适应性和方法学考察表明,该方法准确、灵敏、重现性好。对新疆毛菊苣根茎及种子部位中山莴苣素、山莴苣苦素进行提取及含量测定,结果表明 2种成分在毛菊苣不同部位中的含量存在差异,山莴苣苦素多存在于毛菊苣的种子中,山莴苣素多存在于毛菊苣的根茎部位,说明毛菊苣不同部位中山莴苣素、山莴苣苦素会随着生长差异发生变化,应根据这两种成分的药理活性加以区别,为毛菊苣合理利用及质量评价提供科学依据。
