以蛋白翻译后修饰的视角探究脂肪肝的发病机制
2020-03-11张嘉洸盛亮
张嘉洸,盛亮
(南京医科大学基础医学院药理系,江苏 南京 211166)
脂肪肝问题已经成为遍及全球的健康问题,由脂肪肝引起的一系列机体代谢紊乱严重危害了人体的健康和生活质量。脂肪肝是非酒精性脂肪性肝炎、肝硬化、肝细胞癌和肝功能衰竭的既定危险因素。它还与血脂异常、2型糖尿病和高血压的发展风险增加有关[1]。而脂肪肝的发生,主要是由于脂质的沉积过多引起的肝脏脂肪变性,要研究脂肪肝的发病机制和治疗措施,就要从与脂质代谢相关的方面入手。当肝脏组织中脂肪酸(FA)输入的速率[摄取和合成以及随后酯化成甘油三酯(TG)]大于FA输出(氧化和分泌)的速率时,就会发生脂肪变性[2]。而导致肝脏脂质增多的因素包括了4个方面:①过多游离脂肪酸的摄取;②增加从头脂肪合成;③降低脂肪的氧化;④减少脂肪酸的出口[3]。每个方面的代谢过程都会受到多种酶和蛋白质的调控,对这类酶和蛋白质的翻译后修饰,可能会对脂肪肝的发生发展有着一定的影响。本文主要从4个方面总结了多个与脂质代谢相关的蛋白翻译后修饰的方式和对脂质代谢过程的影响。
1 脂肪的分解
在正常人体组织中,脂类绝大部分以TG的形式储存在脂肪组织中,无论是要进行脂肪的氧化分解或是内源性脂肪酸的合成,都需要进行脂肪动员,将TG分解为游离脂肪酸[3]。TG的水解是一系列有序调控的过程,TG首先被脂肪甘油三酯脂肪酶(ATGL),激素敏感性脂肪酶(HSL)水解成甘油二酯(DG)和游离脂肪酸(FFA)[4],其次,甘油二酯被HSL水解成甘油一酯(MG)和FFA,最后甘油一酯被单线甘油酯酶(MGL)水解成甘油和FFA(见图1)。
若脂质的分解过程紊乱,过多的脂质分解会导致内源性脂肪酸的合成和脂质的氧化增多,导致机体内的脂质堆积和氧化损伤。

图1 脂肪的水解
1.1 脂肪甘油三酯脂肪酶(ATGL) ATGL是在细胞内脂肪分解过程中使TG储存释放脂肪酸的关键酶,提供肝脏组织所需要摄取的游离脂肪酸,主要参与TG分解为DG的过程,其能力强于HSL对脂质的分解作用。同时ATGL也是脂解的限速酶,ATGL的缺乏可能会造成细胞内脂质的空泡化沉积,尤其是在近曲小管处。严重的脂质沉积会带来细胞凋亡等问题,导致肾脏纤维化和功能障碍[5]。
ATGL的修饰方式主要为:①E3泛素连接酶COP1(也称为RFWD2)与ATGL的共识VP基序结合并通过主要在赖氨酸100残基上K-48连接的多泛素化作用将其靶向蛋白酶体降解,降低ATGL的活性和效应,引起脂质的堆积[6];②TSH(促甲状腺激素)与TSHR(促甲状腺激素受体)结合后,激活蛋白激酶A(PKA),PKA结合ATGL的丝氨酸406残基,抑制了ATGL的活性[7];③酰基辅酶A(LCA)直接与ATGL N-末端patatin样磷脂酶结构域(PNPLA)结合,抑制了ATGL活性[8]。
1.2 激素敏感脂肪酶(HSL) HSL基因位于染色体19Q 13.3,HSL由脂肪组织分泌,也在胰腺、睾丸、肌肉、肾上腺等组织发现表达。HSL是一种细胞内的中性脂肪酶,特异性比较弱,能水解甘油三酯、甘油二酯、甘油一酯和胆甾烯基酯,却没有水解磷脂酶活性。伴随HSL的基因敲除,脂肪水解能力被破坏,脂质合成和脂肪代谢能力明显下降,这说明了HSL在脂肪的合成及分解代谢中起着无可替代的作用。与ATGL相比,ATGL催化TG底物的能力强于催化DG底物的能力,而HSL催化DG底物的能力10倍于催化TG底物的能力,ATGL和HSL共同催化哺乳动物储存在脂肪组织内的TG[9]。HSL的缺乏可导致年龄依赖性的肝脏脂肪变性,诱导脂肪肝的产生[10]。
HSL具有两个磷酸化位点。站点1被称为监管站点,位于HSL蛋白序列中Ser-563的位置,被认为在HSL的激活中起关键作用。该位点被环AMP依赖性蛋白激酶和糖原合成酶激酶-4磷酸化。同时还受到激素的调控,肾上腺素通过cAMP级联反应PKA磷酸化HSL,而胰岛素水解cAMP降低PKA的含量来降低HSL的磷酸化,降低其对于脂质的水解作用。站点2称为基础站点,该位点置于HSL蛋白中Ser-565的位置,被两种蛋白激酶磷酸化,即Ca2+/钙调蛋白依赖性激酶Ⅱ和AMP激活蛋白激酶。同时,Ser-659和Ser-660也是负责激活HSL的主要PKA磷酸化位点。此外,PKC可通过细胞外信号调节激酶(ERK)依赖性的途径磷酸化HSL的Ser-600并增加脂肪细胞中的HSL活性。
关于HSL的去磷酸化,Ser-563被B56alpha/PP2A(蛋白磷酸酶2A)和PP2C有效去磷酸化,而Ser-565主要被PP2A去磷酸化[11]。
2 游离脂肪酸的摄取
人体内的游离脂肪酸可来自内源性的脂肪合成,甘油三酯的水解和外源性的脂肪摄入。游离脂肪酸经肝实质细胞摄取后,可进行合成脂肪和脂肪氧化两种步骤,为机体储存能量或是提供机体所需要的能量消耗。无论是进行那个步骤,游离脂肪酸都要先进行活化,变成脂肪酰基辅酶A才可参与下一步的反应,其中需要长链酰基辅酶A合成酶(ACSL1)等酶的作用(见图2)。
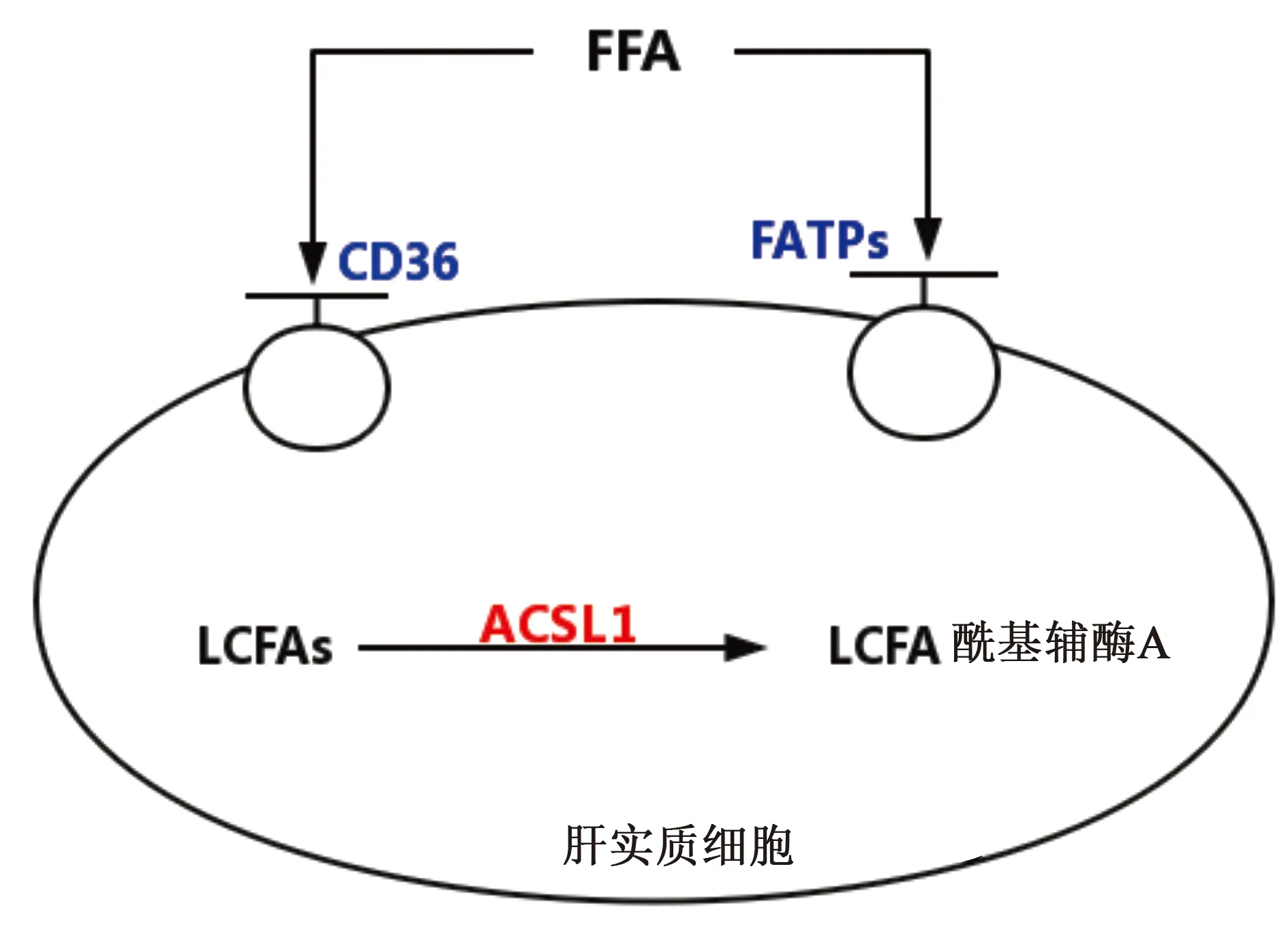
图2 游离脂肪酸的摄取
2.1 CD36 CD36是清道夫受体,属于多功能蛋白,是多种配体的共同受体。其在高亲和力组织摄取长链脂肪酸(FAs)中起重要作用,将游离脂肪酸转运到细胞内,供细胞利用[12]。CD36的活性若受到抑制会减少极低密度脂蛋白(VLDL)的输出,可能是减轻脂肪肝的一种可行的方法[13]。
CD36受到的翻译后修饰的主要方式为:①PKC与PKA可分别磷酸化CD36的Thr-92和Ser-237,抑制了CD36对脂质的摄取。而肠道的碱性磷酸酶gIAP可使CD36去磷酸化,使得其摄取脂质的能力提高[14];②CD36还受泛素化的调节,CD36是Parkin(E3连接酶)的靶点,Parkin作用于CD36 C末端的赖氨酸,使CD36水平升高,稳定性增加[15];③FA摄取和信号传导中的CD36可被长链FA的磺基-N油酸羟基琥珀酸亚胺(NHS)酯不可逆地抑制。磺酸-N-琥珀酰亚胺油酸酯(sso)为其中一种,sso可作用于CD36的Lys-164,使CD36乙酰化提高它摄取脂质的能力[16]。
2.2 脂肪酸转运蛋白1(FATP1) FATP1是FATP家族成员,主要分布在脂肪组织和肌肉组织中,同时也分布在肝脏细胞内。它可增强细胞对长链脂肪酸(LCFA)的摄取[17]。它对脂肪酸的转运能力较CD36弱,但是仍是人体内主要的脂肪酸转运蛋白,若活性降低即可减少组织对脂肪酸的摄取,减少细胞内脂肪的沉积。同时,FATP1还与视网膜有关,FATP1的缺乏会影响视网膜的光反应和暗适应[18]。
雷帕霉素复合物1(mTORC1)和p70核糖体蛋白S6激酶1(S6K1)轴可激活导致肥胖和衰老的代谢途径,其中就包括对FATP1的激活。mTORC1-S6K1在Ser999处对谷氨酰 - 脯氨酰tRNA合成酶(EPRS)的磷酸化,诱导其从氨酰基tRNA多转录酶复合物中释放,磷酸化EPRS结合FATP1,激活FATP1,诱导其转运至质膜和长链脂肪酸摄取[19]。
2.3 长链酰基辅酶A合成酶1(ACSL1) ACSL1在脂肪酸代谢中起关键作用,是长链脂肪酸硫酯化成酰基辅酶A衍生物所必需的。长链脂肪酸(LCFAs)转运到细胞内后,无论是进行合成代谢还是分解代谢,都需要进行活化,即在ACSL1的作用下,转化为长链脂肪酰基辅酶A,所以ACSL1是长链脂肪酸进入代谢的第一步反应的催化酶。如果ACSL1的活性或水平急剧变化,长链脂肪酰基辅酶A增多,在肝脏中蓄积的TG和氧化产生的自由基也增多,将导致脂肪肝的加重和肝脏的氧化损伤。但肝脏中ACSL1的特异性缺失并不会影响肝脏中的脂质水平[20]。
所有入选患者由专业的视光医师给予验配试戴,最后确定镜片参数。戴镜时间保证每晚8~10 h,戴镜后1个月、3个月和6个月复查。本项研究遵循赫尔辛基宣言和临床研究的伦理标准和规范,向入选患者交代检查流程,参与研究的青少年患者及其监护人均知情同意。所有检查由同一名经验丰富的医师操作。
ACSL1的翻译后修饰主要为磷酸化和乙酰化,AMPK可作用于ACSL1的Ser-278,磷酸化ACSL1抑制其活性,而SIRT3可使ACSL1的Lys-285脱乙酰化而增强其活性[21]。
3 脂肪的从头合成
脂肪酸在体内的合成过程复杂,受到多种因子的调控,某个酶或细胞因子的活性及水平改变都会影响到内源性的脂质合成。
脂质的从头合成需要的原料为乙酰辅酶A,来源于葡萄糖的代谢。葡萄糖通过糖酵解水解成丙酮酸,丙酮酸进入线粒体产生乙酰辅酶A。乙酰辅酶A通过柠檬酸合成酶与草酰乙酸结合形成柠檬酸盐。柠檬酸盐被输出到细胞质中并通过ATP-柠檬酸裂解酶(ACLY)分裂成乙酰辅酶A和草酰乙酸。在细胞质中,乙酰辅酶A被乙酰辅酶A羧化酶(ACC)羧化形成丙二酰辅酶A。丙二酰辅酶A和NADPH均用作于乙酰辅酶A,通过脂肪酸合成酶(FASN)合成棕榈酸(16碳脂肪酸)。棕榈酸被内质网(ER)中的脂酰辅酶A延伸酶(Elov1)家族成员延长以产生长链脂肪酸(LCFA)(> 16碳链)。LCFA通过硬脂酰辅酶A去饱和酶(SCDs),形成单不饱和和多不饱和的LCFA。不饱和脂肪酸再在mtGPAT1和Dgat1/2的催化下与三磷酸甘油酯化形成三酰基甘油(TAG)[20](见图3)。

图3 脂肪的从头合成
从头合成脂质是人体在进食时对能量进行储存的方式,产生不饱和脂肪酸并和三磷酸甘油形成三酰基甘油储存。从头合成的脂质增多势必会导致体内的TAG含量增多,诱导脂肪肝的产生。
关于参与脂质从头合成过程相关酶的翻译后修饰方式如下:
3.1 ATP-柠檬酸裂解酶(ACLY) ACLY是一种胞质酶,可催化柠檬酸生成乙酰辅酶A。若ACLY的水平提高,则会增加乙酰辅酶A的含量从而促进脂质的合成,导致了非酒精性脂肪肝等疾病的进一步发展[22]。
ACLY的翻译后修饰包括了泛素化、乙酰化和磷酸化:①Cullin3(CUL3)是CUL3-RING泛素连接酶复合物的核心蛋白,CUL3可通过其衔接蛋白KLHL25(Kelch样家族成员25)与ACLY相互作用,泛素化并降解细胞中的ACLY,通过对ACLY的负调节,抑制脂质合成[23];②ACLY在赖氨酸残基540,546和554处被乙酰化。在高葡萄糖下,P300 /钙结合蛋白(CBP)相关因子(P300/CBP associated factor,PCAF)乙酰转移酶刺激这三个赖氨酸残基的乙酰化,并通过阻断其泛素化和降解来增加ACLY稳定性。相反,蛋白质脱乙酰基酶sirtuin 2(SIRT2)使ACLY去乙酰化并使其不稳定。其中,Lys-540为乙酰化和泛素化的竞争位点,两种修饰起着相反的作用[24];③丝氨酸/苏氨酸激酶1(AKT)可作用于ACLY的Ser-454,通过磷酸化激活ACLY,促进脂质的合成[25]。
3.2 乙酰辅酶A羧化酶1(ACC1) ACC1是ACC家族中的一种,可催化乙酰辅酶A的ATP依赖性羧化,这是脂肪酸生物合成的限速步骤。可见ACC1在脂肪的从头合成中的重要性。抑制ACC1的活性就可减少内源性脂肪酸的生成,进而防止脂肪肝的进一步发展。
ACC1的翻译后修饰的方式主要为磷酸化。
①AMP激活蛋白激酶(AMPK)AMPK可使 ACC1上的ser79磷酸化并抑制其活性,从而抑制了脂肪酸的合成[26];②TGFβ激活激酶(TAK)1 可介导ACC1磷酸化,TAK1可通过磷酸化AMPK的Thr-172位点使其激活,进而磷酸化ACC,降低ACC的活性[27];③蛋白磷酸酶2A异源三聚体(PP2A)可直接使AMPK的Thr-172去磷酸化而使AMPK活性降低,从而降低了ACC的磷酸化程度,提高了ACC的活性,促进脂质的合成积累[28];④核苷二磷酸激酶(NDPK)通过与AMPK竞争ATP的结合位点,调节AMPK的磷酸化程度,维持AMPK的活性,并调控AMPK体内的靶蛋白ACC1的磷酸化[29]。
3.3 脂肪酸合酶(Fasn) Fasn在内源脂肪酸的合成过程中,负责催化长链脂肪酸的合成,使丙二酰辅酶A与乙酰辅酶A聚合形成棕榈酸,是脂肪酸合成过程中的关键酶。FASN活性的增强和减弱都会对脂质的从头合成产生巨大的影响。许多实验表明,从基因层面抑制FASN的表达可以减少体内脂肪酸的合成从而减轻脂肪肝的程度。另一方面,在翻译后修饰的层面上,FASN受到磷酸化,乙酰化和泛素化的调节:①Fasn不同的磷酸化状态可能不同地调节Fasn的活性,苏氨酸的磷酸化可以抑制Fasn 的活性,而酪氨酸的磷酸化可以增强Fasn的活性。HRG(人表皮因子受体调节蛋白)可以激活HER2(人表皮生长因子受体2)酪氨酸激酶,从而导致诱导FASN的酪氨酸磷酸化,增强Fasn 的活性,而AMPK的磷酸化激活后可以磷酸化Fans中的苏氨酸残基,使得Fasn 的活性受到抑制,脂质生成减少[30];②酪氨酸磷酸酶Shp2作为连接分子可将泛素E3连接酶COP1(也称为RFWD2)与FASN连接,从而加速FASN泛素化和降解,其中p38 MAP激酶可使COP1磷酸化,诱导COP1的核输出,由细胞核至细胞质,参与FASN-Shp2-COP1复合物的形成[31]。而泛素特异性蛋白14(USP14)可阻断FASN泛素化,增强FASN的稳定性[32];③赖氨酸乙酰转移酶(KAT8)催化FASN乙酰化,然后促进FASN与 E3泛素连接酶TRIM21结合,导致随后的多泛素化和蛋白酶体降解。相反,HDAC3(组蛋白脱乙酰基酶3)介导的FASN去乙酰化有助于提高FASN蛋白的水平,促进细胞中从头脂肪酸的合成[33]。
3.4 硬脂酰辅酶A去饱和酶1(SCD1) SCD1可催化单不饱和脂肪酸(MUFA)的合成,主要是油酸和棕榈油酸,它们在控制高碳水化合物饮食的体重增加中起重要作用[34]。实验表明,SCD1在人体中的过度表达可能与高甘油三酯血症(HTG),非酒精性脂肪肝,动脉粥样硬化和糖尿病的病因有关,降低SCD1的活性可能是减少这些疾病的可行方法[35]。
SCD1的翻译后修饰方式为:①表皮生长因子受体(EGFR)具有酪氨酸激酶的活性,可与SCD1在Y55结合并磷酸化SCD1,维持SCD1的稳定性,干扰SCD1的泛素化,增加MUFA(单不饱和脂肪酸)水平[36];②SCD1还可通过泛素-蛋白酶体依赖的ERAD途径进行泛素化降解,SCD1末端含有66个残基的富含PEST序列的N-末端区对于蛋白酶体依赖性十分重要,对于泛素化降解敏感[37]。
3.5 甘油-sn-3-磷酸酰基转移酶1(mtGPAT1) mtGPAT1控制三酰基甘油(TAG)合成的第一步,对于慢性代谢紊乱如原发性非酒精性脂肪性肝病(NAFLD)至关重要[38]。抑制mtGPAT1的活性可称为脂肪肝治疗的靶点。
mtGPAT1主要受到磷酸化的修饰。
①酪氨酸激酶2(CK2)可磷酸化mtGPAT1的丝氨酸632、639位点,增强其活性[39];②增加蛋白激酶Cζ磷酸化和膜易位,可磷酸化mtF0F1-ATP酶β-亚基,降低其酶活性,从而抑制mtGPAT1活化[38];③AMPK可作用于mtGPAT1蛋白质的C末端结构域。AMPK磷酸化mtGPAT1可降低其活性[40]。
3.6 二酰基甘油酰基转移酶1/2(DGAT1) DGAT1/2是一种完整的ER膜蛋白,可催化二酰基甘油和脂肪酰基CoA向三酰基甘油(TAG)的转化。DGAT1突变导致其产物表达减少,导致先天性腹泻疾病,这表明了DGAT1在脂质代谢中的重要作用[41]。
DGAT2主要修饰方式为泛素化,它有两个跨膜结构域(TMD1和TMD2),可被蛋白酶体依赖性ERAD(ER相关的降解)途径快速降解,其中,TMD1是DGAT2不稳定性的决定因素,其中的两个赖氨酸残基(K63和K66)首先被认为是泛素化的位点,被E3连接酶gp78(AMFR,autocrine motility factor receptor )识别并在ER处快速降解[42]。
4 脂肪的氧化
脂肪的氧化分解是机体功能的主要手段之一,脂质作为人体的主要储能物质,主要以TG的形式储存在人体的脂肪组织和VLDL中。当机体进行脂肪动员时,TG在脂肪水解酶ATGL、HSL等作用下分解成游离脂肪酸,经细胞摄取后在ACSL1的作用下活化,变为脂酰辅酶A,通过CPT1a进入线粒体,进行β-氧化,经过脱氢,加水,再脱氢,硫解四步后,分解为一分子的乙酰辅酶A和比原来少两个碳的脂酰辅酶A,为机体提供不同长度的脂肪酸和能量[43](见图4)。
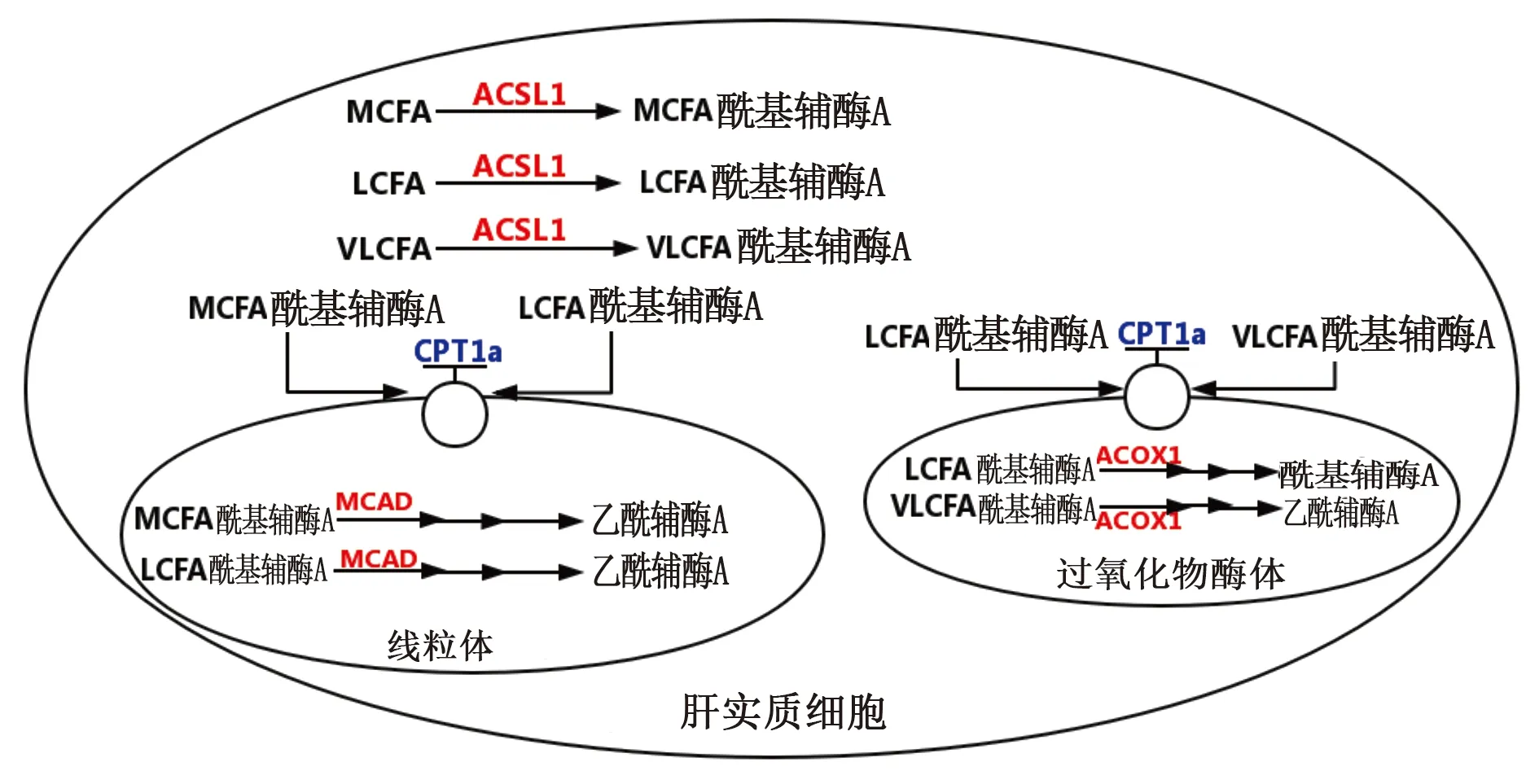
图4 脂肪的氧化
若细胞对脂肪的氧化利用程度降低,脂肪动员减弱,就会导致脂质在细胞内部的过度沉积,诱导脂肪肝的产生。而影响氧化过程与参与反应的酶的活性密不可分。通过调节CPT1a等酶的活性,就能对脂肪的氧化进行调控,一定程度上抑制脂肪肝的进一步发展。
4.1 肉毒碱棕榈酰转移酶1a(CPT1a) CPT1a在脂质代谢中起作用,将LCFAs转运到线粒体内进行氧化分解,释放能量。而CPT1a缺乏症是一种罕见的长链脂肪酸氧化常染色体隐性遗传病。在禁食或生病期间,患者有发生低血糖和肝功能衰竭的风险[44],可见CPT1a在脂肪氧化中的重要作用。
CPT1a的活性可受到丙二酰辅酶A的抑制,而AMPK可磷酸化ACC,使ACC活性降低,降低丙二酰辅酶A的水平,从而提高了CPT1a的活性[45]。
4.2 中链酰基辅酶A脱氢酶(MCAD) MCAD是一种对脂肪酸代谢至关重要的线粒体基质蛋白,在脂质的氧化过程中起重要作用。若MCAD的含量与活性改变,会使得机体的能量代谢产生紊乱。MCAD缺乏症是最常见的脂肪酸氧化病,患者可能出现急性高氨血症、低血糖、脑病和肝大,主要是在长时间的并发感染后。也可能发生与心跳障碍有关的猝死[46]。
MCAD主要通过磷酸化进行翻译后修饰。PTEN诱导的假定激酶1(PINK1)是一种线粒体靶向激酶,PINK1是丝氨酸/苏氨酸激酶,可磷酸化MCAD的S347,增强其活性从而促进MCAD对中链脂肪酸的氧化[47]。
4.3 长链酰基辅酶A脱氢酶(LCAD) LCAD是参与脂肪酸氧化的关键酶,它与MCAD类似,对于脂肪酸的氧化分解有重要意义。有实验证明LCAD缺乏的小鼠能量代谢效率降低,对葡萄糖的依赖性提高,易感与生物饥饿的流感最终消瘦死亡[48]。可见LCAD在能量代谢中的重要性,人体缺失LCAD可能将导致机体供能不足而影响功能。
SIRT3是一种线粒体NAD+依赖性脱乙酰酶,可通过使LCAD的赖氨酸42残基去乙酰化,提高LCAD的活性,减少脂质的积累[49]。
4.4 酰基辅酶A氧化酶1(ACOX1) ACOX1是脂肪酸β-氧化中的第一种限速酶,是β-氧化不可或缺的部分。但它参与的不是线粒体的β-氧化,而是在过氧化物酶体中的不同于线粒体的β氧化,底物主要包括了极长链脂肪酸、长链脂肪酸、2-甲基支链脂肪酸等。其β-氧化的过程包括了氧化、水化、脱氢和硫解,可合成体内所必需的生理活性物质,但氧化不彻底,通常是进行β-氧化循环而缩短碳链[50]。抑制了ACOX1的活性将减少极长链脂肪酸等进行氧化,导致过多的脂肪积累,诱导脂肪肝的产生。
脱乙酰酶sirtuin 5(SIRT5)介导的赖氨酸脱琥珀酸化可通过使ACOX1中的赖氨酸脱琥珀酸乙酰化,损害其活性二聚体引起ACOX1的酶抑制,防止出现脂质过氧化带来的机体氧化损伤[51]。
总之,脂肪肝的发生和发展是一个复杂的过程,受到多种途径和机制的共同影响,而脂质代谢的紊乱是脂肪肝发生的重要原因,了解脂质的转运,合成及氧化过程,可为脂肪肝的研究和治疗提供十分有用的线索。本文分别总结了在脂质代谢的3个不同步骤——转运摄取,从头合成和脂肪氧化中起作用的酶和蛋白质的翻译后修饰的方式及其功能,可能对于脂肪肝的研究有一定的帮助。当然,这些蛋白质的翻译后修饰是否在脂肪肝中起变化还需要试验的证明,同时,这些蛋白质在基因水平的变化也是研究脂肪肝的过程中需要关注的地方,对于脂肪肝的研究,还有许多事情等着我们。
