柱前衍生高效液相色谱法测定复方氨基酸注射液中氨基酸的含量
2020-03-11邓红英张永文李永贵
邓红英,张永文,李永贵
(1.山东大学齐鲁医院药品调剂科,山东 济南 250012;2.济南市中心医院药剂科,山东 济南 250014;3.山东省药学科学院,山东省化学药物重点实验室,山东 济南 250101;4.山东省药学科学院,山东省医用高分子材料重点实验室,山东 济南 250101)
复方氨基酸注射液(18AA)是一种含有合成人体蛋白质所需要的18种氨基酸与其他辅料配制而成的灭菌水溶液,临床上主要用于蛋白质摄入不足以及吸收障碍等氨基酸不能满足机体代谢需要患者的治疗,也常用于改善手术后患者的营养状况[1]。由于氨基酸具有高极性、低挥发性、大部分无强发色基团的特性,因此其分离和检测都较为困难,目前常用的检测方法有氨基酸分析仪检测法、离子色谱法、柱前衍生高效液相色谱(HPLC)法等。方法存在仪器昂贵、运行费用高、衍生物不稳定且有一定毒性、各组分分离效果差、样品检测时间长等诸多问题[2-7]。本研究建立了2,4-二硝基氟苯作为衍生化试剂[8-9],高效液相色谱法检测复方氨基酸注射液(18AA)中氨基酸的方法,该方法分离效果好,且重现性稳定。
1 仪器与试药
1.1 仪器 高效液相色谱仪(LC-20AT型泵、SPD-M20A型检测器,Lab solution液相色谱数据工作站,日本岛津公司);BT125D分析天平(Sartorius);PHSJ-3F精密酸度计(上海雷磁仪器厂);超纯水机(艾柯)。
1.2 试药 门冬氨酸(批号:140691-200401,纯度:100%);谷氨酸(批号:140690-201203,纯度:100%);丝氨酸(批号:140688-201102,纯度:100%);甘氨酸(批号:140689-201605,纯度:100%);苏氨酸(批号:140682-201302,纯度:99.9%);盐酸精氨酸(批号:140781-200801,纯度:100%);脯氨酸(批号:140677-201507,纯度:99.9%);丙氨酸(批号:140680-201303,纯度:99.9%);缬氨酸(批号:140681-201202,纯度:99.6%);甲硫氨酸(批号:140684-201102,纯度:100%);胱氨酸(批号:140632-200502,纯度:99.3%);异亮氨酸(批号:140683-201302,纯度:99.9%);亮氨酸(批号:140687-201503,纯度:99.9%);色氨酸(批号:140686-201303,纯度:99.9%);苯丙氨酸(批号:140676-200405,纯度:100%);盐酸组氨酸(批号:140693-200401,纯度:100%);盐酸赖氨酸(批号:140673-201509,纯度:99.9%);酪氨酸(批号:140609-201513,纯度:99.8%)对照品均购自中国食品药品检定研究院。复方氨基酸注射液(18AA)(自制中试品,批号:20160501、20160502、20160503);2,4-二硝基氟苯(批号:201512271,纯度99.0%,成都艾科达化学试剂有限公司);乙腈为色谱纯;碳酸氢钠、磷酸二氢钾、氢氧化钠、磷酸为分析纯。
2 方法与结果[10]
2.1 溶液制备 配样溶剂:pH 7.0磷酸盐缓冲液。混合对照品储备溶液:精密称取氨基酸对照品各适量,加水溶解,制成每1 mL中含有门冬氨酸62.45 μg、谷氨酸18.83 μg、丝氨酸25.11 μg、甘氨酸190.02 μg、苏氨酸62.50 μg、盐酸精氨酸125.02 μg、脯氨酸25.08 μg、丙氨酸50.06 μg、缬氨酸89.95 μg、甲硫氨酸56.25 μg、胱氨酸2.65 μg、异亮氨酸88.05 μg、亮氨酸122.15 μg、色氨酸22.50 μg、苯丙氨酸133.20 μg、盐酸组氨酸62.52 μg、盐酸赖氨酸107.58 μg、铬氨酸6.30 μg的混合溶液。
混合对照溶液:精密量取混合对照品储备溶液2 mL置10 mL量瓶中,加入5%碳酸氢钠溶液1 mL与1%的2,4-二硝基氟苯乙腈溶液1 mL,摇匀,置60 ℃水浴,暗处加热,间隔20 min振摇1次,60 min后取出,放冷,加磷酸盐缓冲液(pH 7.0)至刻度,摇匀。
供试品溶液:精密量取复方氨基酸注射液(18AA)50 μL置10 mL量瓶中,加入5%碳酸氢钠溶液1 mL与1%的2,4-二硝基氟苯乙腈溶液1 mL,摇匀,置60 ℃水浴中,暗处加热,间隔20 min振摇1次,60 min后取出,放冷,加磷酸盐缓冲液(pH 7.0)至刻度,摇匀。
空白溶液:按处方称取除氨基酸外的各组分,加水配成空白对照溶液。精密量取空白对照溶液50 μL至10 mL量瓶中,照供试品溶液配制方法配制成空白溶液。
2.2 色谱条件 色谱柱:Agilent HC-C18(4.6 mm×250 mm,5 μm),流动相A为乙腈-水(60∶40),流动相B为乙腈-磷酸盐缓冲液(0.014 mol·L-1的磷酸盐缓冲液pH 8.2)(9∶91);流速1.0 mL·min-1;柱温27 ℃,检测波长:360 nm;进样体积10 μL。梯度程序见表1。
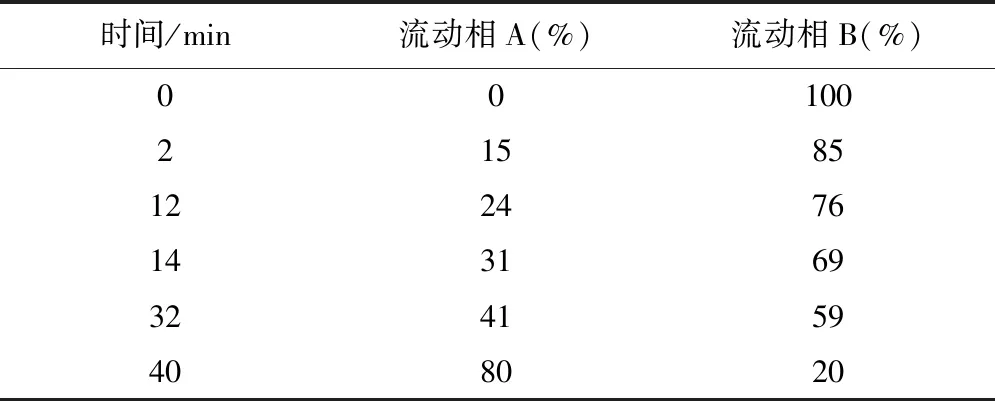
表1 梯度洗脱程序表
2.3 专属性试验 分别取“2.1”项下混合对照品溶液、供试品溶液及空白溶液10 μL注入液相色谱仪。记录色谱图及峰面积。试验结果表明,在本检测条件下,空白溶液对氨基酸检测无干扰,且18种氨基酸分离良好(见图1)。
2.4 定量限与检测限 精密量取“2.1”项下混合对照溶液,加配样溶剂稀释,制成不同浓度梯度的溶液,按上述色谱条件进行测定,分别取各溶液10 μL注入液相色谱仪,记录色谱图。计算各氨基酸的定量限与检测限。
2.5 线性试验 精密量取“2.1”项下混合对照品储备溶液1、1.5、2、2.5、3 mL,分别置10 mL量瓶中,加入对应比例的5%碳酸氢钠溶液与1%的2,4-二硝基氟苯乙腈溶液,摇匀,分别置60 ℃水浴,暗处加热,间隔20 min振摇1次,60 min后取出,放冷,加磷酸盐缓冲液(pH 7.0)至刻度,摇匀,作为线性试验溶液,分别取上述各溶液10 μL注入液相色谱仪,记录色谱图及峰面积,以浓度C为横坐标,峰面积A为纵坐标做线性回归,求得线性方程及相关系数,结果见表2。
2.6 精密度试验 精密量取“2.1”项下混合对照溶液10 μL,注入液相色谱仪,连续进样6次,记录色谱图,计算RSD,结果各氨基酸峰面积RSD均小于2%,表明仪器精密度良好。
2.7 溶液稳定性试验 取“2.1”项下混合对照溶液,分别于0、2、4、6、8、12、24 h精密量取10 μL注入液相色谱仪,记录色谱图,计算RSD,结果各氨基酸峰面积RSD均小于2%,说明混合对照品溶液24 h内稳定。
2.8 回收率试验 精密量取空白基质50 μL置10 mL量瓶中,分别加入18种氨基酸对照品适量(约相当于处方量的80%、100%、120%),照“2.1”项下供试品配制方法配制成回收率试验溶液,平行配制3份。依法测定,计算平均回收率及RSD,结果见表3。
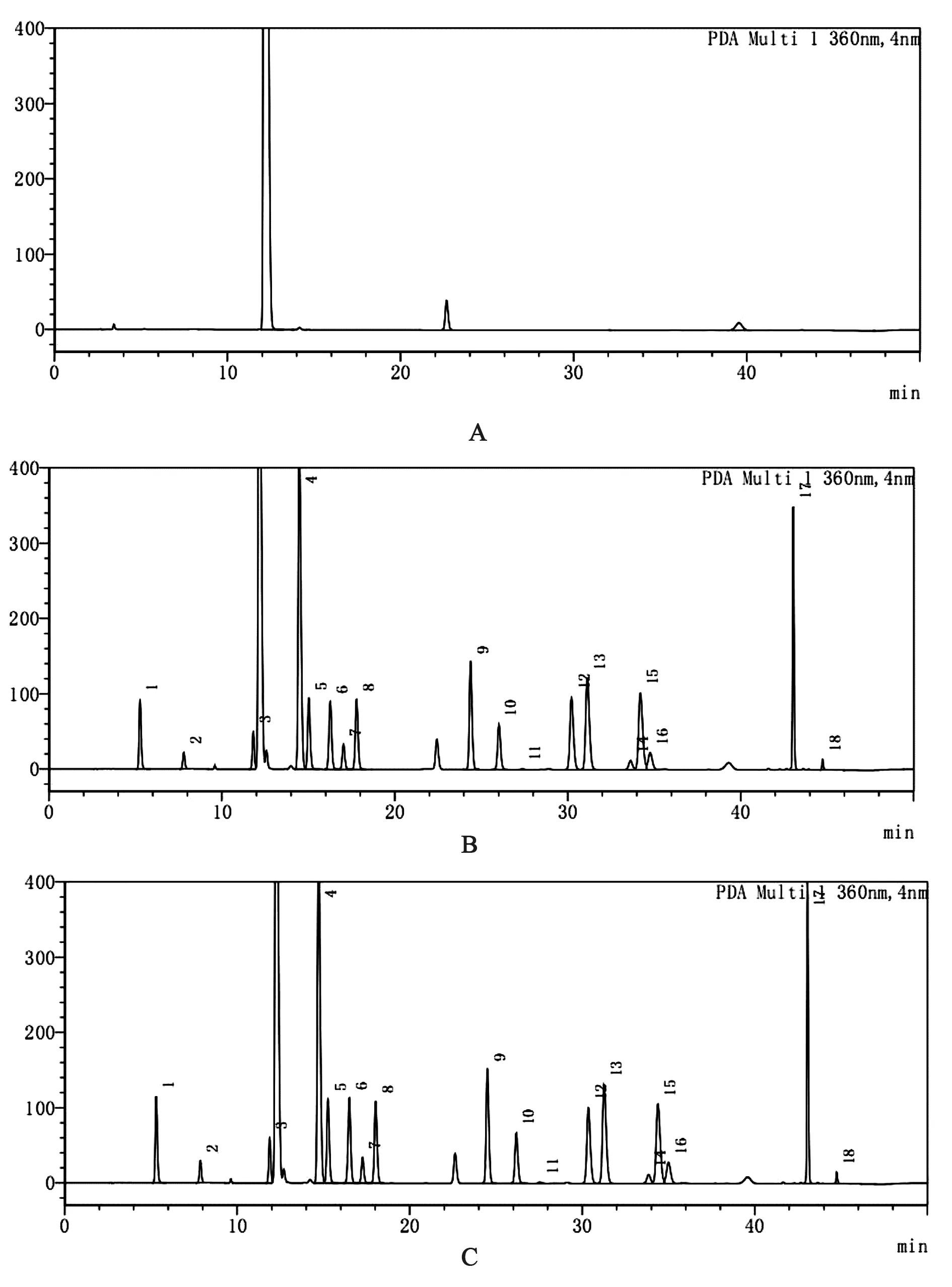
A.空白溶液;B.混合对照品溶液;C.供试品溶液 1.门冬氨酸;2.谷氨酸;3.丝氨酸;4.甘氨酸;5.苏氨酸;6.盐酸精氨酸;7.脯氨酸;8.丙氨酸;9.缬氨酸;10.甲硫氨酸;11.胱氨酸;12.异亮氨酸;13.亮氨酸;14.色氨酸;15.苯丙氨酸;16.盐酸组氨酸;17.盐酸赖氨酸;18.酪氨酸
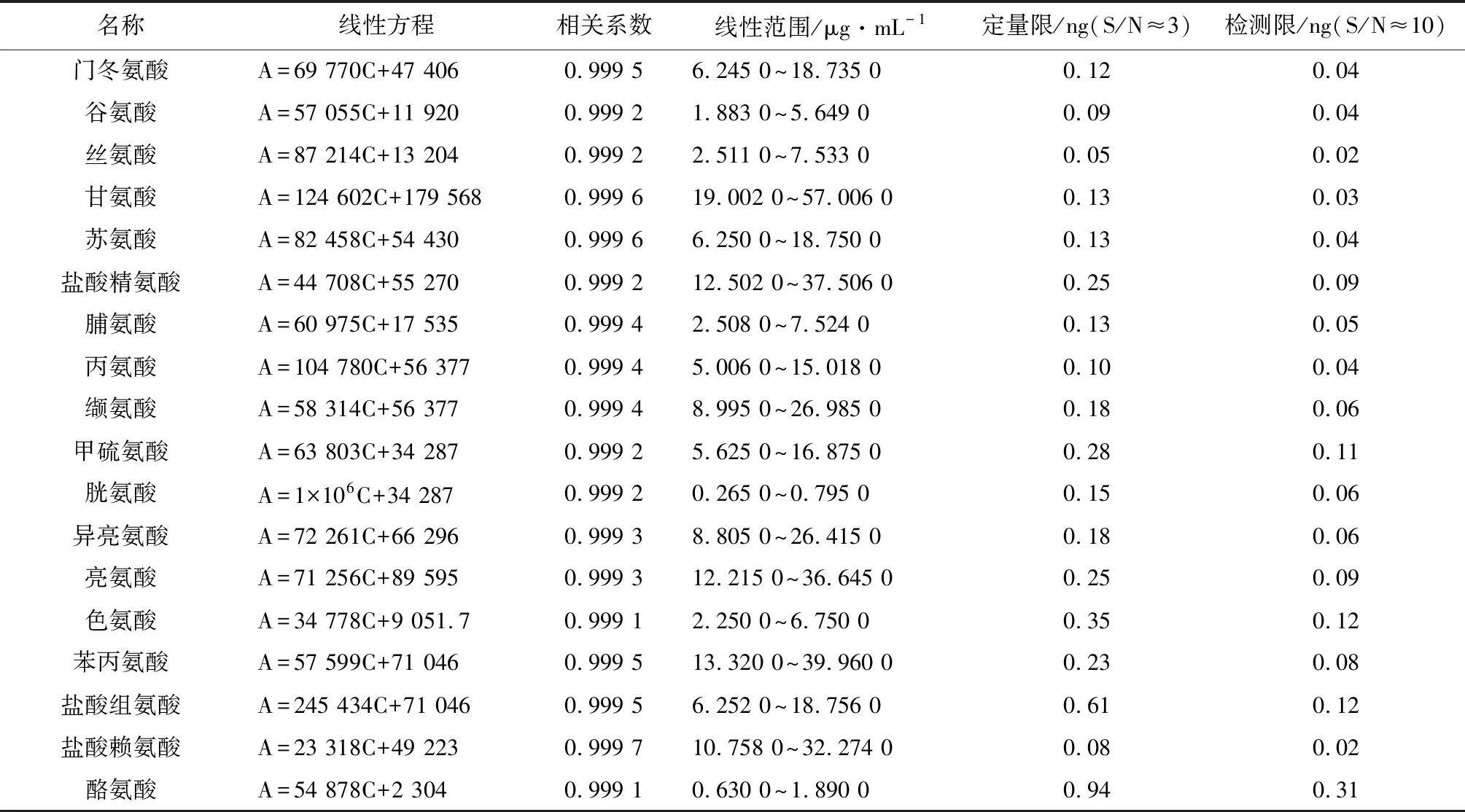
表2 各氨基酸组分线性方程、相关系数、线性范围、定量限与检测限
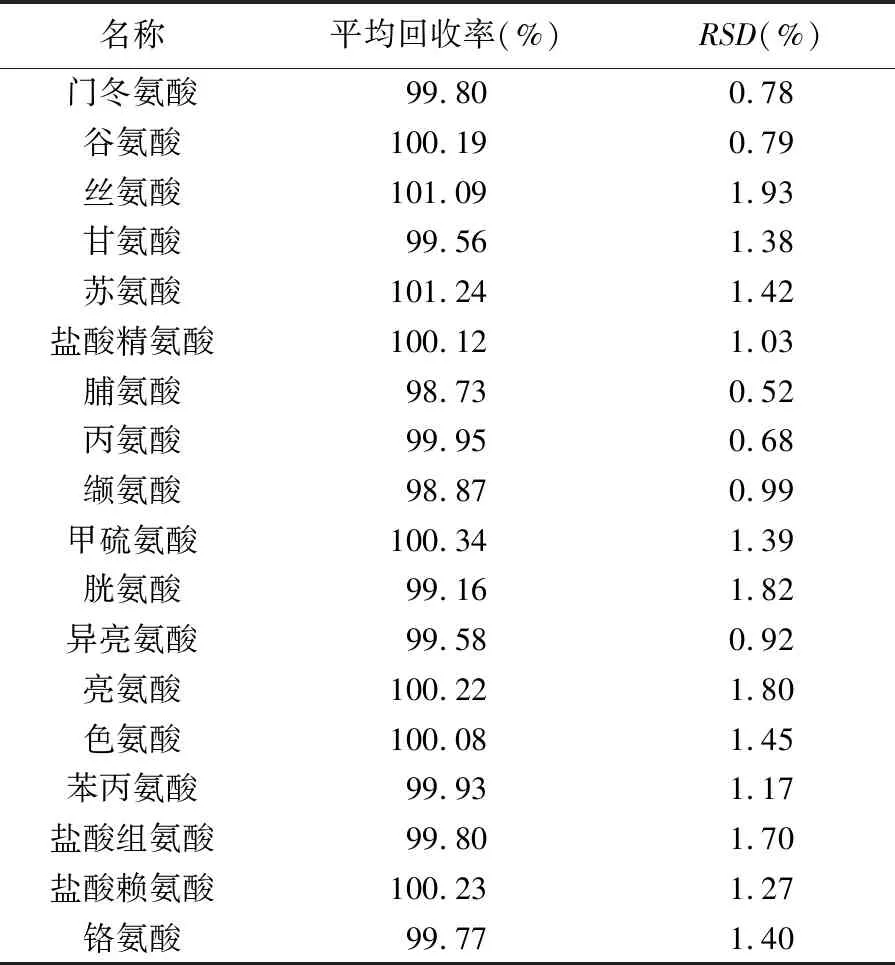
表3 回收率试验结果
2.9 样品检测 取本品3批,照“2.1”项下方法制备混合对照溶液及供试品溶液,照“2.2”项下色谱条件检测各氨基酸含量,结果见表4。

表4 样品测定结果
3 讨论
3.1 衍生化条件选择 本研究分别对衍生化试剂用量、衍生化温度及衍生化时间进行研究,结果使用1%的2,4-二硝基氟苯乙腈溶液1 mL,在60 ℃条件下衍生化1 h,样品中各氨基酸均能衍生化完全,样品检测重复性好。
3.2 流动相研究 本研究流动相B为乙腈-磷酸盐缓冲液(0.014 mol·L-1的磷酸盐缓冲液pH 8.2)(9∶91),9%的乙腈能防止流动相长菌、沉淀,延长流动相使用时间;磷酸盐浓度对氨基酸的分离效果有改善作用;pH值8.2要求选用耐碱色谱柱进行试验。
3.3 柱温研究 本研究最佳柱温为27 ℃,研究发现柱温波动对色氨酸与组氨酸分离影响较大,当柱温在(27±1)℃时,各氨基酸能较好地分离。
3.4 本检测方法胱氨酸可以与其他氨基酸完全分离,但是由于其含量低,检测浓度接近定量限浓度,因此含量测定时未做计算。
