工业改性对大豆蛋白结构及大豆蛋白-肌原纤维蛋白复合凝胶的影响
2020-03-11贾子璇冉安琪刘季善王中江江连洲
贾子璇,冉安琪,刘季善,李 杨,王中江,江连洲,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.山东万得福实业集团有限公司,山东 东营 257000)
大豆分离蛋白(soybean protein isolate,SPI)作为一种优质的植物源蛋白,因其具备良好的功能性质及低成本等优点,常作为添加剂广泛应用于肉制品加工中[1],加入SPI使其与肉中的肌原纤维蛋白(myofibrillar protein,MP)发生交互作用,受热形成复合凝胶。目前,有研究证实天然SPI与肉糜制品的混合会降低肉糜制品的凝胶性[2]。这是由于在香肠加工过程中,加热温度一般为72 ℃左右,此时,天然SPI中的7S与11S蛋白并未达到变性温度,而MP的变性温度在67~72 ℃左右,因此MP先发生变性并开始形成凝胶,此过程会吸收肌肉中的水分,从而造成混合凝胶弹性较差且结构疏松。Feng等[3]研究证实了大豆蛋白中β-伴大豆球蛋白会对肌肉中肌球蛋白重链的自聚集产生阻碍作用。由此可见,对大豆蛋白进行改性处理尤为重要,从而改善其在肉制品中的功能性,生产出适用于工业加工且满足消费者需求的专用大豆蛋白系列产品[4]。
SPI的改性有多种方法,如酶解改性[1]、超声波改性[5]等,Nordqvist等[6]研究发现碱改性可以增强SPI的黏度,经改性后可得到高黏度的胶黏剂。此外,有研究表明在大豆蛋白的分子上引入有机大分子糖类物质,使之糖基化生成新的糖蛋白,可以提高大豆蛋白的溶解性、热稳定性、乳化性等性质[7]。实验室提取SPI是采用碱溶酸沉的方法从豆粕中提取且进行冻干贮藏[8],而本实验采用工业生产流程,碱溶条件与实验室制法有差异,碱性环境的改变会影响SPI的黏度[9],且所得浓缩液采用喷雾干燥的方式进行包装贮藏,因此与实验室改性方式所得结果相比有所差异。
本实验考察4 种适用于工业生产的SPI改性方法(工业热改性、工业碱改性、工业糖基化改性、工业氧化改性),通过测定改性SPI的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)图谱、拉曼图谱、游离巯基及二硫键含量检测其结构、功能的变化,并对改性SPI与MP制成的复合凝胶进行质构、扫描电镜等检测,研究改性处理对复合凝胶的作用效果,为工业改性SPI的生产技术进行推广,对提高肉制品的感官及凝胶特性提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊肉 市购;氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钠、氯化镁、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、SDS(均为分析纯) 美国Sigma公司。
低温豆粕(蛋白质质量分数45%)、SPI、工业热改性大豆分离蛋白(heated-soybean protein isolate,H-SPI)、工业碱改性大豆分离蛋白(alkaline-soybean protein isolate,A-SPI)、工业糖基化改性大豆分离蛋白(glycosylated-soybean protein isolate,G-SPI)、工业氧化改性大豆分离蛋白(oxydic-soybean protein isolate,O-SPI)(蛋白质质量分数92%) 山东万得福实业集团有限公司。
1.2 仪器与设备
Ultra Turrax T25 BASIS速匀浆机 德国IKA公司;CTK150R型离心机 长沙高新技术产业开发区湘仪离心机仪器有限公司;K-S24型电热恒温水浴锅 上海森信实验仪器有限公司;TA-XT2i型质构分析仪 英国Stable Micro System公司;pHS-3D pH计 上海雷磁公司;PE Raman Station 400激光显微拉曼光谱仪 美国PE公司;Infinite M200型多功能酶标仪 瑞士Tecan公司;SU8020扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 工业改性SPI结构与性质的测定
1.3.1.1 SPI的生产与改性处理
1)SPI的工业生产流程
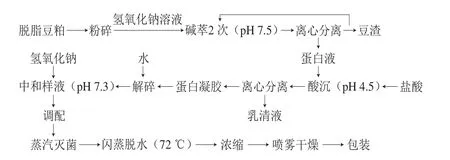
2)主要流程操作参数
碱萃:将脱脂豆粕粉粹后置于萃取罐中按料液比1∶9(g/mL)加入水,水温控制为40 ℃,加入氢氧化钠碱液使豆粕在pH值为7.5的条件下溶解于水中;酸沉:利用大豆蛋白等电点为4.2~4.5的原理,加入盐酸调整酸沉罐中混合豆乳的pH值到4.5左右,使蛋白在此条件下产生沉淀;解碎:按1∶4(g/mL)的比例将蛋白凝胶加水入暂存罐中搅拌;中和样液:在中和罐中加碱,将样液pH值调整到7.3;蒸汽灭菌:将样液利用140 ℃的高温进行瞬时杀菌;闪蒸脱水:瞬时加热真空闪蒸,蒸馏除去豆腥味并提高凝胶性和持油性。温度控制在72 ℃,杀菌时间为5~15 s。
3)SPI的工业改性处理
H-SPI:上述闪蒸脱水步骤中的闪蒸温度由72 ℃调整为81 ℃,其他参数不变;A-SPI:上述中和样液过程的pH值由7.3调至8.7,其他参数不变;G-SPI:上述调配过程中添加1%魔芋淀粉,加温搅拌至75 ℃,持续90 min,其他参数不变;O-SPI:将制备的SPI置于45 ℃贮藏仓保温36 h进行氧化,其他参数不变。
本实验中4 种工业改性方式是经过工业上反复实验及筛选确定的,是已经在工业上实现生产的蛋白,故所选参数均为已优化后的参数。
1.3.1.2 SDS-PAGE测定
参照Laemmli[10]的方法,稍作修改。使用的分离胶及浓缩胶分别为15%和5%。将蛋白样品溶于样品缓冲液中,蛋白质量浓度为5 mg/mL,95 ℃加热5 min后取10 μL上样,浓缩胶电压80 V,分离胶电压120 V。电泳完成后,用考马斯亮蓝R-250染色,采用体积分数10%冰乙酸溶液和体积分数10%甲醇溶液脱色,脱色后电泳胶片用Tanon凝胶成像系统拍照。
1.3.1.3 拉曼光谱分析
测定条件:将SPI样品分散在缓冲液中并配制成100 mg/mL溶液进行拉曼测定,拉曼光谱的激发光波长为785 nm,发射功率为300 mW,测量拉曼光谱范围选取600~1 800 cm-1。每个样品重复扫描3 次,各样品的拉曼谱图均由计算机作信号累加后平均,并绘图输出,峰位误差小于±3 cm-1。
图谱的处理:首先进行拉曼图谱基线校正、各峰归属采用OMINIC软件,归一化处理以苯丙氨酸的1 004 cm-1作为内标,并且以此作为各拉曼峰强度变化的依据,谱图的拟合利用Origin 8.5软件[11]。
1.3.1.4 巯基与二硫键含量的测定
游离巯基含量的测定:参考Beveridge等[12]的方法,稍作修改。将一定量SPI溶于pH 8.0的磷酸盐缓冲溶液中,25 ℃磁力搅拌1 h,得到质量浓度为7.5 mg/mL的SPI溶液。取2 mL SPI溶液加入2 mL pH 8.0的磷酸盐缓冲溶液和67 μL 5,5’-二硫代双(2-硝基苯甲酸),置于25 ℃恒温水浴锅中静置1 h直至反应充分,10 000 r/min离心30 min,取上清液在波长412 nm处测定吸光度A412nm。每组样品测定3 次。
总巯基含量的测定:取400 μL SPI溶于10 mL离心管中,加入20 μL巯基乙醇和1.6 mL尿素-盐酸胍溶液,于25 ℃恒温水浴锅中静置1 h直至充分反应,5 000 r/min离心10 min,清洗沉淀2 次。向沉淀中加入4 mL pH 7.0的0.1 mol/L磷酸盐缓冲溶液和32 μL 5,5’-二硫代双(2-硝基苯甲酸)。置于25 ℃恒温水浴锅中静置1 h直至反应充分,10 000 r/min离心30 min。取上清液在波长412 nm处测定吸光度A412nm。每组样品测定3 次。
巯基含量按式(1)计算:
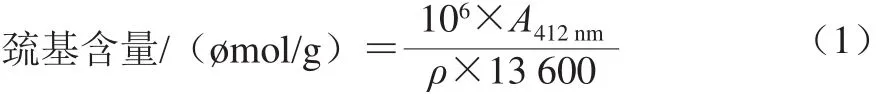
式中:13 600为摩尔消光系数/(L/(molgcm));ρ为蛋白质溶液的质量浓度/(mg/mL)。
二硫键含量按式(2)计算:

1.3.2 改性SPI与MP复合凝胶性质测定
1.3.2.1 MP的提取
根据Feng Xiaochao[13]和Park[14]等的方法并稍加修改提取MP。在市场购买新鲜的猪背肌,剔除多余的筋膜、脂肪,用绞肉机搅碎,所得肉糜用于提取猪肉MP。称取50 g肉样,加4 倍体积的pH 7.0缓冲液(0.1 mol/L KCl,2 mmol/L MgCl2,1 mmol/L EDTA,10 mmol/L Na2HPO4)匀浆离心,弃上清液,取沉淀重复上述步骤3遍。所得沉淀加入4 倍体积的0.1 mol/L NaCl洗液,匀浆离心,沉淀重复洗涤2 次,第3次加洗液匀浆后,用四层纱布过滤除去结缔组织,最后用0.1 mol/L HCl溶液调pH值至6.25后离心去上清液,所得膏状物为MP。MP浓度采用双缩脲法测定,以牛血清蛋白作标准曲线。
1.3.2.2 复合凝胶的制备
提取的MP(蛋白质质量分数约为8%)稀释到40 mg/mL,用蒸馏水将SPI配成40 mg/mL溶液,SPI与MP按1∶4比例混合均匀[15],所有混合溶液的总蛋白质量浓度均为40 mg/mL。取20 mL搅匀的溶液于80 ℃水浴锅中加热30 min,取出迅速置于冰水中冷却,4 ℃冰箱中贮藏12 h。制备好的凝胶每次测定前在室温(20~25 ℃)平衡30 min,然后用于测定质构及扫描电镜。
1.3.2.3 质构测定
根据Buamard等[16]的方法进行凝胶质构的测定。测试时将样品固定于测定平台,探头型号选择P/0.5(直径12 mm),下压得到的穿透力即为蛋白的凝胶强度。选用的物性仪测定参数如下:测试前速率3.0 mm/s;测试速率0.3 mm/s;触发力5 g;测试后速率3.0 mm/s;穿刺距离10.0 mm。每个样品进行3 次平行实验,取平均值。
1.3.2.4 扫描电镜测定
将凝胶切成1 cm3(1 cmh1 cmh1 cm)的小方块,放于孔板中,加入2.5%戊二醛溶液固定2 h,然后用磷酸缓冲液漂洗数次,接着用乙醇脱水。用醋酸戊酯置换乙醇同时干燥。用银粉导电胶固定样品,在镀膜机内镀金属膜,最后在扫描电镜下观察和拍照,加速电压为10 kV,每个样品观察8 个区域。
1.4 数据统计
本实验数据均为3 个平行样的平均值,用Origin 8.5和SPSS 22.0软件进行统计和方差分析(ANOVA),用Duncan法进行差异显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 改性处理对SPI亚基组成的影响
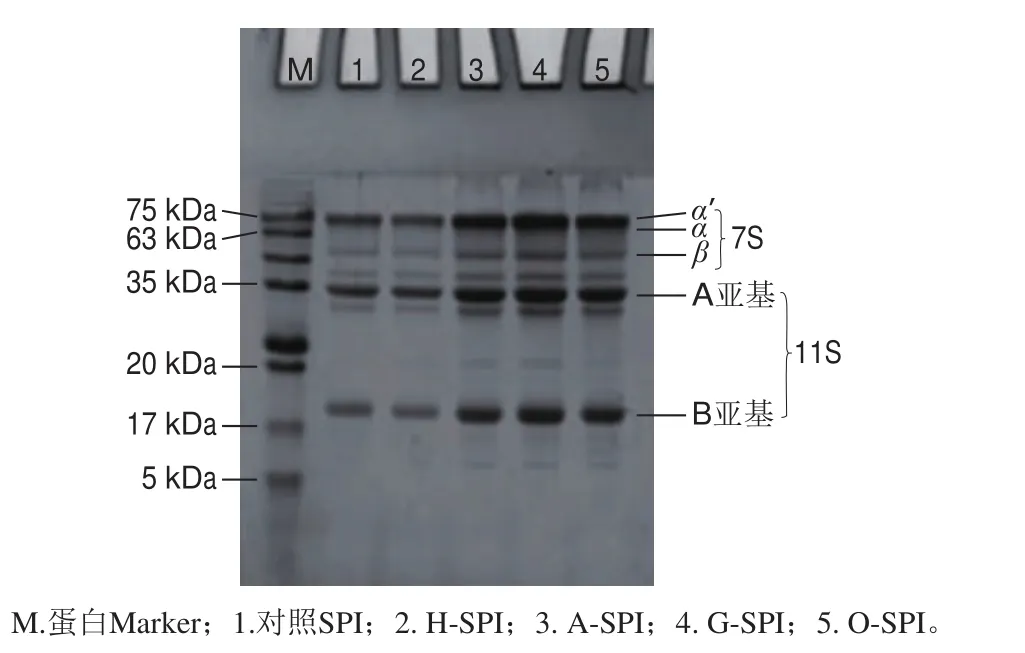
图1 改性SPI的SDS-PAGE图谱Fig. 1 SDS-PAGE results of different modified SPIs
如图1所示,从总体亚基组成看,4 种工业改性SPI分离胶的电泳条带与对照SPI相比无显著差异,由此可以看出工业改性处理并未对蛋白的亚基组成造成显著影响。与对照SPI相比,H-SPI的11S碱性亚基(B亚基)条带变浅,这可能是由于11S球蛋白受热变性发生解离后复聚集,从而导致11S球蛋白中碱性亚基生成不溶性聚集体[17]。工业碱改性与工业糖基化改性SPI的分离胶条带基本一致,与对照SPI相比,A-SPI和G-SPI的条带在分子质量为20 kDa处出现了加深,并出现了分子质量为5~17 kDa的小分子条带,推测可能是改性处理使SPI分子亚基解离,出现了分子质量为5~17 kDa的低分子亚基,且部分亚基聚合形成了分子质量为20 kDa的小分子聚集体[18]。O-SPI与对照SPI相比,亚基条带的颜色加深,凝胶槽口处高分子聚集体的积聚逐渐加深,表明蛋白受氧化而产生聚集[19]。
2.2 工业改性处理对SPI结构影响的拉曼光谱分析
2.2.1 工业改性处理对SPI二级结构的影响

图2 工业改性SPI的拉曼光谱图Fig. 2 Raman spectra of different industrial modified SPIs
如图2所示,1 600~1 700 cm-1范围内是二级结构特征谱带。本实验利用酰胺I带拟合SPI二级结构,酰胺I带的蛋白质二级结构特征峰范围为1 645~1 660 cm-1为α-螺旋;1 665~1 680 cm-1为β-折叠;1 680~1 690 cm-1为β-转角;1 660~1 670 cm-1为无规卷曲[11,20]。本实验中SPI的拉曼图谱二级结构的定量计算由Raman Spectral Analysis Package Version 2.1软件完成。
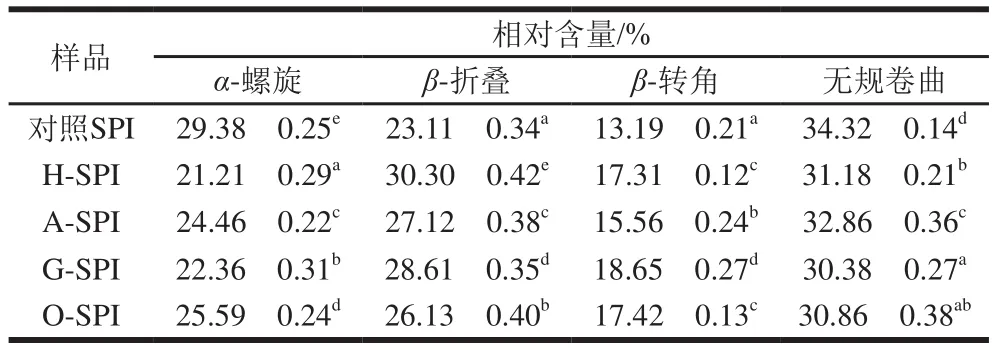
表1 利用酰胺I带拟合SPI二级结构结果Table 1 Proportions of secondary structures in SPI estimated by amide I band fi tting
由表1可知,4 种工业改性处理均减少了SPI的α-螺旋和无规卷曲结构相对含量,并增加了β-折叠与β-转角结构相对含量。本团队前期研究报道了与未经热处理的SPI相比,热处理30 min增加了SPI的α-螺旋结构含量,降低了β-折叠结构含量[21]。本实验中工业热改性是在81 ℃的闪蒸温度下短时加热,由此推测工业热改性与实验室热改性之间的差异会造成SPI二级结构的不同转变。耿蕊[22]研究表明碱改性会降低SPI的α-螺旋结构含量,暴露出更多的疏水基团。布冠好等[23]报道了SPI经糖基化后,复合蛋白质的α-螺旋含量降低,β-折叠结构含量增加。SPI经氧化后,α-螺旋和无规卷曲含量下降,β结构含量上升;卢岩[24]研究证实了SPI氧化过程中伴随着α-螺旋结构的损失。
2.2.2 改性处理对SPI二硫键构型的影响
图2中500~550 cm-1范围内是拉曼光谱二硫键特征谱带,其中二硫键gauche-gauche-gauche(g-g-g)振动模式归属于500~510 cm-1,gauche-gauche-trans(g-g-t)形式二硫键在515~525 cm-1处,trans-gauche-trans(t-g-t)形式二硫键在535~545 cm-1处[11,25]。采用了Origin 8.5软件进行多峰值拟合研究不同工业改性处理对于SPI二硫键变化的影响。

表2 工业改性对SPI二硫键构型的影响Table 2 Effects of different industrial modi fi cations on the S—S bond conformations of SPI
由表2可知,g-g-g构型代表分子内二硫键,t-g-t构型代表分子间二硫键。未经处理的SPI主要以g-g-g构型为主,相对含量为44.32%,这与Przulj等[26]发现的天然SPI中g-g-g构型二硫键所占比例一致。H-SPI的g-g-g构型相对含量下降,t-g-t相对含量增加,由此看出工业热改性使SPI的分子内二硫键转化为分子间二硫键,Ellepola等[27]对大米球蛋白二硫键构型的研究表明热处理能够促进蛋白分子间二硫键的形成。A-SPI的g-g-g构型二硫键所占比例与对照SPI相比无显著变化(P>0.05),g-g-t构型相对含量下降,t-g-t构型相对含量增加,这与本团队前期研究pH 8.0条件下SPI二硫键的3 种构型含量所占比例一致[11]。与对照SPI相比,G-SPI的g-g-g构型和t-g-t构型相对含量增加,g-g-t含量减少。张瑶[28]研究证明了糖化处理SPI后,二硫键由g-g-t转变为t-g-t构象。工业氧化改性使SPI二硫键构型由分子间转化为分子内二硫键,吴伟[29]的研究表明这可能与分子间二硫键被氧化有关。
2.2.3 改性处理对SPI氨基酸侧链的影响
2.2.3.1 酪氨酸残基的变化
图2拉曼光谱的850 cm-1和830 cm-1处是酪氨酸残基的苯环呼吸振动和面外弯曲倍频之间的费米共振[11,27],利用这2 条谱线的强度比(I850/I830),可以确定蛋白质分子中的酪氨酸残基的暴露与埋藏的程度。当I850/I830的比值在1.25~1.40时,表明酪氨酸残基完全暴露于分子表面;当比值为0.3~0.5时,酪氨酸残基完全埋藏于分子内部;当比值为0.7时,酪氨酸残基为电离状态。
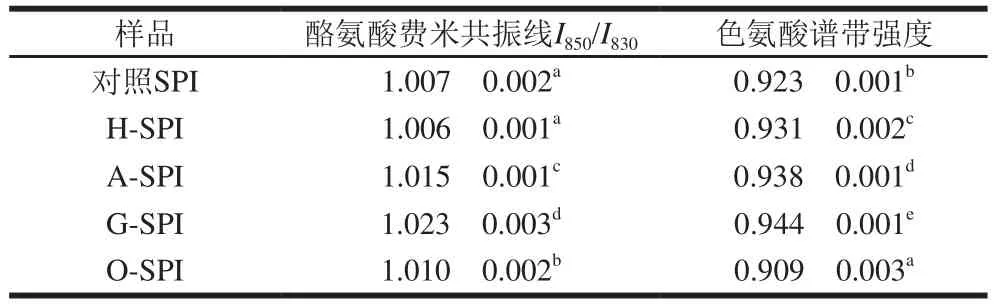
表3 工业改性SPI的酪氨酸费米共振线I850/I830及色氨酸残基分析结果Table 3 I850/I830 and tryptophan band intensity of different industrial modified SPIs
由表3可知,不同工业改性SPI的I850/I830比值均在1.00~1.03之间,接近于1.25~1.40范围,表明酪氨酸残基趋向于“暴露式”。与对照组相比,H-SPI的酪氨酸费米共振线I850/I830比值变化不显著(P>0.05)。齐宝坤等[30]研究表明在80 ℃热处理过程中酪氨酸残基微环境可以保持;工业碱改性显著增加了SPI酪氨酸费米共振线I850/I830比值(P<0.05),说明碱改性可使SPI的酪氨酸残基更多地暴露于分子表面,并作为氢键的供体或受体与水相互作用[11];G-SPI样品表现为“暴露”式。张瑶[28]研究表明与天然SPI相比,糖基化后的大豆蛋白-葡聚糖复合体系中有更多的酪氨酸暴露到溶液的极性微环境中;O-SPI的酪氨酸残基暴露程度增大,说明氧化处理破坏了维持蛋白质三级结构的主要作用力,使包埋于SPI分子内部的酪氨酸残基暴露于分子表面[24]。
2.2.3.2 色氨酸残基的变化
图2中760 cm-1附近的拉曼谱带归属为色氨酸残基。Li-Chan[31]研究表明760 cm-1附近区域的拉曼峰强度与色氨酸残基的“包埋”和“暴露”态有关。I760越大,色氨酸残基微环境极性越强,导致色氨酸残基由埋藏在分子内部向分子表面暴露。
由表3可知,与对照SPI相比,H-SPI在760 cm-1附近区域的拉曼峰强度升高,齐宝坤等[30]认为热处理使SPI色氨酸残基暴露是由于蛋白质发生变性,分子结构展开导致的;A-SPI色氨酸残基的暴露程度增大,本团队前期研究认为碱改性使SPI埋藏在疏水环境中的色氨酸残基暴露到分子的表面[11];G-SPI色氨酸残基趋向于“暴露”态,张瑶[28]研究认为色氨酸残基最先是包埋的、疏水的,而后转变为暴露的展开形式;O-SPI的色氨酸谱带强度降低,Traverso[32]认为这是由于氧化引起蛋白聚集,导致天然SPI先前暴露的色氨酸残基被包埋在改性后的SPI分子内部[33]。
2.3 改性处理对SPI巯基及二硫键含量的影响
由图3可知,工业热改性处理显著降低了SPI的游离巯基含量,增加了总巯基含量,结合表2二硫键构型结果可知,工业热改性显著提高了SPI的分子间二硫键含量(P<0.05)。杨岚等[34]研究认为这可能是因为温度越高,分子运动速率和碰撞几率越大,同时在较短时间内能够相互反应的基团暴露的越多,因此分子间巯基相互作用形成的二硫键越多,游离巯基含量越少。工业碱改性处理显著提高了SPI的总巯基含量(P<0.05),游离巯基含量与对照SPI相比无显著差异(P>0.05),结合表2可知碱改性提高了SPI分子间二硫键含量。碱性环境会加速巯基氧化[35]。蒋将[36]研究在pH值调至12.0后,表面巯基含量有降低趋势,这可能是由于巯基氧化和二硫键的形成所致。由图3结合表2可知,糖基化处理可能使SPI游离的表面巯基形成了更多的分子内及分子间二硫键。张瑶[28]研究证实糖化处理可减少SPI游离巯基含量且增加二硫键含量。O-SPI的游离巯基和二硫键含量显著降低(P<0.05),随着时间的延长,SPI中游离巯基可能会发生氧化,导致游离巯基含量减少[29]。Thomas等[37]认为大豆蛋白巯基被氧化成为不可逆氧化状态,形成了非二硫键的含硫化合物。

图3 工业改性方式对SPI游离巯基及总巯基含量的影响Fig. 3 Effect of different industrial modification methods on free sulfhydryl group and total sulfhydryl group contents of SPI
2.4 SPI-MP复合凝胶质构分析

表4 SPI-MP复合凝胶质构结果Table 4 Texture characteristics of SPI-MP hybrid gels
如表4所示,H-SPI、A-SPI、G-SPI与MP形成的混合凝胶硬度、弹性、黏结性、胶着性、咀嚼性等质构特性均显著优于对照SPI(P<0.05),O-SPI形成的混合凝胶除黏结性外,其余各项质构特性都差于对照SPI。程春梅[38]报道了SPI在肉制品中的应用,认为加热后的SPI会使其蛋白分子从天然状态解折叠,亚基解离并形成部分的可溶性聚集体,从而增强了蛋白质分子内及与水分子间的相互作用。Jiang Jiang等[39]研究证实对SPI进行碱处理会显著增强MP凝胶能力,这可能是由于碱改性使SPI分子展开,增加了与MP之间的交联作用[40]。G-SPI与MP复合凝胶的综合质构特性优于对照SPI,这是由于SPI经糖基化改性后引入了糖链,分子运动阻力和黏度增加,同时反应后蛋白质的疏水基团暴露,有利于与MP的相互作用[41]。吴伟[29]研究认为随着氧化时间的延长,蛋白质分子发生降解,黏度降低,减弱了SPI与MP之间的交联作用。
2.5 凝胶扫描电镜分析

图4 复合凝胶扫描电镜结果(×1 000)Fig. 4 Scanning electron micrographs of hybrid gels (× 1 000)
如图4所示,与对照组相比,工业热改性、工业碱改性和工业糖基化改性处理均使复合凝胶结构更加致密,工业氧化改性则使复合凝胶结构更加松散且无规则。H-SPI-MP凝胶表面不规则空洞减少,张海瑞等[42]研究发现在90 ℃加热条件下,SPI的凝胶结构更加致密;A-SPIMP凝胶表面结构致密,凝胶界面网络更加清晰。连喜军等[43]研究表明pH 8~11,随着pH值升高,SPI形成凝胶的透明性增加;G-SPI-MP凝胶表面比较规则,蛋白质交联程度大。Lakemond等[44]研究发现糖基化改性增加了长链疏水性基团的含量,增强疏水相互作用,从而维持凝胶的均一网状结构;O-SPI-MP凝胶表面存在大量无规则孔隙,这与吴伟[29]研究结果一致,随着蛋白氧化程度的增加,大豆蛋白凝胶网络的粗糙度增加,内部孔隙变大并且分布不均匀。
3 结 论
通过对SPI亚基组成、二级结构、二硫键构型、巯基含量、氨基酸侧链分析及SPI-MP复合凝胶质构特性、扫描电镜结果可知:4 种工业改性未对SPI亚基组成产生显著影响,但是均减少了SPI的α-螺旋和无规卷曲结构相对含量,并增加了β-折叠与β-转角结构相对含量;工业热改性、工业碱改性、工业糖基化改性显著增加了SPI二硫键含量,而工业氧化改性则显著降低了SPI的二硫键含量(P<0.05);氨基酸侧链分析结果表明4 种工业改性蛋白的酪氨酸残基均趋向于“暴露式”,工业热改性、工业碱改性、工业糖基化改性均使色氨酸残基暴露程度增大,而工业氧化改性导致氧化蛋白聚集使色氨酸残基被包埋;质构特性及扫描电镜结果表明,工业热改性、工业碱改性、工业糖基化改性均显著提高了SPI-MP复合凝胶的硬度、弹性等质构特性(P<0.05),复合凝胶更加致密均匀,而工业氧化改性SPI与MP形成的复合凝胶粗糙多孔。综上,在肉制品生产中,可以对SPI进行工业热改性、工业碱改性、工业糖基化改性等方式,作为添加剂填充至肉制品中,提高肉制品的感官及凝胶特性。
