绿豆多肽锌螯合物的制备及其结构与体外消化的分析
2020-03-11富天昕盛亚男冯玉超王长远
富天昕,张 舒,盛亚男,冯玉超,王长远,2,*
(l.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
绿豆是中国主要的食用豆类作物,其生产和出口量居世界首位。作为药食两用的豆科植物,绿豆其本身含有丰富的蛋白质、淀粉、维生素、矿物质及人体必需的氨基酸。其中蛋白质质量分数高达19.5%~33.1%,是禾谷类籽粒的2~3 倍[1-2]。但目前对绿豆的开发多为淀粉的加工利用,对绿豆蛋白的开发利用还存在一些局限,造成了资源的严重浪费[3]。因此开发绿豆蛋白,增加绿豆的附加值已成为现代的研究热点。而绿豆多肽作为绿豆蛋白的酶解物,因其具有低致敏性,且在较低的pH值条件下依然能保持较高溶解性,可减轻肠胃负担的特点所以有着广阔的应用前景[4-6],但多数研究只是停留在绿豆蛋白肽本身的生物活性,例如抗氧化性、抗菌性,鲜有绿豆蛋白肽与金属离子结合的报道。
锌被称为“生命元素”,在维持人体正常的生理状态和生命活动中起着至关重要的作用。缺锌可导致生长迟缓、免疫性功能障碍和神经性功能障碍等一系列疾病[7-9]。但人体对饮食中锌的吸收率较低,其主要原因是锌与植酸在小肠中可形成不溶的复合物,从而大大降低了锌的生物利用率,锌缺乏已成为严重影响健康的常见问题[10-11]。因此寻求一种高效、吸收利用率好的补锌制剂迫在眉睫。研究发现,肽可与金属离子反应形成化学稳定的可溶性螯合物,这种螯合物可以防止金属离子在胃肠道中受到植酸等物质的影响而生成沉淀。此外,这种金属螯合物还可以在肽的吸收模式下进入体内,加速金离子的吸收。这为身体补充锌提供了新的途径[12-14]。
为进一步明晰多肽与锌离子螯合的机制以及生物利用率等情况,实验利用绿豆多肽与锌进行螯合,以螯合能力为指标明确螯合工艺的最优条件,采用红外、紫外光谱分析对螯合前后的结构进行比较,推测肽锌螯合位点,并运用扫描电镜和X-射线衍射观察二者表面结构和结晶结构的差异,通过体外肠道模拟实验测定螯合物的生物利用率。本研究可为肽锌螯合的工业化生产及后续的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
脱脂绿豆蛋白(纯度89.93%) 实验室自制;碱性蛋白酶(200 000 U/g)、盐酸、氢氧化钠、七水硫酸锌(均为分析纯) 上海麦克林公司;无水乙醇、二甲酚橙、六亚甲基四胺、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(均为分析纯)西安化学试剂厂;透析袋(7 000 Da) 上海基星生物科技有限公司;溴化钾、胃蛋白酶、胰蛋白酶 美国Sigma公司。
1.2 仪器与设备
HH-S4型恒温水浴锅 郑州长城科工贸有限公司;DELTA 320精密pH计 梅特勒-托利多仪器(上海)有限公司;Alpha 1-2 LD plus冷冻干燥机 德国Christa公司;PXZ-21K高速冷冻离心机 长沙湘智离心机仪器有限公司;Quintik 24-1CN电子天平 赛多利斯科学仪器(北京)有限公司;UV-2250PC型紫外-可见光分光光度计 日本岛津仪器公司;傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)仪美国Thermo Electron公司;SU1510型扫描电镜 日本日立公司。
1.3 方法
1.3.1 绿豆蛋白的制备
将绿豆进行粉碎过筛,并对其进行脱脂处理。将脱脂绿豆粉与蒸馏水以1∶10的配比进行碱提(用1 mol/L氢氧化钠溶液调pH值至10),室温条件搅拌2 h,3 500 r/min离心20 min,取上清液用1 mol/L的盐酸调pH值至4.6,静置0.5 h后,按照上述条件离心取沉淀,水洗沉淀2~3 次,冷冻干燥并在-20 ℃保存备用。
1.3.2 绿豆多肽的制备
将脱脂后的绿豆蛋白用碱性蛋白酶进行水解,酶解条件为温度56 ℃、绿豆蛋白质量分数3%、酶添加量6%、pH 9、时间4 h,在水解过程中维持pH值恒定并不断搅拌。酶解结束后沸水浴中灭酶15 min,离心取上清液(5 000 r/min,15 min),经冷冻干燥制得绿豆多肽粉[15]。
1.3.3 绿豆多肽成分测定
蛋白质含量测定参照GB/T 5009.5ü2010《食品中蛋白质的测定》;水分测定参照GB/T 12087ü2008《食品中水分的测定》;灰分测定参照GB/T 5009.4ü2016《食品中灰分的测定》;锌离子测定参照GB/T 10656ü2008《锅炉用水和冷却水分析方法 锌离子的测定》。
1.3.4 绿豆多肽锌螯合物的制备
将上述得到的绿豆多肽溶于蒸馏水中,调节螯合的温度、pH值,待条件稳定后加入一定量的ZnSO4g7H2O恒温进行螯合,5 000 r/min离心15 min去除沉淀。取上清液用3 倍体积的95%乙醇溶液进行醇沉处理,10 000 r/min离心15 min取沉淀,洗涤数次后将其冷冻干燥[16]。
1.3.5 绿豆多肽螯合能力的测定
采用EDTA络合滴定法[17]。将1.3.1节得到的螯合物用去离子水溶解定容至50 mL。取定容后的溶液10 mL,滴加二甲酚橙指示剂,滴加质量分数为20%的六亚甲基四胺至溶液呈稳定的紫红色,再加入4 mL六亚甲基四胺,用0.01 mol/L EDTA溶液滴定,溶液从紫红色变为黄色即为终点,记录所消耗EDTA溶液的体积。肽锌螯合能力计算如式(1)所示:

式中:X为绿豆多肽锌螯合能力/(mg/g);M为锌的摩尔质量/(g/mol);C为EDTA的浓度/(mol/L);V为滴定所消耗EDTA的体积/mL;m为螯合用绿豆多肽的质量/g。
1.3.6 单因素试验
将绿豆多肽溶于去离子水中,配制成质量分数为3%多肽溶液,加入质量分数为5%的ZnSO4g7H2O溶液,恒温水浴一定时间。分别以多肽与锌离子质量比(肽锌质量比)(3∶1、4∶1、5∶1、6∶1、7∶1)、反应温度(30、40、50、60、70 ℃)、反应时间(40、60、80、100、120 min)、反应pH值(4、5、6、7、8)进行单因素试验。
1.3.7 响应面试验
在单因素试验的基础上以绿豆多肽螯合锌的螯合能力为响应值,采用Design-Expert 8.0统计分析软件且以反应pH值、反应温度、肽锌质量比、反应时间为自变量建立Box-Behnken模型,对肽锌螯合反应进行响应面优化设计。响应面试验设计因素与水平如表1所示。
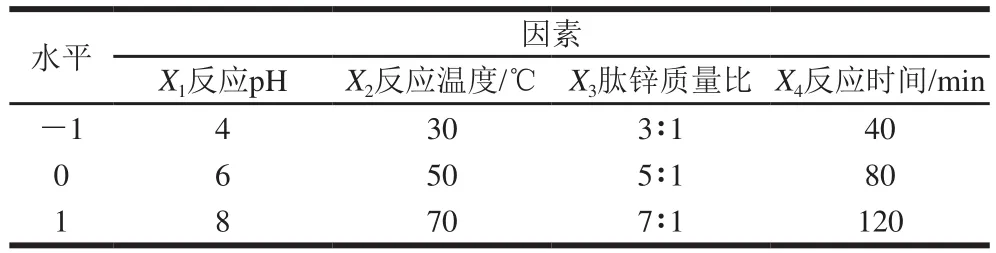
表1 响应面试验因素与水平Table 1 Coded values and corresponding actual values of independent variables used for Box-Behnken design
1.3.8 绿豆多肽锌螯合物结构表征
1.3.8.1 紫外光谱分析
分别将肽与肽锌螯合物粉末样品溶于去离子水中,配成0.4 mg/mL溶液,用紫外-可见分光光度计在190~400 nm波长范围内进行紫外吸收光谱扫描[18]。
1.3.8.2 FTIR分析
分别取2 mg的绿豆多肽和肽锌螯合物放入玛瑙研钵中,再向玛瑙研钵中分别加入200 mg干燥后的KBr,研磨至粒度在2.5~2.0 μm以下,在20 MPa的压力下压至1~2 min,取出压片呈半透明状态。利用FTIR仪进行定性分析,波数范围400~4 000 cm-1[19]。
1.3.8.3 扫描电镜分析
将肽与肽锌螯合物粉末分别用双面胶黏贴于铝制样品台上,然后喷涂一薄层金膜,在扫描电镜下观察拍摄样品微观形态并照相。放大倍数为500 倍[20]。
1.3.8.4 X-射线衍射分析
取一定量的样品放在样品槽中,在加速电压40 kV、加速电流40 mA、扫描范围(2θ)5°~90°、扫描速度0.02°/0.2 s的条件下对样品进行扫描,利用X-射线衍射图谱分析其结构[21]。
选取2015年4月至2017年9月期间在我院就诊的84例系统性红斑狼疮患者作为研究对象,并按照科室随机分为对照组和观察组。其中,对照组中男性15例,女性27例,年龄在34岁到79岁之间,平均年龄42.9±5.7岁,平均病程为3.2年;观察组中男性17例,女性25例,年龄在36岁到77岁之间,平均年龄44.1±6.3岁,平均病程为3.5年。两组患者的性别、年龄以及平均病程等一般数据均不具备统计学中的意义(P>0.05)。
1.3.9 肽锌螯合物生物利用率1.3.9.1 模拟胃肠液的配制
模拟胃液的配制:准确称取2 g氯化钠与3.2 g胃蛋白酶溶于800 mL双蒸水,混匀后用6 mol/L盐酸溶液调pH值至1.2,双蒸水定容至1 000 mL后备用。
模拟肠液的配制:称取0.68 g磷酸二氢钾溶于70 mL双蒸水后,加入7.7 mL 0.2 mol/L氢氧化钠溶液,混匀后加入1 g胰蛋白酶和6 g胆盐,溶解后用0.2 mol/L的氢氧化钠调pH值至7.6,双蒸水定容至100 mL后备用[22]。
1.3.9.2 模拟体外模拟胃肠道消化
分别取10 mg/mL的肽锌螯合物和ZnSO4g7H2O(对照)溶液,用1 mol/L的盐酸调节溶液pH值到2.0,向溶液中加入5 mL的模拟胃液,混匀后,在37 ℃水浴振荡2 h。之后将混合液pH值调节至7.2后加入5 mL模拟肠液,将此混合物移入到透析袋中(7 000 Da),37 ℃振荡水浴2 h[23]。
溶解率测定:分别在胃液消化、肠液消化后测定肽锌螯合物和ZnSO4g7H2O的溶解率。取一定体积的溶液10 000 r/min离心15 min,利用EDTA络合滴定法分别测定上清液中锌离子含量和溶液中总锌含量。锌离子溶解率计算如式(2)所示:
式中:V1为滴定上清液中锌离子所需要的EDTA溶液体积/mL;V2为滴定等体积溶液中锌离子所需要的EDTA溶液体积/mL。
透析率的测定:在肠液消化后,取透析袋外的溶液,利用EDTA络合滴定测定溶液中锌离子含量,以表示透过模拟肠道的锌离子含量,锌离子透析率计算如式(3)所示:
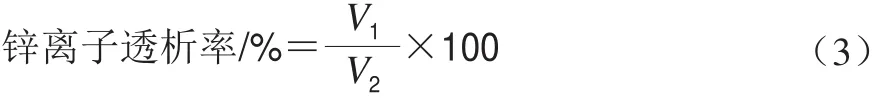
式中:V1为滴定透析袋外锌离子所需要的EDTA溶液体积/mL;V2为滴定透析袋内外锌离子所需要的EDTA溶液体积/mL。
2 结果与分析
2.1 绿豆多肽成分分析
2.2 单因素试验结果
2.2.1 反应pH值对螯合能力的影响
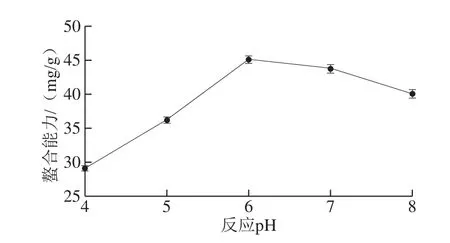
图1 反应pH值对螯合能力的影响Fig. 1 Effect of pH on chelation efficiency
从图1可以看出,肽锌螯合反应开始,随着反应pH值的不断增大,肽锌螯合能力逐渐增强,在pH值为6时,其螯合能力达到最大,随后缓慢下降。造成这种情况的原因是,当螯合反应体系中反应pH值太低时,H+则会与锌离子争夺供电子基团,不利于螯合物的生成。当反应pH值过高时,锌离子则会与OH-生成Zn(OH)2沉淀,不利于螯合反应的进行[24-25]。
2.2.2 反应温度对螯合能力的影响
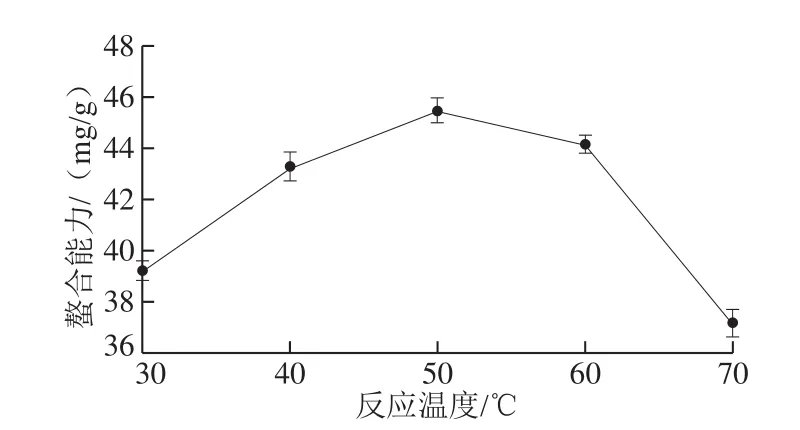
图2 反应温度对螯合能力的影响Fig. 2 Effect of temperature on chelation efficiency
从图2可以看出,螯合能力随着反应温度的上升出现先升高后下降的趋势,在反应温度达到50 ℃时,其螯合能力达到最大,但在超过60 ℃时,肽锌螯合能力则急速降低。出现这种趋势的原因是开始时温度升高会使溶液中的锌离子加速溶出,增大了锌离子与肽的碰撞频率,有利于螯合反应的进行。但由于肽锌螯合的过程属于放热过程,且高温易破坏多肽的结构,减少了多肽锌的结合位点,不利于螯合反应的进行[26-27]。
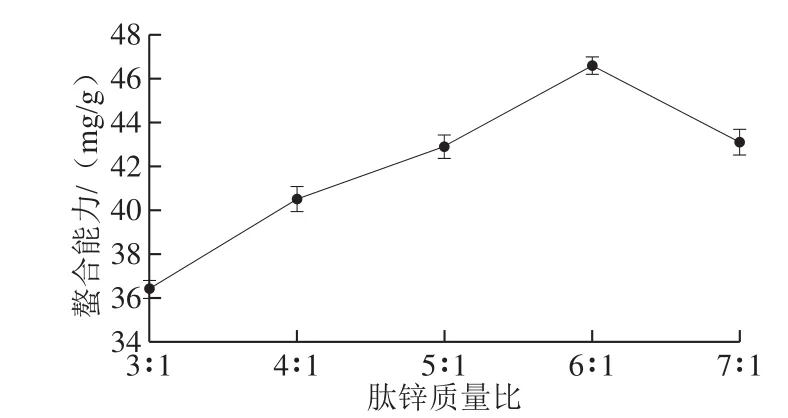
图3 肽锌质量比对螯合能力的影响Fig. 3 Effect of peptide/zinc ratio on chelation efficiency
2.2.3 肽锌质量比对螯合能力的影响从图3可以看出,在螯合反应开始时,螯合能力随着多肽比例的增加而不断增大,当其质量比达到6∶1时,肽锌螯合能力达到最高值,随后随着肽锌质量比的增大其螯合能力开始降低。出现这一现象的原因是当肽锌质量比值过小时,溶液中多肽的浓度较低且无法生成稳定的环状结构,且大量的锌离子未参加螯合反应;当肽锌比值过大时,在溶液中产生聚集现象,多肽的有效利用率下降,不利于与锌离子结合[28]。故曲线呈现先逐渐上升后下降的趋势。
2.2.4 反应时间对螯合能力的影响
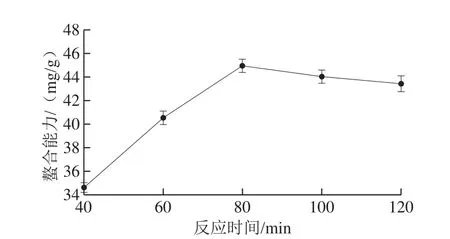
图4 反应时间对螯合能力的影响Fig. 4 Effect of reaction time on chelation efficiency
从图4可以看出,肽锌螯合反应时间逐渐延长,肽锌螯合能力不断增大,当反应时间达到80 min左右时,肽锌螯合能力达到最大,之后随着反应时间的延长,其螯合能力略有降低。故选取60~100 min作为后续研究。
2.3 响应面试验结果
2.3.1 响应试验设计及结果
为获得螯合能力最高的绿豆多肽锌螯合物,采用响应面设计对螯合条件(肽锌质量比、反应温度、反应时间、pH值)进行优化,以期获得螯合能力最高的螯合物。以X1、X2、X3、X4分别表示反应体系的pH值、反应温度、肽锌质量比、反应时间以及螯合能力(Y)为响应值,设计4因素3水平的二次回归方程拟合因素和响应值间的函数关系,见表3。根据试验结果建立多元二次回归方程:Y=51.78+1.52X1+0.46X2+1.98X3+0.094X4-1.58X1X2+1.17X1X3+0.30X1X4-0.18X2X3-1.60X2X3-0.16XX+0.55XX-6.28X2-2.65X2-1.86X2-3.51X2。
24341234由表4可以看出,此响应面的模型显著,失拟项不显著,且j为0.974 5,表示回归方程模型具有良好的实际试验拟合度,误差很小,可以在实际实验肽锌螯合能力的研究和分析中使用。
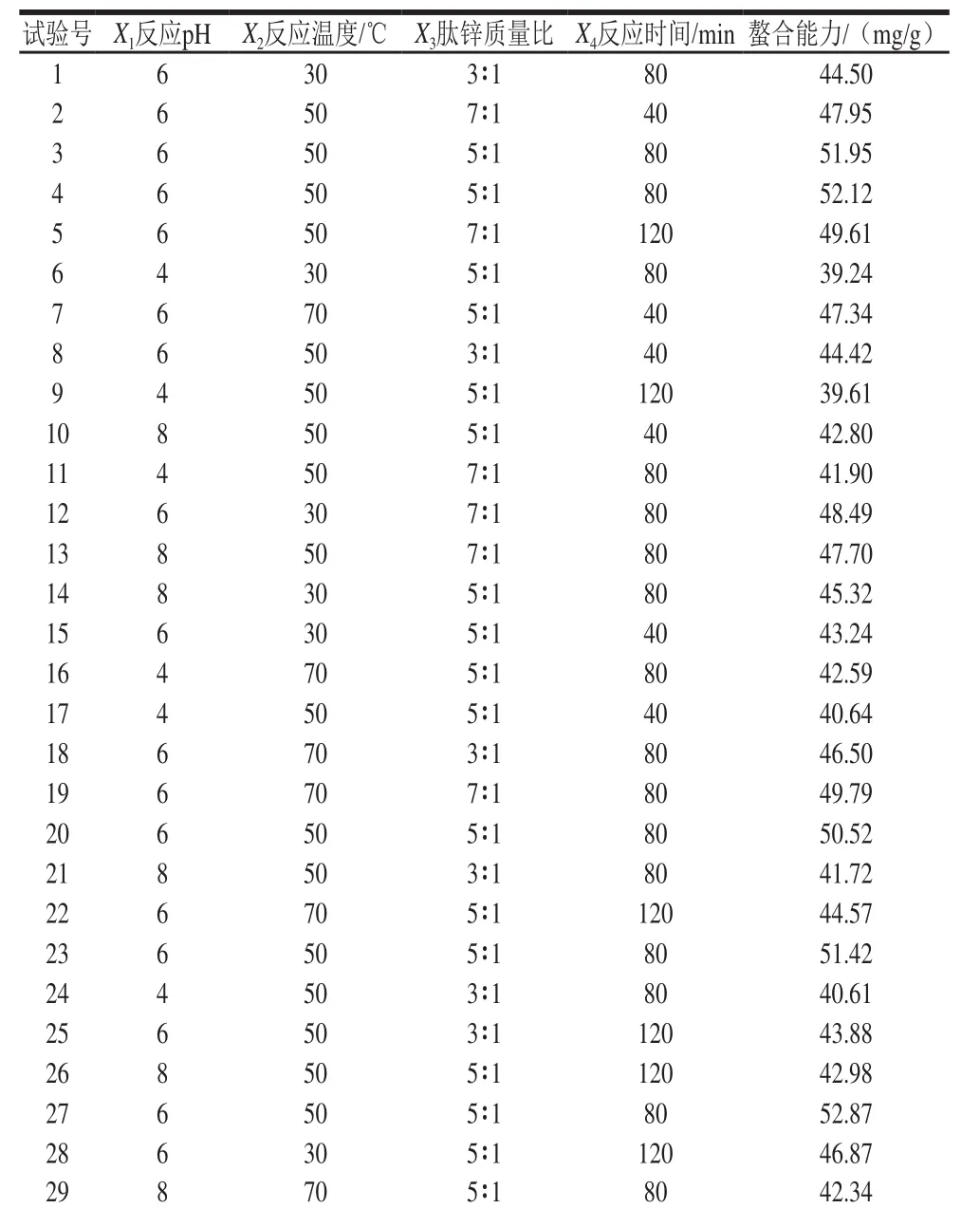
表3 响应面试验设计与结果Table 3 Experiment design with results for response surface analysis
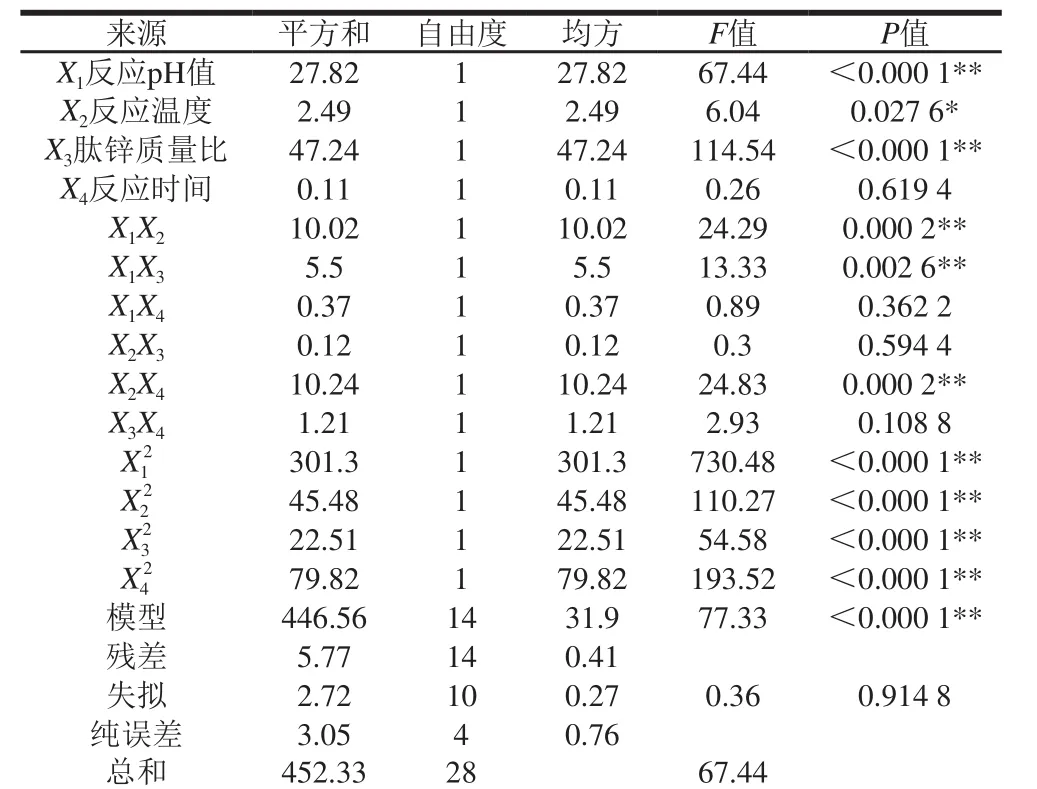
表4 回归方程模型的方差分析Table 4 Analysis of variance for regression equation
2.3.2 响应面分析
从图5可以看出,曲面形状均近似椭圆形,说明交互作用较显著。如图5A所示,反应pH值和反应温度沿着弯曲表面上升的斜率陡峭,并且轴向轮廓致密,故反应pH值和反应温度存在显著的交互作用,且明显可以看出反应pH值对肽锌螯合能力的影响相比温度较大。从图5B可以看出,当反应pH值一定时,随着肽锌质量比的不断增大,肽锌螯合能力呈现先增强后逐渐减弱的趋势,当肽锌质量比一定时,反应pH值不断升高,肽锌螯合能力也呈现先增强后逐渐减弱的趋势。由图5C可知,反应温度和反应时间沿曲面上升的坡面较缓且轴向等高线密集程度较小,故反应温度和反应时间存在显著的交互作用,反应温度与反应时间的交互作用对肽锌螯合能力的影响也是呈现先增强后减弱的趋势。结合Design Expert试验设计软件分析得到佳螯合条件为肽锌质量比为6.19∶1、反应温度49.9 ℃、反应pH 6.3、反应时间82.7 min,此时得到的响应预测值即52.50 mg/g。
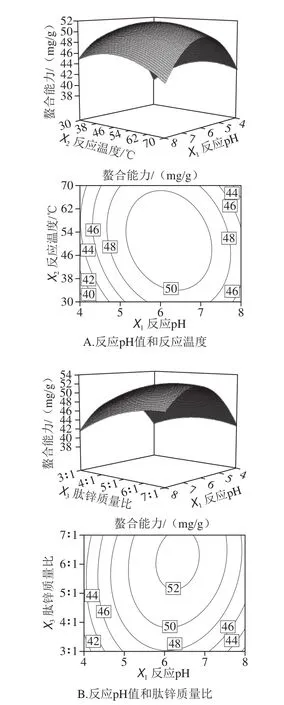
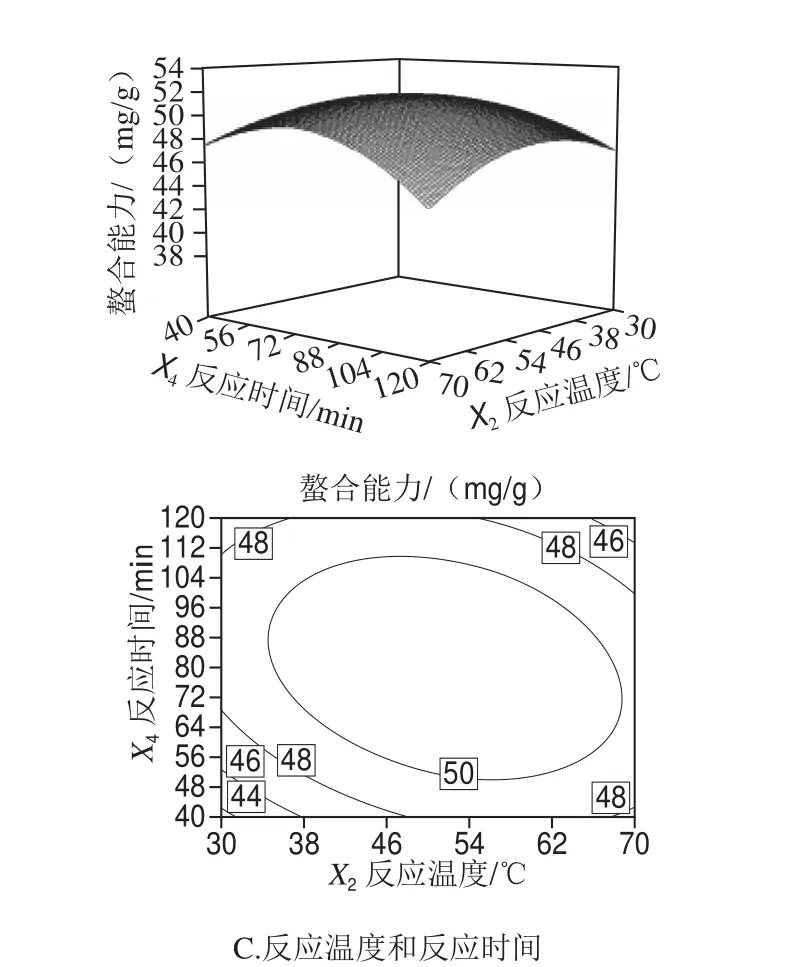
图5 各因素交互作用对肽锌螯合能力影响的响应面图Fig. 5 Response surface and contour plots showing the interactive effect of factors on chelating efficiency
2.3.3 验证实验
为后续的生产加工,将实际的应用调整为肽锌质量比6.20∶1、反应温度50 ℃、反应pH 6.3、反应时间83 min,实际得到的肽锌螯合能力的平均值为52.19 mg/g,与预测值相差0.59%,与响应面预测值较为吻合。故而,本实验所采用响应面法所得的绿豆多肽锌制备的优化工艺具有可靠性。
2.4 绿豆多肽锌螯合物的结构表征
2.4.1 紫外光谱分析
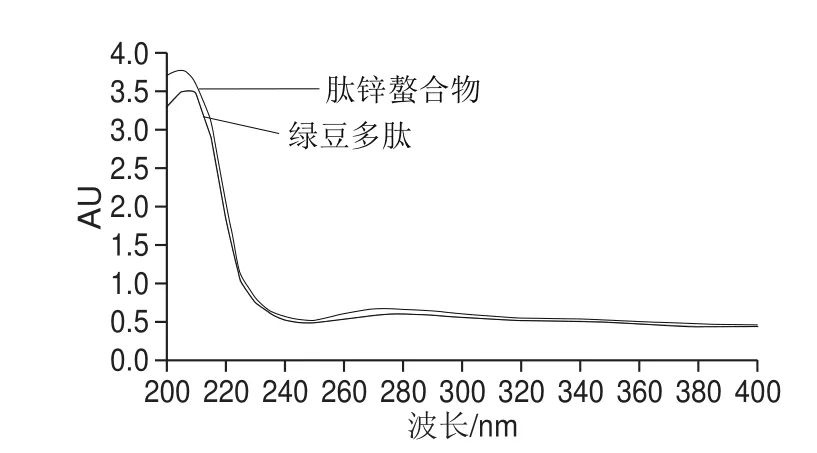
图6 绿豆多肽以及肽锌螯合物的紫外扫描图Fig. 6 Ultraviolet absorption spectra of mung bean peptide and zinc-peptide chelate
从图6可以看出,肽与螯合物的紫外吸收光谱发生了明显的改变,说明锌离子与肽发生了相互作用,并且产生了一种不同于肽的新的化合物。可以看出,肽在209 nm波长处有最大吸收峰,这是肽键上的C=O电子跃迁的结果[29],而螯合后的吸收峰移至205 nm波长处,是因为锌离子与N、O发生配位结合,使肽键上的C=O电子跃迁受到了影响。此外,肽在276 nm波长处有较弱的吸收峰,螯合后移至273 nm波长处且强度明显增加,这是配体NüCüO电子发生跃迁的结果[30]。螯合前后紫外光谱的变化说明了螯合物的生成。
2.4.2 FTIR分析
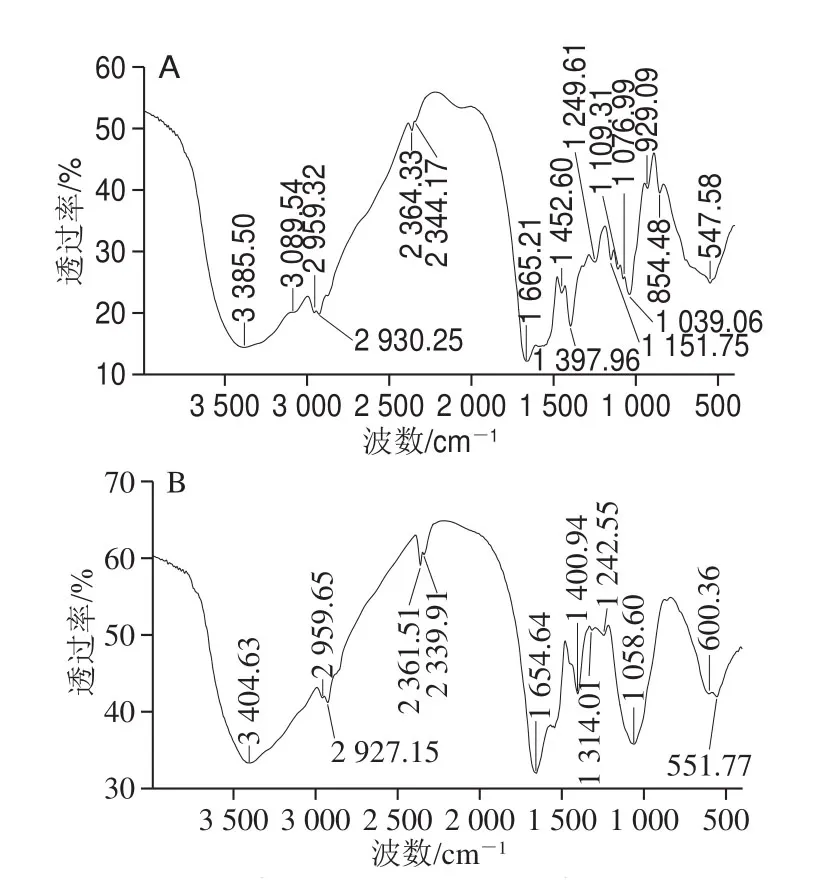
图7 绿豆多肽(A)以及肽锌螯合物(B)的红外扫描图Fig. 7 Infrared spectra of mung bean peptide (A) and zinc-peptide chelate (B)
由图7可以看出,螯合前后的红外光谱图发生了显著的变化,说明螯合反应的发生,并生成了新的物质,从而使氨基酸的振动频率发生改变,引起吸收峰的变化。绿豆多肽在3 385 cm-1处出现—NH和—OH伸缩振动频率重叠的宽吸收峰,而在螯合物的红外光谱中其波数增加至3 404 cm-1,且强度减弱,说明锌离子与—NH和—OH基团发生反应,导致电子云密度增大[31]。绿豆多肽酰胺I带的波数为1 634、1 446 cm-1,在与锌离子发生螯合反应后,波数减少到1 585、1 413 cm-1,这代表了由羰基化合物引起的红外吸收,发生了羧酸根生物反对称伸缩振动和对称伸缩振动。此外,绿豆多肽在1 037 cm-1处的吸收峰,在与锌离子螯合后移至1 058 cm-1处,且强度增大。说明锌离子与NH2发生了结合。绿豆多肽红外光谱中—NHüC=O上—NH的吸收峰在1 109 cm-1,与锌离子发生反应后消失不见,说明锌离子发生螯合的位置应该是—NHüC=O上—NH基团[32]。综上所述,与锌离子发生螯合的位置可能是—NHüC=O上的—NH,—COOH上的—OH和末端—NH2,这与紫外光谱显示的结果一致。
2.4.3 扫描电镜分析

图8 绿豆多肽(A)与钛锌螯合物(B)的扫描电镜图Fig. 8 Scanning electron micrographs of mung bean peptide (A) and zinc-peptide chelate (B)
利用扫描电镜对肽粉末和肽锌螯合物粉末的微观表面结构进行观察,将其在电镜下放大500 倍。由图8A可以看出,肽表面呈多孔状结构,且较为疏松。从图8B可以看出,肽锌螯合物表面呈片状结构,且多为聚合状态。这是因为多肽与锌离子通过离子键、配位键结合从而生成了小颗粒聚集体[33]。扫描电镜从物质微观表面结构再次证明了螯合物的形成。
2.4.4 X-射线衍射分析
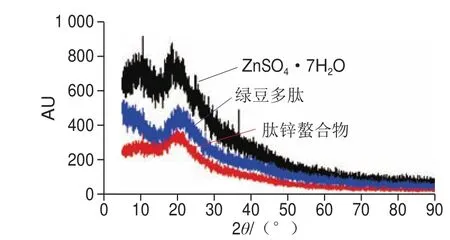
图9 X-射线衍射图谱Fig. 9 X-ray diffraction patterns of mung bean peptide and zinc-peptide chelate
由图9可看出,绿豆多肽与螯合物的的衍射图谱有很大差别。ZnSO4g7H2O具有明显的结晶衍射峰,而螯合物则没有明显的结晶衍射峰,如果绿豆多肽与锌离子仅仅是物理的混合,相互作用较弱,则螯合物会显示出结晶区。由此可以推测,锌离子在与绿豆多肽发生螯合反应时,晶体结构发生了变化,使结晶度显著下降。结晶结构发生变化的原因是绿豆多肽的末端氨基、羧基与锌离子发生了配位结合,从而导致了晶体结构发生改变[34]。这与上述所测结构的结果一致。
2.5 肽锌螯合物生物利用率分析
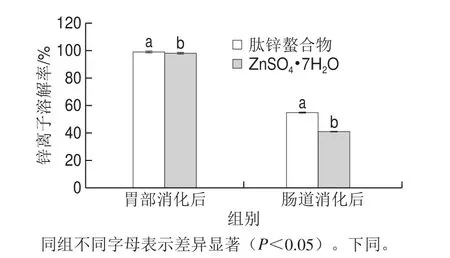
图10 体外模拟消化中锌离子溶解率的比较Fig. 10 Comparison of dissolution rates of zinc ions from zinc-peptide chelate and zinc sulfate during in vitro simulated gastrointestinal digestion
由图10、11可知,肽锌螯合物和ZnSO4g7H2O经胃消化后的溶解率分别98.85%、97.78%,二者差异显著(P<0.05);经肠道消化后的溶解率分别为54.61%、40.76%,二者差异极显著(P<0.01);透析率分别为44.24%、30.15%,差异极显著(P<0.01)。说明螯合物的溶解率在胃肠中均有良好的溶解性,且都高于无机锌盐。虽然无机锌盐在胃中也有较好的溶解性,但进入肠道后其溶解性显著下降,这因为肠道是偏碱性的环境,无机锌离子会形成氢氧化锌沉淀,而肽锌螯合物因其有较稳定的配位键[35],在胃肠中仍可以较稳定的存在,所以溶解性相较于无机锌盐更好。透析率较无机盐高的原因是锌离子与小肽结合后以分子形式直接通过透析袋,而无机锌离子较多会生成沉淀,导致无法透过。体外消化实验表明肽锌螯合物相较于无机锌盐有较好的生物利用率。
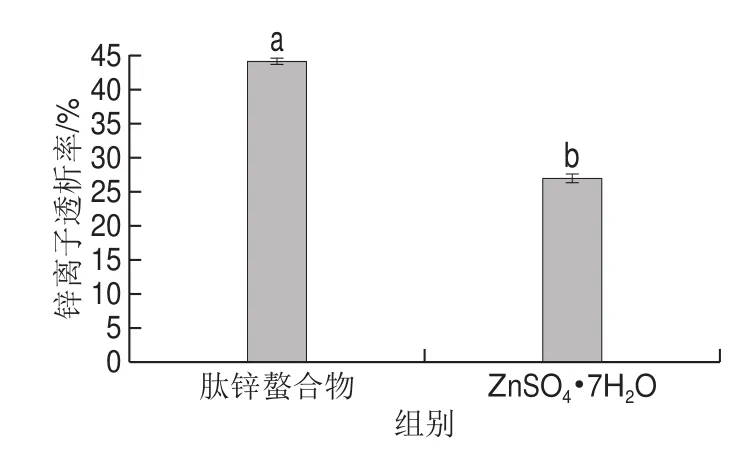
图11 体外模拟消化中锌离子透析率的比较Fig. 11 Comparison of dialysis rates of zinc ions from zinc-peptide chelate and zinc sulfate during in vitro simulated gastrointestinal digestion
3 结 论
本研究将水解后的绿豆多肽与锌离子进行螯合,以螯合能力为指标,考察反应温度、反应pH值、肽锌质量比、反应时间对螯合能力的影响。通过响应面结合实际应用得出最佳工艺条件为肽锌质量比6.20∶1、反应温度50 ℃、反应pH 6.3、反应时间83 min,实际得到的肽锌螯合能力为52.19 mg/g;对螯合绿豆多肽和肽锌螯合物的结构进行紫外光谱、FTIR、扫描电镜和X-射线衍射分析,结果表明锌离子与绿豆多肽的末端氨基、羧基以及酰胺键上的氮氢基团发生了配位反应,螯合后形成的新物质从微观表面及微观结构均有较大变化,说明螯合物与绿豆多肽分属不同物质;对螯合生成的新物质进行体外消化模拟实验,实验证明,肽锌螯合物在胃肠中的溶解率和透析率都优于无机锌盐,肽锌螯合物具有较好的生物利用率。本实验可为肽锌螯合物的生产以及后续的研究提供理论支持。
