NaOH处理对霞多丽葡萄籽原花青素的影响
2020-03-11王文雅袁其朋
张 杰,王文雅,*,袁其朋*
(1.北京化工大学生命科学与技术学院,北京 100029;2.北京化工大学厦门北化生物产业研究院有限公司,福建 厦门 361022)
葡萄籽是红酒产业的主要副产物之一,含有较多活性物质,如维生素、矿物质、脂类、蛋白质、碳水化合物、多酚等,其中最著名是原花青素(procyanidin,PC)。来源于葡萄籽的PC有很好的药理学功能,如抗氧化性、抗炎性和广谱抗菌性等[1]。PC的上述生理学活性使其在制药、食品、医疗保健等领域应用广泛。黄烷-3-醇(儿茶素(catechin,C)/表儿茶素(epicatechin,EC))和其衍生物(表儿茶素没食子酸酯(epicatechin 3-O-gallate, ECG))为葡萄籽中PC的主要聚合单元,它们通过CüC键聚合成B型的PC[2-3]。研究发现葡萄籽中65% PC的聚合度(degree of polymerization,DP)大于5[3],生物利用率研究显示,仅DP小于5的PC能被人体吸收[4-7]。虽然PC有很好的生物活性,但多数大分子PC不能被人吸收,因此将高聚原花青素(polymeric procyanidins,PPC)(DP>5)转化为能被人吸收的低聚原花青素(oligomeric procyanidins,OPC)(DP<5)或单体是葡萄籽高附加值利用的重要途经之一。
目前,国内外PC解聚的方法主要有单体链断裂剂法[8]、弱酸法[3]、酸式盐法[9]、催化剂加氢裂解法[10]、碱裂解法[11]等。这些解聚方法中,部分方法或由于生产成本高,或对设备要求苛刻,或者易产生有毒刺激性气体,不适用于食品工业生产。碱裂解法最早被应用于蔓越莓中制备A型PC,结果显示二聚体增加了8.4 倍,单体增加14.9 倍,综合评价碱法表现出了较高的工业应用潜力,但碱法对葡萄籽中B型PC制备的影响及活性研究鲜见报道。因此,本实验研究不同条件NaOH处理对葡萄籽中提取B型PC制备的影响,包括PC的平均聚合度(mean degree of polymerization,mDP)、PC含量、体外抗氧化活性、OPC组分的变化等,并且探究PC含量和体外抗氧化活性的关系。研究确定碱法对于葡萄籽中B型PPC有解聚和促进OPC释放的作用,并且确定最佳水解条件。
1 材料与方法
1.1 材料与试剂
法国霞多丽葡萄籽(酒厂) 西安昊轩生物科技有限公司;葡萄籽PC(纯度95%) 西安瑞林生物科技有限公司;总抗氧化能力检测试剂盒 碧云天生物技术公司;福林-酚试剂、标准品C 美国Sigma公司;NaOH(分析级) 北京化工厂;乙酸(色谱级) 天津赛孚瑞科技有限公司;乙腈、甲醇(色谱级) 赛默飞世尔科技有限公司。
标准品EC、ECG、原花青素二聚体B1、原花青素二聚体B2成都曼思特生物科技有限公司;原花青素二聚体B3、原花青素三聚体C1上海源叶科技有限公司;原花青素四聚体A2北京大道正行科技发展有限公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 梯希爱(上海)化成工业发展有限公司;香草醛、苄硫醇、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl hydrate,DPPH) 上海麦克林生化科技有限公司。以上标准品纯度均大于96%。
1.2 仪器与设备
MS-H-ProT加热磁力搅拌器 美国赛洛捷克有限公司;V-5100B紫外分光光度计 上海元析仪器有限公司;LC-20AT液相色谱仪 日本岛津公司;Seven2Go高级单通道便携式pH计 梅特勒-托利多国际贸易有限公司;50 mL NEST刻度尖底离心管 北京科华经纬科技有限公司。
1.3 方法
1.3.1 霞多丽葡萄籽预处理
参考Gu Liwei等[12]的方法,略有修改。葡萄籽洗净,冷冻干燥48 h,粉碎过20 目筛。称粉碎后葡萄籽50.00 g,置于500 mL烧杯中,加入250 mL正己烷,300 r/min磁力搅拌脱脂12 h,静置30 min,抽滤得滤渣,置于通风橱中,静置24 h。上述实验操作尽量在避光条件下进行。
1.3.2 碱预处理及PC粗提液制备
参考文献[11-12]的方法,略有修改。脱脂葡萄籽0.500 0 g,置于50 mL离心管中。加入5 mL NaOH溶液,NaOH溶液浓度分别为0、1、2、4、6 mol/L,处理温度分别为40、60、80 ℃,处理时间分别为15、30、60 min。处理结束后,将离心管置于冰浴中至调pH值,用4 mol/L HCl溶液调节pH值至6~7,加入丙酮-水-乙酸(70∶29.5∶0.5,V/V)溶液,将离心管溶液稀释至35 mL。稀释后的处理液37 ℃水浴超声10 min。随后,室温遮光,600 r/min搅拌提取50 min,9 000 r/min离心15 min,收集上清液即获得PC粗提液,粗提液备测。在此基础上,设定温度和时间为60 ℃、15 min,NaOH溶液浓度分别为8、10、15、20、25 mol/L,按照前述流程进一步优化碱裂解条件,提取PC备测。
1.3.3 PC粗提液的除盐液制备
参考Li Zheng等[10]的方法,用乙酸乙酯萃取去除粗提液中的盐分。取5.00 mL PC粗提液于25 mL鸡心瓶中,45 ℃旋干,用15 mL超纯水溶解固体洗涤鸡心瓶,转移至125 mL分液漏斗。加30 mL乙酸乙酯,萃取3 次,收集乙酸乙酯相。取72 mL乙酸乙酯相于100 mL鸡心瓶中,45 ℃旋干。用4 mL甲醇溶解洗涤鸡心瓶,过0.45 μm滤膜,滤液备测。
1.3.4 PC的mDP测定
各称10.00 mg C、EC、ECG、原花青素二聚体B1、原花青素二聚体B3置于10 mL容量瓶中,加入适量甲醇溶解,定容得1 mg/mL标准品溶液。C、EC、ECG为末端单元对照直接进行液相色谱测定,原花青素二聚体作为延伸单元的对照进行硫解实验。通过硫解原花青素二聚体B1和原花青素二聚体B3,鉴定C末端及3,4-反-表儿茶素苄硫醚、3,4-反-儿茶素苄硫醚和3,4-顺-儿茶素苄硫醚[13]。
硫解的方法参考文献[2,12,14-15],采用反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)略有改动。各取50 µL甲醇和原花青素二聚体B1及原花青素二聚体B3溶液分别置于250 µL内插管中,加入50 µL体积分数3.3% HCl-甲醇溶液和100 µL体积分数5%苄硫醇-甲醇溶液,然后将置于1.5 mL的液相小瓶中的内插管盖紧,40 ℃水浴30 min,-20 ℃保存10 h。甲醇组为溶剂对照组,PC粗提液及除盐液按照上述操作硫解,硫解产物采用液相色谱检测。
HPLC测定条件参考Gu Liwei等[15]的方法。Diamonsil-C18色谱柱(250 mmh4.6 mm,5 µm);柱温35 ℃;流速1.0 mL/min;进样量20 µL;检测波长280 nm;流动相A为2%乙酸溶液,流动相B为甲醇;梯度洗脱:0~45 min,15%~80% B;45~50 min,80% B;50~55 min,80%~15% B;55~70 min,15% B。mDP按式(1)计算:
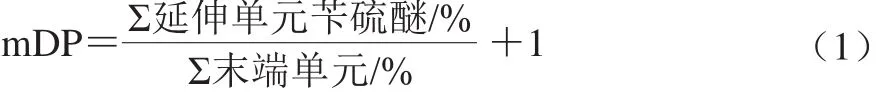
式中:末端单元分别为C、EC、ECG;延伸单元苄硫醚分别为3,4-反-儿茶素苄硫醚、表没食子儿茶素苄硫醚、3,4-顺-儿茶素苄硫醚、3,4-反-表儿茶素苄硫醚、表儿茶素-3-O-没食子酸酯苄基硫醚。
1.3.5 正相高效液相色谱(normal-phase high performance liquid chromatography,NP-HPLC)分析OPC组分
各称10.00 mg C、EC、ECG、原花青素二聚体B1、原花青素二聚体B2、原花青素二聚体B3、原花青素三聚体C1、原花青素四聚体A2置于10 mL容量瓶中,加入适量甲醇溶解固体,定容得1 mg/mL标准品溶液,过0.45 µm滤膜,备测。各取1 mL 1 mg/mL的C、EC、ECG、原花青素二聚体B1、原花青素二聚体B2、原花青素二聚体B3溶液于10 mL带塞螺纹玻璃管,混合均匀得混合标准品1。同样配制混合标准品2(C、EC、ECG)、混合标准品3(原花青素二聚体B1、原花青素二聚体B2、原花青素二聚体B3)、混合标准品4(C、EC、ECG、原花青素二聚体B1、原花青素二聚体B2、原花青素二聚体B3、原花青素三聚体C1、原花青素四聚体A2),-20 ℃贮存备测。
HPLC条件参考Choy等[16]的方法,略有改动。Develosil diol 100色谱柱(250 mmh4.6 mm,5 µm);柱温30 ℃;流速1.0 mL/min;进样量20 µL;检测波长280 nm;流动相A为乙腈-乙酸溶液(98∶2,V/V),流动相B为甲醇-超纯水-乙酸溶液(95∶3∶2,V/V);梯度洗脱:0~3 min,7% B;3~53 min,7%~37.6% B;53~56 min,37.6%~100% B;56~69 min,100% B;69~75 min,100%~7% B;75~85 min,7% B。参考文献[16]的液相色谱测定条件对DP大于10的PC检测有干扰,因此将流动相A改为乙腈-水(98∶2,V/V),其他测定条件同上。
1.3.6 PC含量的测定
参考Çam等[17]的方法,略有修改。称25.00 mg C置于25 mL容量瓶,加入适量甲醇溶解C,定容得100 µg/mL母液。分别取1、2、4、6、8 mL母液置于10 mL容量瓶,定容得10、20、40、60、80 µg/mL梯度溶液。取1.00 mL待测液于10 mL试管中,加2.50 mL质量分数1%香草醛-甲醇溶液,加2.50 mL体积分数25% H2SO4-甲醇溶液,30 ℃水浴15 min,于波长500 nm处测吸光度,甲醇作空白对照。以吸光度为纵坐标,以C质量浓度为横坐标,绘制标准曲线,得回归方程y=0.008 1x+0.068(R2=0.999 8)。除盐液稀释8 倍,进行测定,根据方程计算,结果以C当量表示(µg/mL),以干基计。
1.3.7 体外抗氧化测定
1.3.7.1 DPPH自由基清除能力测定
参考Xu Changmou等[18]的方法,略有修改。称6.26 mg Trolox置于25 mL容量瓶,加入适量甲醇溶解Trolox,定容得1 000 µmol/L母液。分别各取1、2、4、6、8 mL母液置于10 mL容量瓶,定容得100、200、400、600、800 µmol/L Trolox溶液。取100 µL待测液于10 mL试管,加入3.90 mL 2.5 mg/100 mL DPPH-甲醇溶液。空白组为甲醇,于波长515 nm处测得吸光度A0。对照组在30 ℃黑暗条件下反应60 min,于波长515 nm处测定吸光度A。DPPH自由基清除率按式(2)计算。以清除率为纵坐标,以Trolox为横坐标,绘制标准曲线,得回归方程y=0.055x+0.976 2(R2=0.999 6)。除盐液稀释8 倍后,进行测定,根据方程计算,结果以Trolox当量(µmol/g)表示,以干基计。

1.3.7.2 Fe3+还原能力(Ferric ion reducing antioxidant power,FRAP)测定
参考相关文献[19-20]的方法,略有改动。称量12.52 mg Trolox置于50 mL容量瓶,加入适量超纯水溶解,定容得2 000 µmol/L母液。分别取0.5、2.5、5、7.5 mL母液置于10 mL容量瓶,定容得150、300、600、900、1 200、1 500 µmol/L Trolox溶液。取试剂盒中TPTZ稀释液、TPTZ溶液和检测缓冲液以10∶1∶1比例混匀,37 ℃孵育60 min得FRAP工作液。取180 µL FRAP工作液加入到96 孔板中,加入5 µL待测样品混匀,37 ℃孵育5 min,于波长593 nm处测定吸光度,超纯水作空白对照。以还原产物吸光度为纵坐标,Trolox为横坐标,绘制标准曲线,得回归方程y=0.000 6x-0.027 7(R2=0.998 3)。除盐液稀释8 倍后,进行测定,根据方程计算,结果以Trolox当量(µmol/g)表示,以干基计。
1.3.7.3 ABTS阳离子自由基清除能力测定
参考相关文献[19,21]的方法,略有改动。取100 mL 7 mmol/L ABTS溶液和50 mL 2.45 mmol/L K2S2O8溶液置于250 mL蓝色螺纹瓶,25 ℃黑暗条件下反应12 h,得ABTS反应初始液。用乙醇稀释ABTS反应初始液于波长734 nm处测定吸光度为0.700f0.200。称12.52 mg Trolox置于50 mL容量瓶,加入适量甲醇溶解,定容得2 000 µmol/L母液。分别取0.5、2.5、5、7.5 mL母液置于10 mL容量瓶,定容得100、500、1 000、1 500 µmol/L溶液。取30 µL待测液于10 mL试管中,加入3.00 mL ABTS-甲醇溶液,30 ℃反应6 min,在734 nm波长处测定吸光度A,空白组为乙醇溶液A0。清除率计算同式(2)。以ABTS阳离子自由基清除率为纵坐标,以Trolox为横坐标,绘制标准曲线,得回归方程y=0.000 4x-0.024 8(R2=0.995 9)。除盐液稀释8 倍后,进行测定,根据方程计算,结果以Trolox当量表示(µmol/g),以干基计。
1.3.8 PPC的制备
参考Saucier等[22]的方法,略有改动。制备文献[22]中报道的mDP较高的组分F1。称2.00 g 95%葡萄籽PC于200 mL容量瓶,加入适量超纯水溶解,定容得10 g/L母液。取50 mL的母液置于250 mL的分液漏斗中,加入100 mL乙酸乙酯萃取,萃取3 次,收集水相。将水相置于100 mL鸡心瓶中,45 ℃旋干。加入25 mL的甲醇重新溶解和洗涤鸡心瓶,并将液体转移至100 mL离心管中,加入25 mL氯仿,混合均匀后静置30 min。将液体分别置于2 个50 mL离心管中,10 000 r/min离心15 min。弃上清液,收集固体,加少许甲醇溶解,将溶液置于100 mL鸡心瓶,45 ℃旋干,得50.00 mg PPC固体。
称10.00 mg PPC,置于10 mL容量瓶,加入适量甲醇溶解,定容得1 mg/mL PPC,过0.45 μm滤膜,备测。进行硫解实验,测定PPC的mDP。
中和反应会生成较多NaCl引起柱子堵塞,因此选取低浓度2 mol/L NaOH溶液进行研究。称20.00 mg PPC于50 mL离心管中,加入1 cm转子,加20 mL 2 mol/L的NaOH溶液,60 ℃、200 r/min水浴15 min。然后将离心管冰浴,200 r/min持续搅拌,用4 mol/L HCl溶液调节pH值至6~7。取15 mL粗反应液按照1.3.3节步骤除盐得除盐液,过0.45 μm滤膜,备测。
1.4 数据处理
所有实验重复3 次,采用Origin 2017处理数据并作图,结果以fs表示。用One-way ANOVA分析显著性差异,P<0.05,差异显著。
2 结果与分析
2.1 NaOH处理条件对PC的mDP的影响
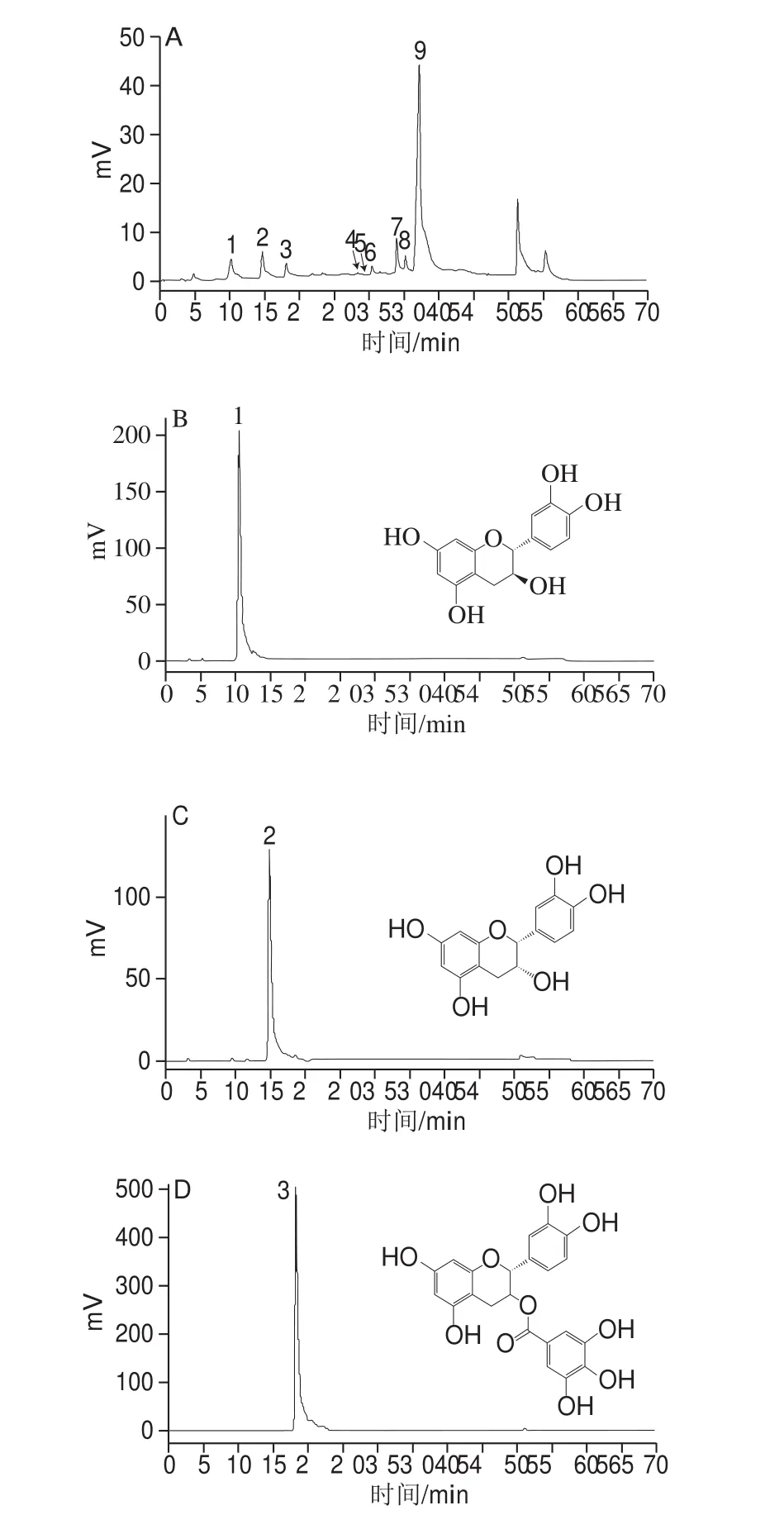
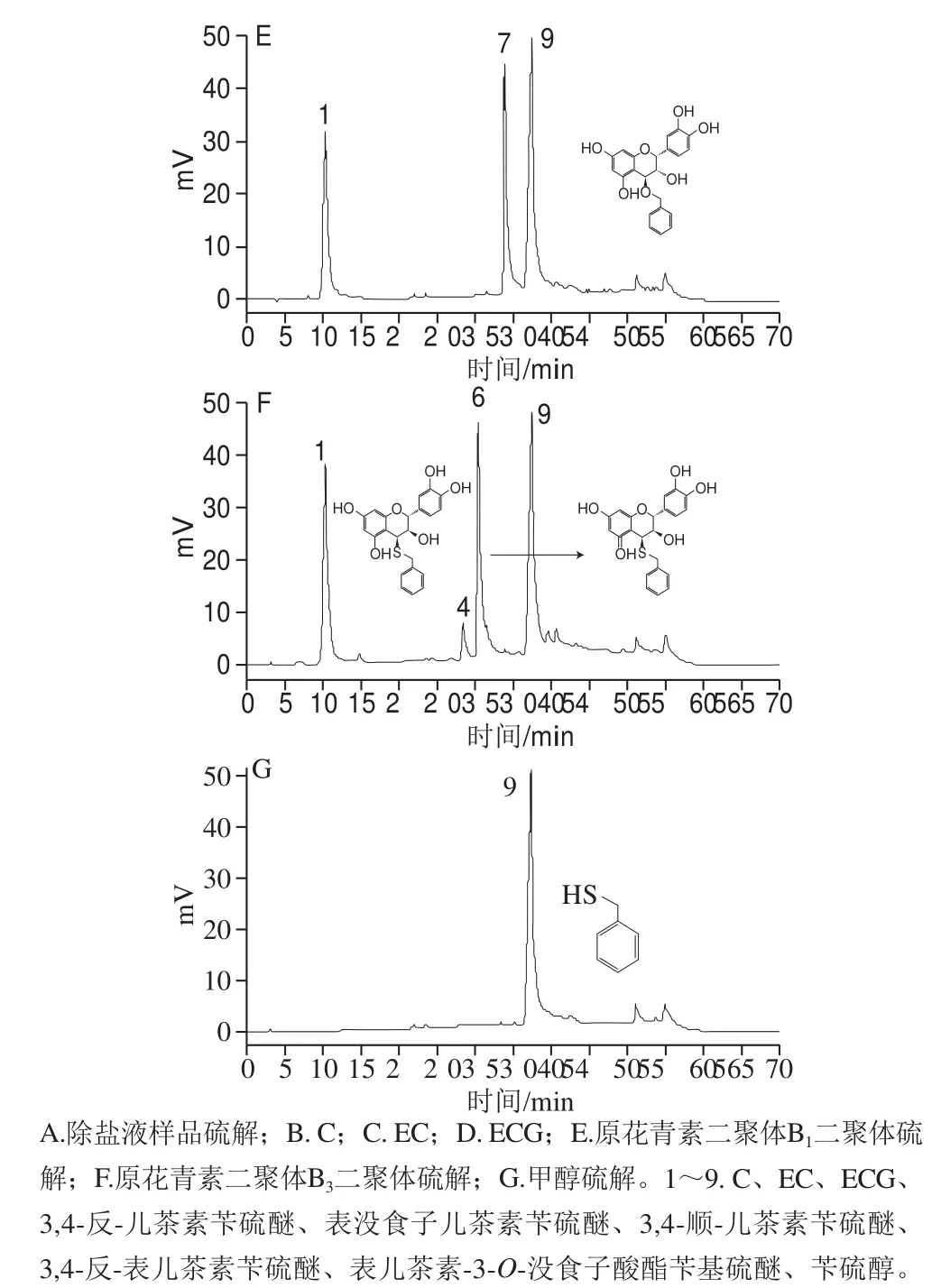
图1 RP-HPLC检测除盐液样品、聚合终端标准品、聚合延伸单元(二聚体硫解)色谱图Fig. 1 RP-HPLC analysis of desalted sample, polymerization terminal standard, polymerization extension unit (dimer thiolysis)
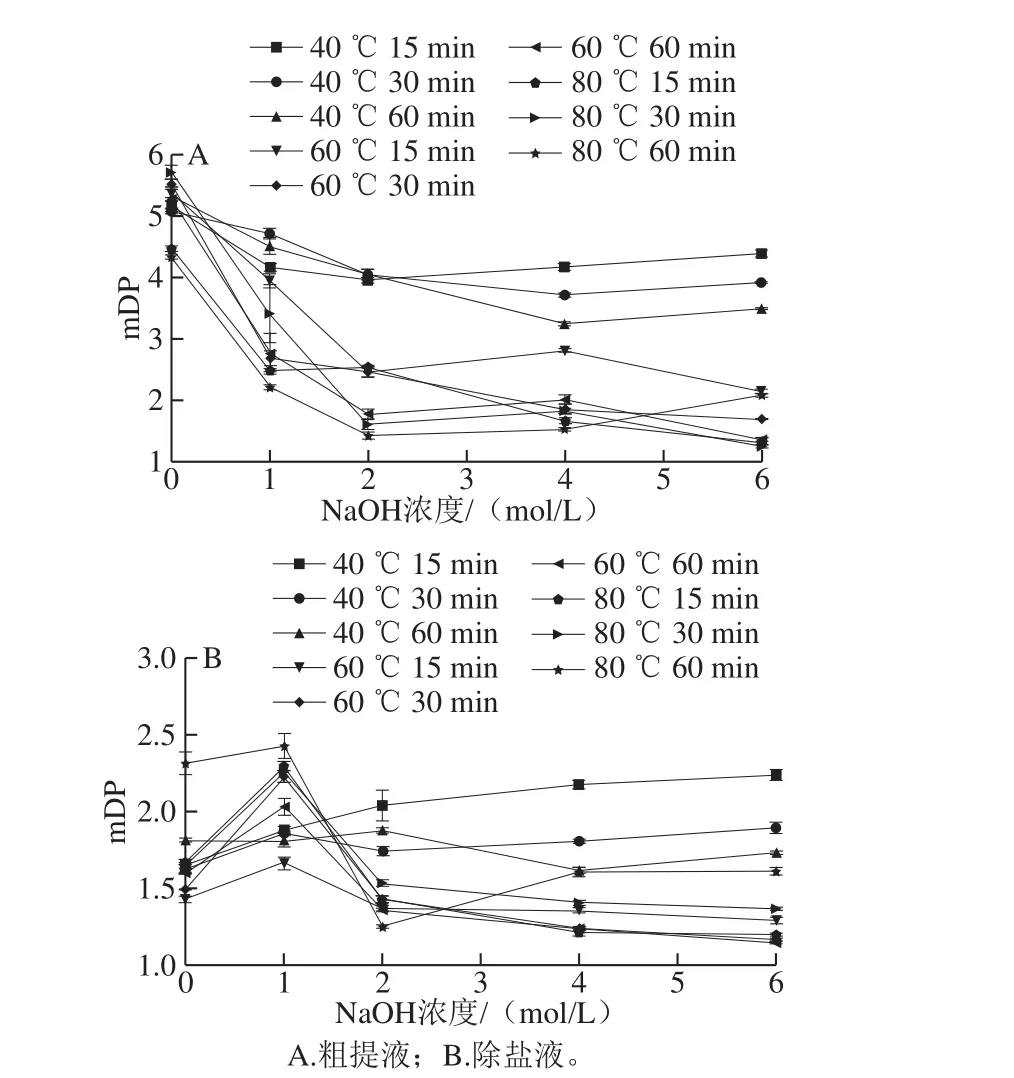
图2 NaOH处理对PC mDP的影响Fig. 2 Effect of different NaOH pretreatments on the mDP of procyanidins
如图1A所示,分离出9 个峰,其他样品出峰相似。图1B~G为PC末端单元及延伸单元的出峰时间,与Gu Liwei等[12]结果一致。其中峰5和峰8对应的表没食子儿茶素苄硫醚和表儿茶素-3-O-没食子酸酯苄基硫醚无标准品,只能根据相关文献出峰时间及顺序鉴定[12,14-15,23-24]。由图2A可知,粗提液组中经NaOH处理的实验组与NaOH浓度为0 mol/L的对照组相比,整体mDP均显著降低,说明温度、时间及NaOH浓度都会影响mDP,可推测NaOH对PC可能有解聚的作用。但粗提液中含NaCl较多会堵塞液相色谱柱,因此后续检测需进行除盐处理。由图2B可知,与粗提液相比,除盐液的mDP稳定在1.2~2.5之间,十分接近。
2.2 NaOH处理条件对PC及体外活性的影响
2.2.1 液相色谱测定条件的优化
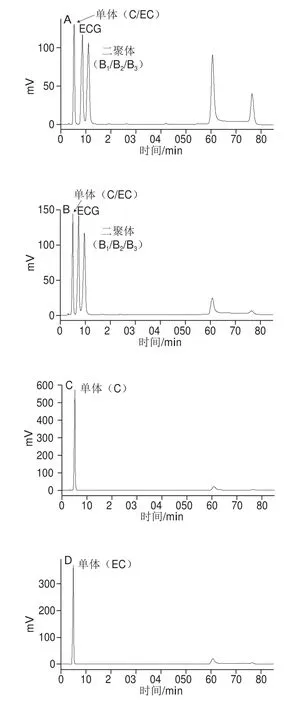

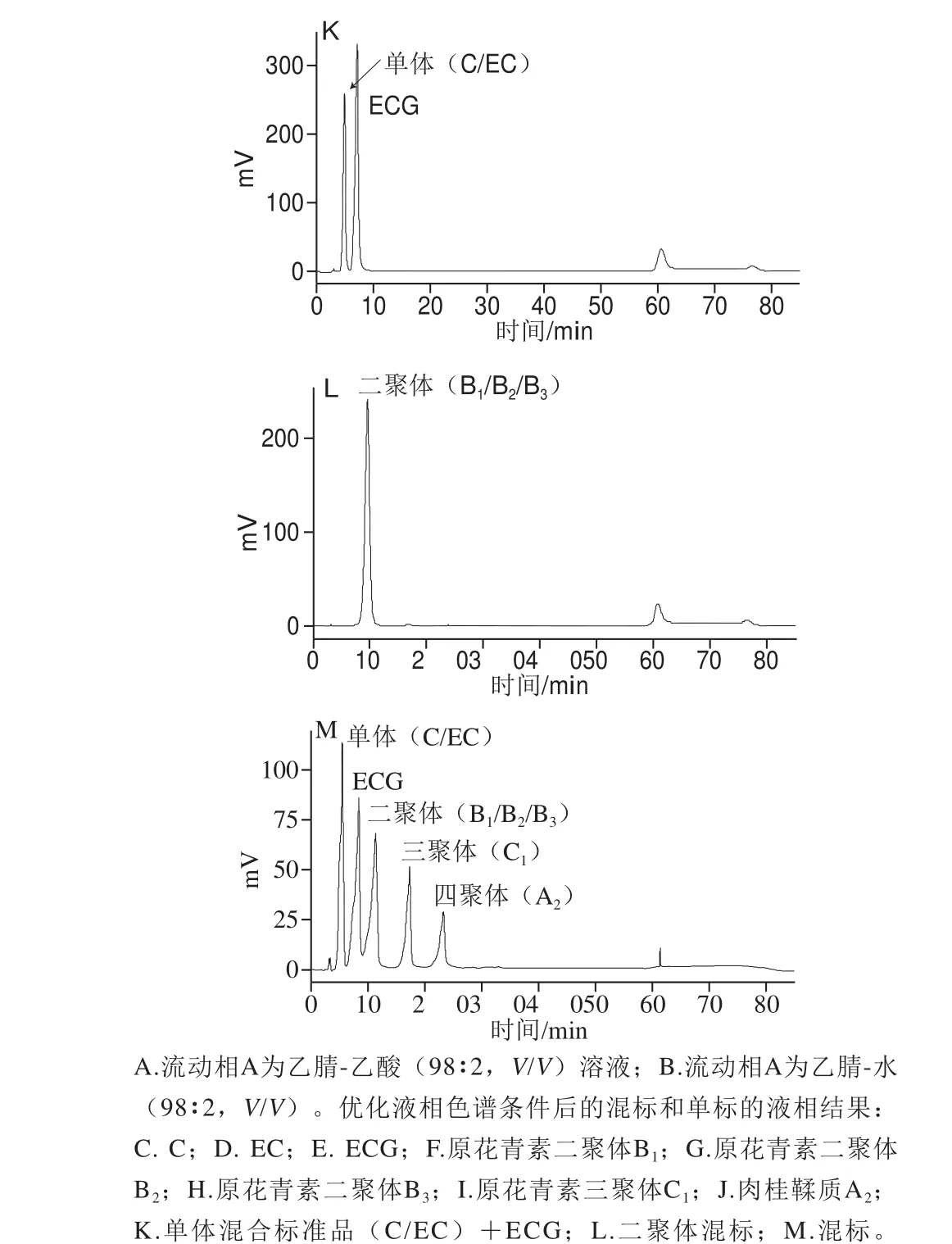
图3 液相色谱条件优化Fig. 3 Optimization of mobile phase composition
目前用于葡萄籽PC检测的方法有MonoChrom Diol[25]和Develosil Diol[16,26-28]。Develosil Diol能测DP 1~10及DP大于10的PC,MonoChrom Diol能测DP 1~5及DP大于5的PC,为更准确地表征PC,本研究采用Develosil Diol对PC的DP进行测定。首先进行单体和二聚体混合标准品检测的优化,从图3A可以看出,将乙腈-乙酸(98∶2,V/V)作为流动相条件下,在60 min出现一个非目标大峰,为减少非目标因素的干扰,对流动相进行优化,流动相改为乙腈-水(98∶2,V/V);调整后的结果如图3B所示,60 min大峰减小,说明干扰减小。在此基础上,使用新的流动相体系对C、EC、ECG、原花青素二聚体B1、原花青素二聚体B2、原花青素二聚体B3、原花青素三聚体C1、原花青素四聚体A2单标和混标进行检测,结果显示,分子质量相同的单体混合仅出现一个峰;分子质量不同的混标,按照分子质量大小,分子质量小的先出峰,分子质量大的后出峰;混标各单体的出峰时间与单标的出峰时间有差异,但差异较小(图3C~M)。这说明乙腈-水(98∶2,V/V)为较优的流动相,能够用于后期葡萄籽OPC制备物的鉴定。
2.2.2 NP-HPLC测定OPC组分及OPC含量
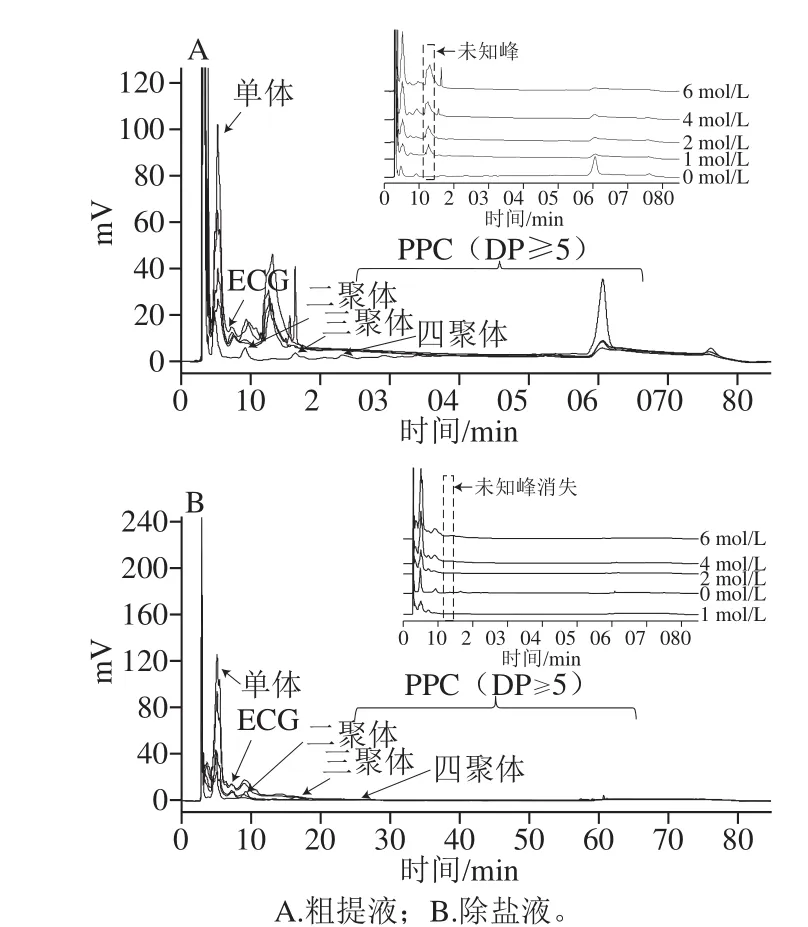
图4 样品的NP-HPLC分析Fig. 4 NP-HPLC analysis of crude and desalted samples
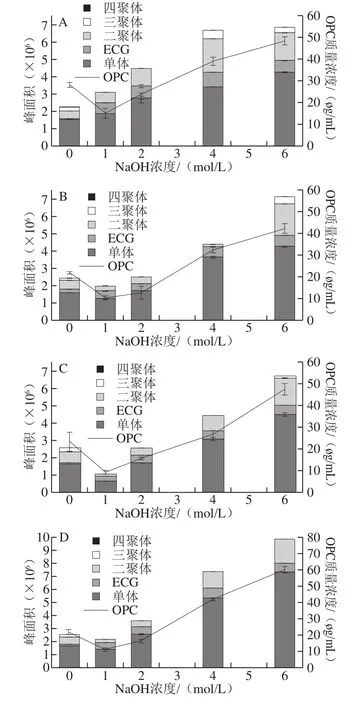
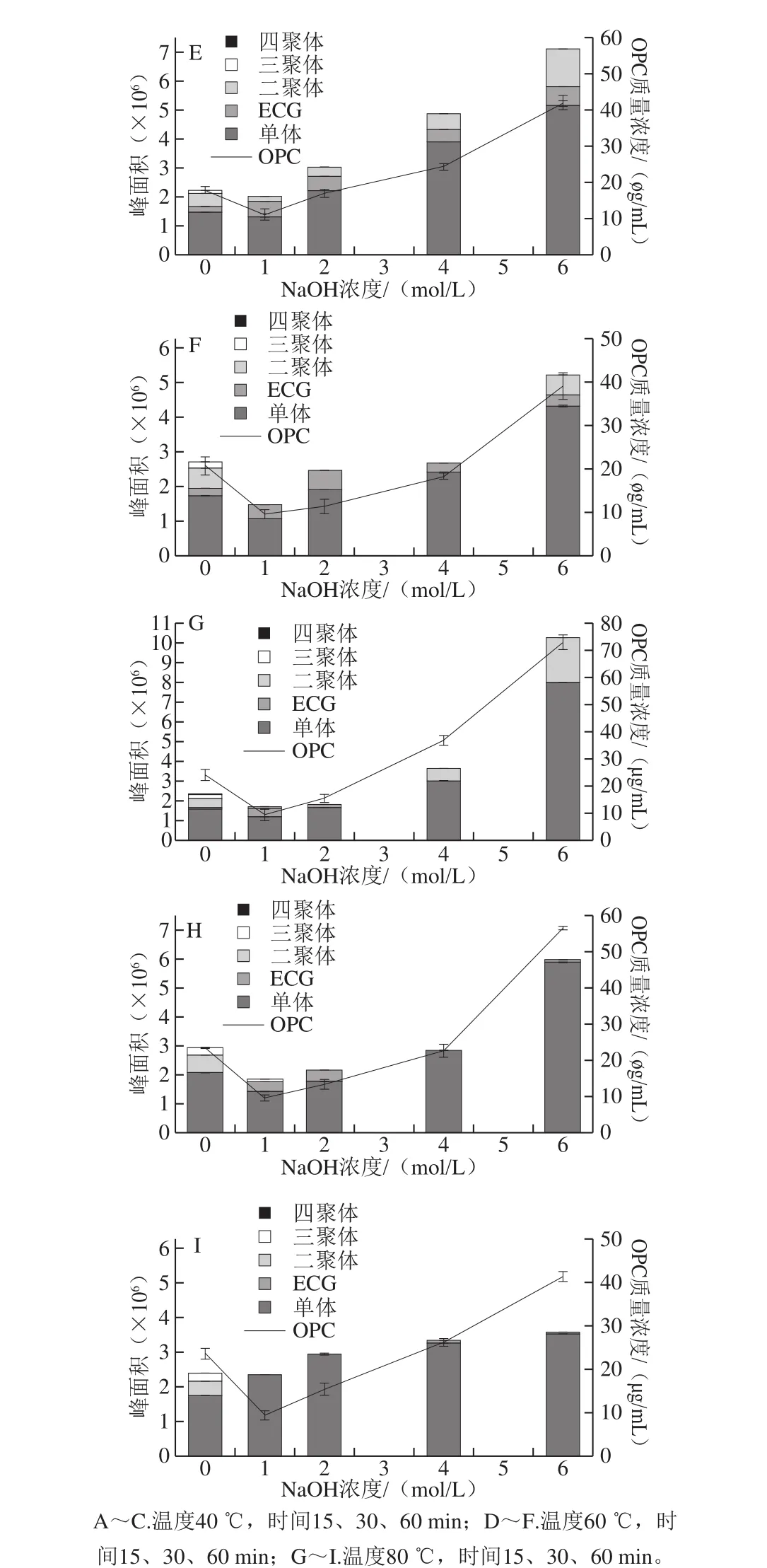
图5 碱处理样品的液相色谱分析及OPC含量的变化Fig. 5 Effect of NaOH concentration on OPC contents as a function of pretreatment temperature
生物利用率研究显示,OPC是被人体吸收的主要PC组分。因此,研究碱对PC的解聚效果需要重点分析产物中OPC含量的变化。依据DP小于5混标的出峰时间,可以对OPC的组分进行分析(图3M)。图4分别为60 ℃,15 min,NaOH浓度分别为0、1、2、4、6 mol/L粗提液和除盐液的液相色谱图,OPC的组成和含量有明显的变化,其中粗提液中10~15 min出现了一个明显的大峰(图4A),但在除盐液中却没有(图4B),可以推测这个未知峰对应的化合物不溶于乙酸乙酯,可能是杂质,因此不再进一步分析。图4B中25 min后基本没有出峰,也说明除盐后样品中的主要PC为OPC。由图5A~I可知,OPC各组分占比为单体>二聚体>ECG>三聚体>四聚体,四聚体较少。以下除特殊说明,对照组均为0 mol/L NaOH。
考察处理时间15、30、60 min对OPC组分的单峰面积、总峰面积、OPC含量的影响发现(图5A~C),随着时间的延长,对照组OPC组分的单峰面积、总峰面积、OPC含量变化不大,而实验组OPC组分的单峰面积、总峰面积、OPC含量均呈减小趋势。研究温度40、60、80 ℃对OPC组分的单峰面积、总峰面积、OPC含量的影响发现(图5A、D、G),随着温度的升高,对照组的OPC组分的单峰面积、总峰面积、OPC含量变化不大,实验组除1 mol/L碱处理外,OPC组分的单峰面积、总峰面积、OPC含量均呈现增加趋势,其中6 mol/L表现最优,而80 ℃结果最差。
NaOH浓度变化对OPC组分的单峰面积、总峰面积、OPC含量的影响显示,与对照组相比,1 mol/L时单峰面积小于对照,大于1 mol/L时峰面积均大于对照,且随着NaOH浓度的增加而增加;OPC组分的总峰面积及OPC含量的变化与单体峰面积变化相似,且进一步增加NaOH浓度仍有可能增加OPC组分、总峰面积及OPC含量(图5)。
综合处理时间、处理温度、NaOH浓度3 个因素分析,当6 mol/L NaOH溶液处理15 min时,对比处理温度40、60、80 ℃的数据发现,80 ℃和60 ℃较高,且80 ℃的OPC总峰面积和OPC含量高于60 ℃,依次分别为10 265 300.00f10 750.08,(72.96f2.60)μg/mL和9 878 310.00f15 417.32,(60.25f1.84) μg/mL,但60 ℃时有3 种PC:单体7 332 290.00f7 846.53、ECG 672 790.33f1 149.17和二聚体1 873 230.00f6 690.29,而80 ℃仅有2 种PC:单体8 023 860.00f7 010.10和二聚体2 241 460.00f4 675.69。苏惠娟[29]尝试4 种碱解聚PPC,解聚效果为氢氧化钠>碳酸钠>碳酸氢钠≈碳酸氢钾,最佳解聚条件为60 ℃、1 mol/L NaOH溶液处理25 min,得单体15.6 mg/g,二聚体20.1 mg/g,与本研究解聚产物相似。
2.2.3 NaOH处理样品体外抗氧化活性

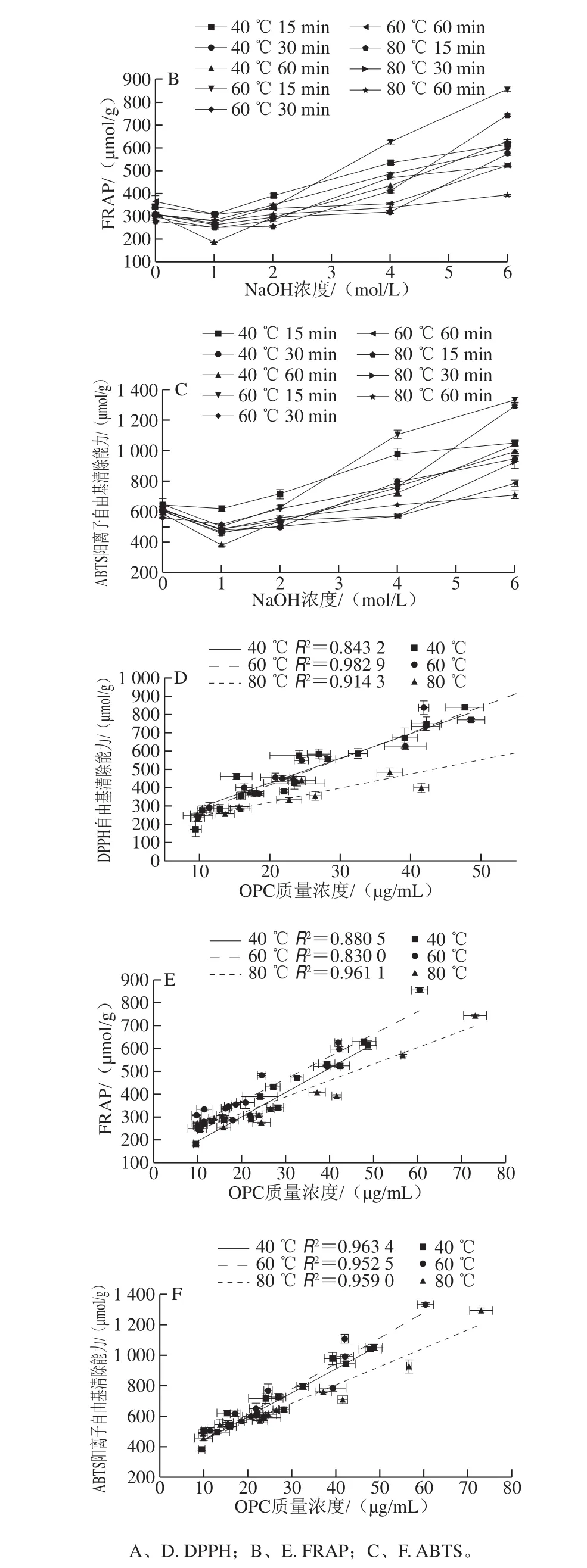
图6 不同碱处理样品的体外抗氧化活性及体外活性与PC含量的相关性分析Fig. 6 In vitro antioxidant activities of different alkali-treated samples and their correlation with PC content
由图6所示,当温度和时间一定时,与对照组相比,1 mol/L NaOH处理样品的抗氧化活性小于对照,大于1 mol/L时活性均大于对照,且随着NaOH浓度的增加而增加。当温度和NaOH浓度一定时,活性随着时间的延长而降低。当时间和NaOH浓度一定时,随着温度的变化,活性的变化无规律。6 mol/L NaOH处理15 min,对比不同温度发现,DPPH、FRAP、ABTS抗氧化实验结果均表现为60 ℃时活性最高,分别为(967.40f14.69)、(856.72f10.046 19)、(1 331.17f12.38) μmol/g。综上分析,60 ℃条件下,6 mol/L NaOH处理15 min,获得的OPC活性最高,OPC组成分析结果显示,该条件下获得OPC富含ECG组分(图5D)。Zhang Shuting等[30]的研究结果与本研究相似,且其研究指出ECG的活性高于C和EC。故ECG组分含量较高可能是60 ℃、6 mol/L NaOH处理15 min后,OPC活性最大的原因。
2.2.4 最优碱处理条件
6 mol/L NaOH、60 ℃碱处理15 min时,OPC组分的总峰面积、OPC含量及体外抗氧化活性均呈增加趋势(图6),推测进一步增加NaOH浓度仍可以增加OPC组分的总峰面积、OPC含量及体外抗氧化活性。25 ℃时,饱和NaOH浓度为26.4 mol/L,因此进一步研究8、10、15、20、25 mol/L NaOH对PC解聚的影响。由图7A可知,粗提液mDP在10 mol/L NaOH处理时降至最低,随着NaOH浓度的增加又呈缓慢增加;而除盐液的mDP较平稳地维持在1.29f0.019~2.51f0.017。图7B~D显示,除盐液的OPC总峰面积与PC含量均在10 mol/L NaOH处理时达最大值,DPPH、FRAP、ABTS 3 种方法对于除盐液抗氧化活性检测均显示在10 mol/L NaOH处理时达最高值。且PC含量与DPPH、FRAP、ABTS抗氧化活性均表现良好的线性关系。综上,最佳预处理条件为60 ℃、15 min、10 mol/L NaOH。在此条件下,与对照组相比,mDP由5.39f0.12降至1.30f0.014,OPC组分的总面积增加了7.28 倍(单体8.09 倍,二聚体7.53 倍,三聚体4.66 倍),OPC含量增加了5.42 倍,体外抗氧化活性DPPH、FRAP、ABTS分别提高3.22、4.13 倍和2.84 倍。
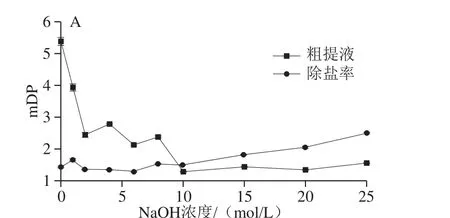
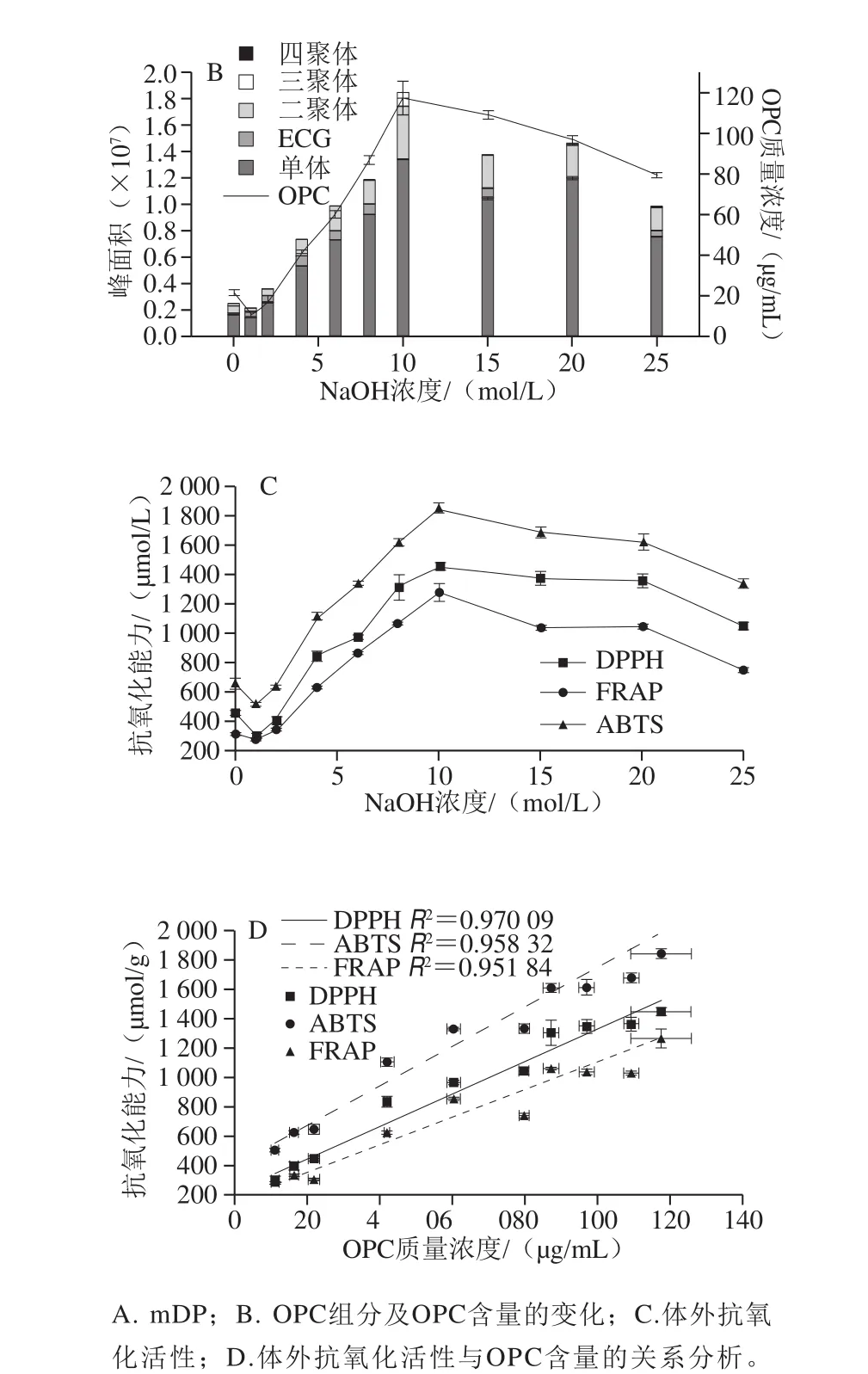
图7 NaOH浓度对PC的影响Fig. 7 Effect of different NaOH concentrations on mDP and total area and content of OPC and correlation between antioxidant activities and OPC content
2.2.5 碱处理对葡萄籽中PC释放和解聚的规律
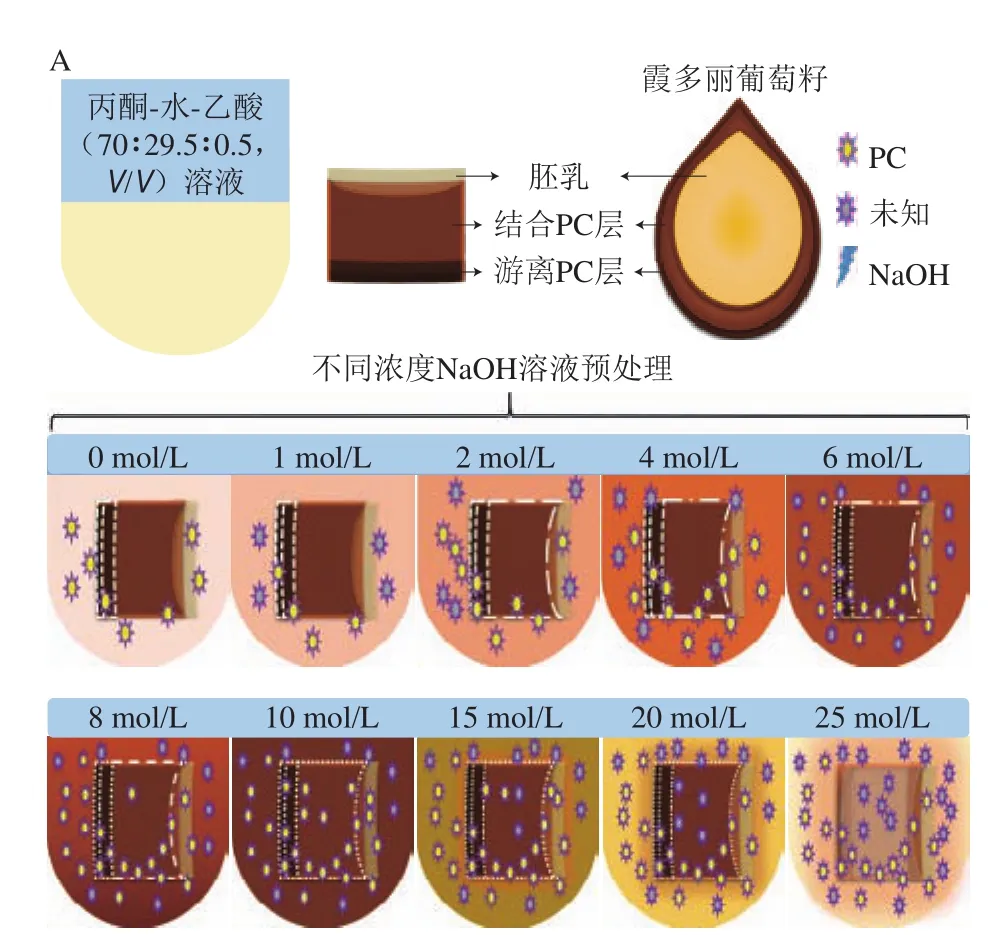
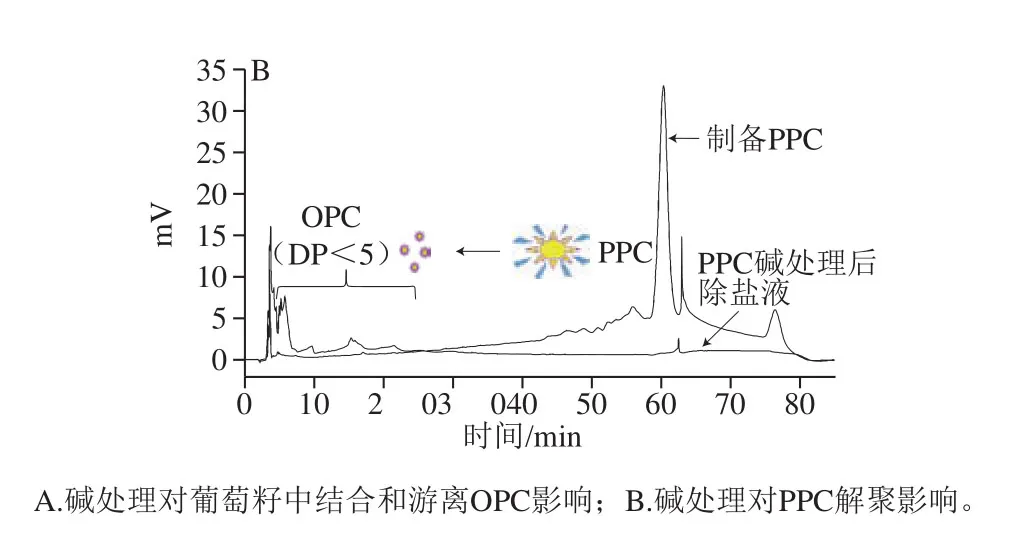
图8 碱处理对PC解聚的影响Fig. 8 Effect of alkali treatment on depolymerization of procyanidins
依据2.2.4节分析NaOH浓度0~25 mol/L,60 ℃碱处理15 min对OPC组分及OPC含量的影响,发现碱对葡萄籽中的PC可能存在2 种作用:首先根据OPC含量先降低后增加的趋势分析,碱可以促进OPC释放。其次根据液相结果分析单体、ECG、二聚体、三聚体等对应的峰面积都有或多或少的增加,其中单体占比最高,增加最显著,可以推测碱对PPC可能存在解聚作用。这与相关报道[31-32]的酚酸在植物中的2 种存在状态(游离态和结合态)一致。随着NaOH浓度提高,OPC含量先增加后减少的规律也支持本实验推测的可能性(图7B)。图8A对NaOH浓度影响葡萄籽中游离和结合的OPC含量变化的机制进行了解释:对照组没有碱的作用,游离层的OPC可以被丙酮混合液提取。1 mol/L NaOH处理时,碱对结合层作用很小,不足以破坏其结构或与其成分发生反应,NaOH则会与部分游离层释放的OPC反应破坏其结构。当2~10 mol/L NaOH处理时,随着NaOH浓度的增加,结合层被逐渐破坏瓦解,随着结构破坏的加剧更多的OPC被释放,同时也有更多OPC与碱反应,但释放大于损失。在10 mol/L NaOH处理时,释放远大于损失,故溶液中OPC最多。当10~25 mol/L NaOH处理时,结合层释放的OPC在10 mol/L NaOH时已达到最大值,随着NaOH浓度的增加,OPC损失加剧,损失逐渐大于最大释放量,故溶液中能检测到的OPC越来越少。0~25 mol/L NaOH,60 ℃处理15 min时检测结果显示,碱对OPC组分有明显增加作用(图7B)。进一步PPC碱处理,如图8B所示,碱处理使60 min单峰变为在3~20 min的系列小峰,而图3M显示在此时间段内出现的单峰为单体、ECG、二聚体、三聚体,说明碱对PPC存在解聚作用,此结果与White等[11]的研究结果一致。上述这些结果说明了碱对葡萄籽中的OPC存在释放和解聚制备2 种作用机制,二者的动态平衡显示为最终OPC的产量。
3 结 论
通过探究不同NaOH浓度条件对葡萄籽PC的mDP、OPC组分、OPC含量以及体外抗氧化活性的影响,发现碱对于PC的释放及解聚均有作用,并且得到了最优条件为60 ℃、15 min、10 mol/L NaOH处理。与对照组相比,优化处理条件下PC的mDP由5.39f0.12降至1.30f0.014,OPC组分的总面积增加7.28 倍(单体8.09 倍、二聚体7.53 倍、三聚体4.66 倍),OPC含量增加(5.42f0.56)倍,体外抗氧化活性DPPH、FRAP、ABTS分别提高3.22、4.13、2.84 倍。
