杨梅素与G-β-CD的包合作用及抗氧化性分析
2020-03-11王轶博符晓芳辛婷婷
王轶博,符晓芳,袁 丽,张 婷,辛婷婷
(北京工商大学理学院,北京 100048)
杨梅素(3,5,7,3’,4’,5’-六羟基黄酮,图1a)是一种天然黄酮类化合物,广泛分布于茶、水果、草药等中[1]。作为一种多羟基黄酮,杨梅素具有良好的抗氧化性[2]、消除体内自由基等特性,以及降血糖、抗炎、抗肿瘤[3-6]等生物学活性。这些性质除对生物医学领域意义重大外,在食品工业方面也十分重要,可作为食品抗氧化剂和功能补充剂。利用杨梅素的抗氧化特性,可以避免果蔬在贮存过程中,其结构中的酚类物质被氧化成黑色素而影响果蔬的外观及营养、缩短果蔬的货架期。因此可将其用作良好的果蔬保鲜和防腐剂。由于杨梅素具有较低的水溶性(溶解度为16.60 μg/mL)[7],阻碍了其在食品工业领域的应用。通过合适的载体包裹提高溶解性及利用度是常用的解决方法。
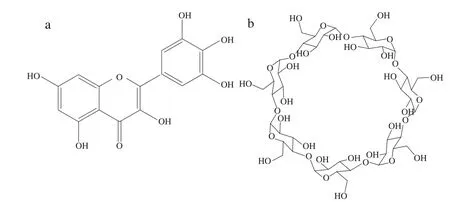
图1 杨梅素(a)及β-环糊精(b)结构Fig. 1 Structures of myricetin (a) and β-cyclodextrin (b)
环糊精是由D-吡喃葡萄糖单元以α-1,4-糖苷键结合成的一系列环状低聚糖的总称,状似中空圆台。环糊精分子外侧亲水而内侧疏水[8],利用环糊精这种性质,将疏水分子通过非共价作用包合[9],可以改变被包合物的水溶性及稳定性[10-11],拓展被包合物的实际应用。根据吡喃葡萄糖单元个数的不同,环糊精分为α-环糊精、β-环糊精(图1b)和γ-环糊精。β-环糊精相较α-环糊精和γ-环糊精而言,空腔尺寸适中,易形成包合物而被广泛研究[12],但β-环糊精自身的空腔疏水性也限制了其应用[13]。β-环糊精衍生物,如羟丙基-β-环糊精(hydroxypropyl-βcyclodextrin,HP-β-CD)和葡萄糖基-β-环糊精(glucoseβ-cyclodextrin,G-β-CD)等,通过引入修饰基团可以提高环糊精的水溶性以及结构稳定性[14]。
目前,研究人员通常以环糊精或环糊精衍生物为主体,杨梅素为客体,制备包合物并通过理论计算或实验分析研究包合物的性能[9,15-18]。Chakraborty等[9]通过分子模型和量子化学计算,探索了杨梅素在β-CD空腔中的结构和能量,从理论上分析了杨梅素与β-CD抗氧化性较好的原因。Yao Yashu等[15]制备了杨梅素/HP-β-CD,通过研究发现,小鼠体内杨梅素/HP-β-CD的生物利用度比游离的杨梅素提高了9.4 倍,因而在生物医药方面有极大的应用前景。Cho等[19]则用β-CD二聚物为主体,制备了3 种黄酮类化合物(杨梅素、槲皮素和山柰酚)的包合物。溶解性研究表明,制备出的系列包合物的溶解性相对于游离的黄酮类客体都有不同程度的提高,而杨梅素的溶解性增强了33.6 倍,比槲皮素的12.4 倍和山柰酚的10.5 倍都高。文献报道中HP-β-CD是使用最多的包合物主体,而G-β-CD则在包合物的制备过程中使用极少。相比HP-β-CD的大量研究,目前国内外对G-β-CD的研究较少。与β-CD相比,G-β-CD具有更好的亲水性和水溶性,而且具有较好的安全性、乳化性和抗回生作用,同时还可以改善食品的质构、弹性、咀嚼性等,因而在食品领域具有很高的应用价值[20]。
本研究目的是改善杨梅素的水溶性,选择具有更好安全性、水溶性和亲水性的G-β-CD为主体,通过冷冻-干燥法制备出杨梅素/G-β-CD包合物,并通过相溶解度法、红外光谱分析、X射线衍射(X-ray diffraction,XRD)、扫描电子显微镜(scanning electron microscopy,SEM)、差示扫描量热(differential scanning calorimetry,DSC)与热重(thermogravimetry,TG)等手段分析主客体相互作用,并进一步考察杨梅素/G-β-CD包合物的抗氧化能力。
1 材料与方法
1.1 材料与试剂
杨梅素(纯度≥98%) 上海源叶生物科技有限公司;G-β-CD 北京百灵威科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)上海梯希爱化成工业发展有限公司;三氯乙酸、K3Fe(CN)6、FeCl3上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
D/MAX2500V/PC XRD仪 德国布鲁克公司;Nicolet FT-IR-R330分光光度计 美国赛默飞公司;N-1100V-W(WD)旋转蒸发仪 日本东京理化器械株式会社;DTG-60AH 日本岛津公司;TESCAN VEGA II SEM仪 捷克Tescan公司。
1.3 方法
1.3.1 杨梅素/G-β-CD包合物的制备
将杨梅素(0.6 mmol/L,190 mg)溶于40 mL乙醇溶液中,389 mg 0.3 mmol/L G-β-CD溶于160 mL去离子水中,再将杨梅素-乙醇溶液缓慢滴加到G-β-CD溶液中,30 ℃磁力搅拌3 d,旋蒸除去有机溶剂后用0.45 μm的滤膜过滤,滤液冷冻干燥即可得到杨梅素/G-β-CD包合物。
1.3.2 杨梅素与G-β-CD的物理混合物
杨梅素与G-β-CD按照物质的量比1∶1称量,于研钵中充分研磨混合均匀,得到杨梅素与G-β-CD的物理混合物。
1.3.3 相溶解度的测定
配制0.01~0.03 mmol/L浓度范围(梯度间隔为0.005 mmol/L)的系列标准杨梅素乙醇溶液,检测其在378 nm波长处的吸光度,绘制杨梅素浓度与吸光度的标准曲线,拟合得到标准曲线为y=24.824x-0.000 9,R2=0.994 9,线性相关性好。配制10 mL不同浓度(0.00~0.01 mol/L)的一系列G-β-CD溶液,分别加入10 mg杨梅素,25 ℃恒温水浴条件下以120 r/min振荡48 h,用0.45 μm的滤膜过滤除去不溶物。测定滤液中杨梅素的吸光度后,根据浓度-吸光度标准曲线,得滤液中杨梅素的含量。以G-β-CD浓度为横坐标,绘制杨梅素的相溶解度曲线,并根据式(1)[21]计算包合物的缔合常数Ks。

式中:Slope为杨梅素相溶解度曲线的斜率;S0为G-β-CD浓度为0时的杨梅素溶解度。
1.3.4 抗氧化性检测
1.3.4.1 还原能力的测定
将磷酸二氢盐缓冲溶液(pH 6.6,0.2 mmol/L,2.0 mL)与K3Fe(CN)6溶液(1h10-2g/mL,2.0 mL)混合均匀后分别加入不同浓度的杨梅素/G-β-CD包合物溶液,50 ℃保温20 min后迅速冷却,再加入2.0 mL 0.1 g/mL三氯乙酸溶液。静置待分层后取上层清液,加入2.0 mL去离子水和0.4 mL 1h10-3g/mL的FeCl3溶液。充分反应后,测定样品在700 nm波长处的吸光度。不同浓度杨梅素溶液还原能力的测定处理相同。
1.3.4.2 DPPH自由基清除能力的测定
避光的条件下,将DPPH的乙醇溶液(0.1 mmol/L,2.0 mL)分别与不同浓度的杨梅素/G-β-CD包合物样品溶液混合均匀,于(30f1)℃保持60 min,检测517 nm波长处样品的吸光度。杨梅素溶液的DPPH自由基清除能力的测定方法与此一致。根据式(2)计算DPPH自由基清除能力[13]:
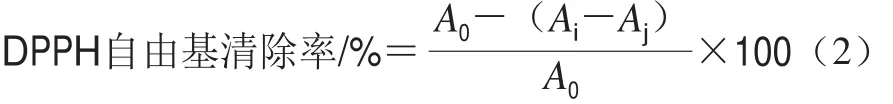
式中:A0表示DPPH溶液和样品溶剂的吸光度,Ai表示DPPH溶液和样品溶液的吸光度,Aj表示样品溶液和乙醇溶液的吸光度。
1.3.5 红外光谱分析
采用Nicolet FT-IR-R330红外光谱仪的KBr压片法,测定杨梅素、G-β-CD、杨梅素与G-β-CD以及杨梅素/G-β-CD包合物红外数据。测定前,需将以上4 种样品分别与光谱级KBr混合并充分研磨,再压制成片放到红外光路中。用OMNIC操作系统测定红外光谱,扫描范围为4 000~650 cm-1。
1.3.6 XRD分析
利用D/MAX2500V/PC XRD仪在室温下得到杨梅素、G-β-CD、杨梅素与G-β-CD以及杨梅素/G-β-CD包合物的XRD图谱。测试时采用Cu-K(α)射线照射待测样品,波长1.540 56 Å,电压40 kV,电流40 mA,以4 °/min的扫描速率在2θ为5°~50°的范围扫描。
1.3.7 SEM分析
通过TESCAN VEGA II SEM观察杨梅素、G-β-CD、杨梅素与G-β-CD以及杨梅素/G-β-CD包合物的形貌。将一小块双面胶带固定在铝短管上,将研磨后的4 种样品粉末均匀涂在短管表面,之后放入喷金仪中使待测样品具有导电性,最后用SEM观察样品形貌。
1.3.8 热稳定性分析
杨梅素、G-β-CD、杨梅素与G-β-CD以及杨梅素/G-β-CD包合物的热稳定性通过DTG-60AH仪器分析。托盘一侧放置装有样品的密封铝制小锅中,另一侧是同样密封的空锅作为参照。在70 mL/min流动氮气的氛围下,以10 ℃/min的速率将样品从50 ℃加热到500 ℃。
1.4 数据分析
统计数据使用SPSS程序软件进行分析。实验使用单因素方差分析,用Tukey测试的置信区间分析3 组平行组之间的差异。P<0.05,差异显著。
2 结果与分析
2.1 相溶解度
相溶解度是测定环糊精包合物对客体分子溶解度影响作用的常用方法。缔合常数体现主体和客体之间的键合强度,利用相溶解度法计算出的缔合常数越高,包合物越稳定[22]。由图2可知,杨梅素/G-β-CD包合物在水中的溶解度随着G-β-CD浓度的增加而增加,且表现出较好的线性相关性(R=0.982 8)。相溶解度曲线呈AL型,表明G-β-CD与杨梅素在实验条件下形成了物质的量比为1∶1的包合物[23]。通过计算得出缔合常数为8 594 L/mol,可知包合物的稳定性较好。同时,当G-β-CD浓度增大到10 mmol/L时,杨梅素的溶解度相比未加G-β-CD时增大了70.24 倍,说明杨梅素经过G-β-CD的包合,水溶性得到了显著提高。
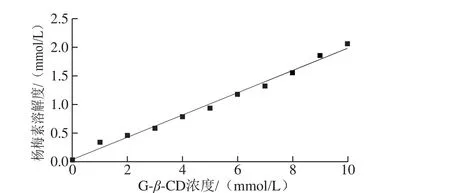
图2 杨梅素/G-β-CD的相溶解度曲线Fig. 2 Phase-solubility diagram of myricetin/G-β-CD complex
2.2 红外光谱分析
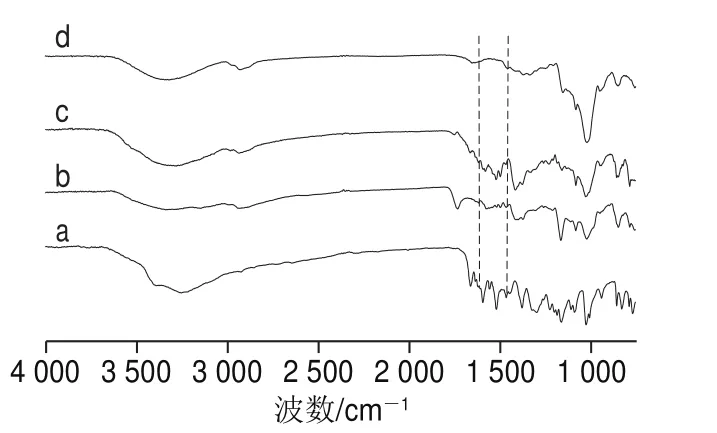
图3 杨梅素(a)、G-β-CD(b)、杨梅素与G-β-CD物理混合物(c)、杨梅素/G-β-CD包合物(d)红外光谱图Fig. 3 IR spectra of myricetin (a), G-β-CD (b), physical mixture of myricetin and G-β-CD (c), and myricetin/G-β-CD inclusion complex (d)
测定4 000~750 cm-1范围内杨梅素、G-β-CD、杨梅素与G-β-CD物理混合物、杨梅素/G-β-CD包合物的红外光谱如图3。杨梅素在3 383 cm-1处出现羟基的特征峰,1 662 cm-1出现羰基的特征峰,1 614、1 585、1 513、1 448 cm-1处是苯环骨架振动产生的峰(图3a);G-β-CD在3 344 cm-1出现羟基伸缩振动峰,2 929 cm-1出现CüH的伸缩振动峰,1 159、1 104、1 024 cm-1是CüH、CüO的伸缩振动(图3b);杨梅素与G-β-CD物理混合物的红外谱图(图3c)与杨梅素和G-β-CD的红外谱图明显不同,既包含羟基的吸收峰,又有羰基、苯环骨架的振动峰,是二者简单结合而并未发生包合作用;杨梅素/G-β-CD包合物(图3d)与杨梅素的红外吸收峰明显不同,没有杨梅素的500~1 500 cm-1之间的一些小的特征峰,图谱整体更接近G-β-CD,但包合物的羟基吸收峰明显变宽,表明羟基的数量增加,该结果表明杨梅素进入G-β-CD腔体内,并形成包合物。
2.3 XRD分析
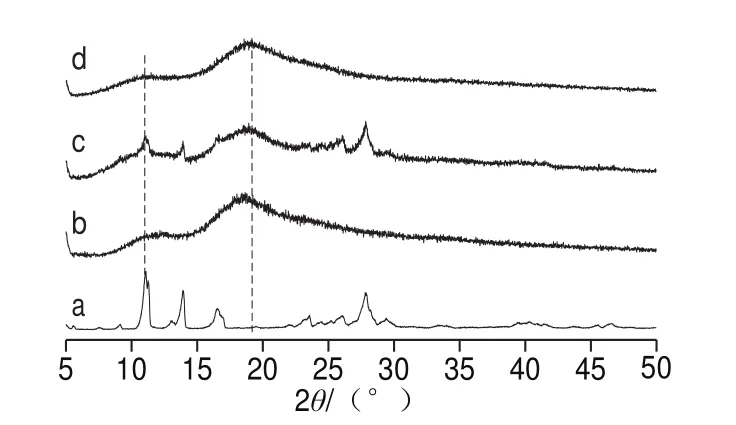
图4 杨梅素(a)、G-β-CD(b)、杨梅素与G-β-CD物理混合物(c)、杨梅素/G-β-CD包合物(d)XRD图Fig. 4 XRD diagrams of myricetin (a), G-β-CD (b), physical mixture of myricetin G-β-CD (c), and myricetin/G-β-CD inclusion complex (d)
XRD可以表征杨梅素/G-β-CD包合物中主体G-β-CD、客体杨梅素之间的相互作用。杨梅素具有明显的晶型结构(图4a);G-β-CD有2 个明显的宽峰,为无定型结构(图4b);杨梅素与G-β-CD物理混合物的XRD图显示只是主客体简单的混合叠加[24],表明两者之间没有产生化学键合(图4c);杨梅素/G-β-CD包合物中,杨梅素的晶型结构消失而出现无定型结构(图4d),表明主客体间通过化学作用成功制备出包合物[25]。
2.4 SEM分析
由图5可以看出,杨梅素的形貌呈条状;G-β-CD呈非晶球状;杨梅素与G-β-CD物理混合物中既有条状结构也有球状结构,且分离明显,表明物理混合物二者的物理形貌未发生变化;杨梅素/G-β-CD包合物则出现了稍长的非晶柱状,与主客体的形貌都不同,表明已形成了杨梅素/G-β-CD的包合物。

图5 杨梅素(a)、G-β-CD(b)、杨梅素与G-β-CD物理混合物(c)、杨梅素/G-β-CD包合物(d)SEM图Fig. 5 SEM photos of myricetin (a), G-β-CD (b), physical mixture of myricetin and G-β-CD (c), and myricetin/G-β-CD inclusion complex (d)
2.5 热稳定性分析
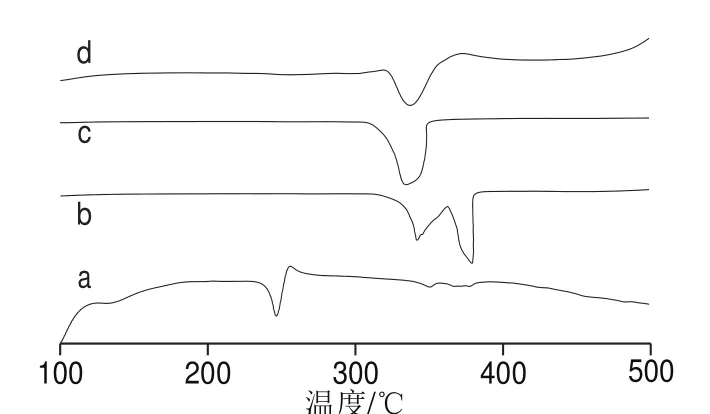
图6 杨梅素(a)、G-β-CD(b)、杨梅素与G-β-CD物理混合物(c)、杨梅素/G-β-CD包合物(d)DSC图Fig. 6 DSC diagrams of myricetin (a), G-β-CD (b), physical mixture of myricetin G-β-CD (c), and myricetin/G-β-CD inclusion complex (d)
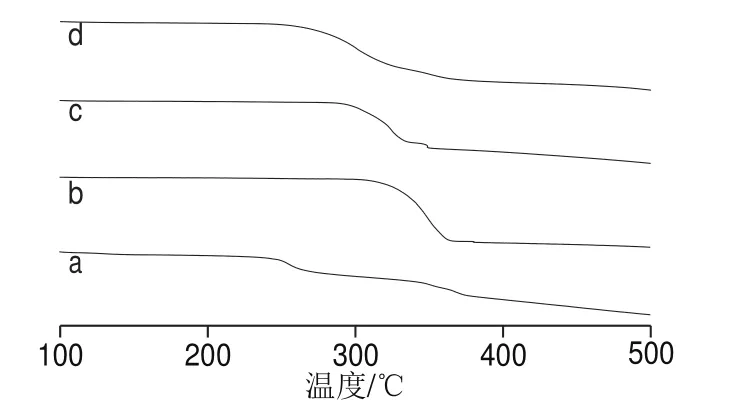
图7 杨梅素(a)、G-β-CD(b)、杨梅素与G-β-CD物理混合物(c)、杨梅素/G-β-CD包合物(d)TG图Fig. 7 TG diagrams of myricetin (a), G-β-CD (b), physical mixture of myricetin , G-β-CD (c), and myricetin/G-β-CD inclusion complex (d)
由图6可知,杨梅素在246 ℃有1 个尖的吸收峰,随后有1 个放热峰;G-β-CD在343、348 ℃有2 个吸热峰;杨梅素与G-β-CD物理混合物的DSC图是二者的结合,但其图谱近似包合物DSC图可能是由于主客体在高温熔融条件下部分形成包合物所致;杨梅素/G-β-CD图谱基本与G-β-CD的图谱类似,杨梅素的特征峰消失,表明主客体间形成缔合结构,杨梅素/G-β-CD在338 ℃出现吸热峰,相比杨梅素客体分子分解温度升高,说明经过包合作用,有效提高了客体分子的热稳定性。图6的DSC曲线与图7的TG曲线图类似,同样证明了主客体之间形成包合物,并经过包合作用有效提高了客体分子的热稳定性。
2.6 还原能力
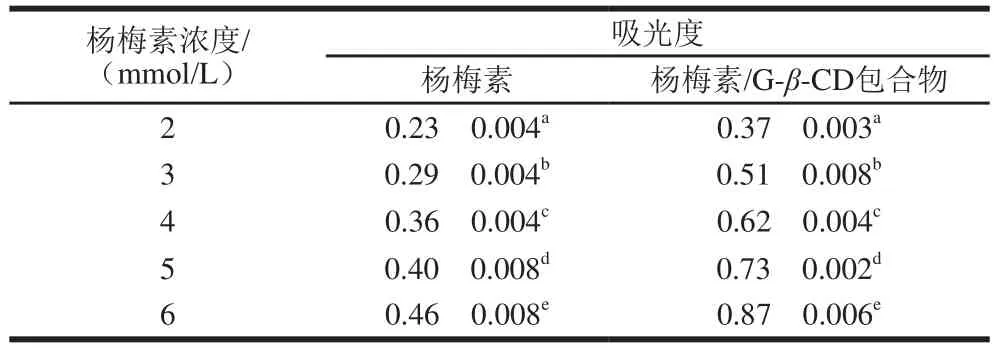
表1 杨梅素、杨梅素/G-β-CD包合物的吸光度(λ=700 nm)Table 1 Absorbance of myricetin and myricetin/G-β-CD inclusion complex (λ= 700 nm)
物质的还原能力与其抗氧化能力线性相关[26],因而可以通过测定物质的还原能力表征其抗氧化能力的强弱。利用待测物质的还原性,将铁氰化物中Fe3+还原成亚铁氰化物中Fe2+,Fe2+进一步和FeCl3反应生成在波长700 nm处有最大吸光度的普鲁士蓝,因此通过测定体系在波长700 nm的吸光度,可间接反映物质的还原能力[27]。杨梅素和杨梅素/G-β-CD包合物的吸光度越高,说明其还原能力越强。环糊精本身在波长700 nm处对入射光并不会有吸收,因而不会对包合物吸光度测定造成干扰[28]。杨梅素、杨梅素/G-β-CD包合物的吸光度与杨梅素浓度做3 组平行实验,结果见表1。随着杨梅素浓度的增加,杨梅素/G-β-CD包合物在波长700 nm处的吸光度也明显增加。当杨梅素浓度相同时,杨梅素与杨梅素/G-β-CD包合物的吸光度有明显差异,而且随着杨梅素浓度从2 mmol/L增加到6 mmol/L时,杨梅素吸光度从0.23f0.004升高到0.46f0.008,杨梅素/G-β-CD包合物的吸光度从0.37f0.003提高到0.87f0.006,二者的吸光度差异越来越大。杨梅素浓度为6 mmol/L时,杨梅素/G-β-CD的吸光度与杨梅素相比提高了89.13%,该结果说明通过包合作用,可以显著提高客体分子的还原能力。推测原因可能是包合作用提高了物质的水溶性,使其在水中分散良好,有利于与Fe3+的接触而增大了杨梅素的还原能力[29-30]。
2.7 DPPH自由基清除能力

表2 杨梅素、杨梅素/G-β-CD包合物的DPPH自由基清除率Table 2 DPPH radical scavenging capacity of myricetin and myricetin/G-β-CD inclusion complex
DPPH乙醇溶液在波长517 nm处有强的吸收峰,溶液呈紫色[31]。DPPH自由基的孤电子可以与自由基清除剂提供的电子配对,使其最大吸光度下降而褪色,而且褪色程度与其接受的电子多少相关,即自由基清除剂的清除自由基能力越强,褪色程度越高,吸光度越小。环糊精在517 nm波长处无吸收,因而不会对包合物清除DPPH自由基的分析造成干扰[26]。在杨梅素浓度为2~10 mmol/L的范围内,对杨梅素与杨梅素/G-β-CD包合物的DPPH自由基清除能力做3 组平行实验。随着杨梅素浓度增加,杨梅素/G-β-CD包合物DPPH自由基清除率随之增加。由表2可知,在相同的杨梅素浓度下,杨梅素与杨梅素/G-β-CD包合物的清除DPPH自由基能力有明显不同,且随着杨梅素浓度增加,这种差异越来越明显。在测定浓度范围内,杨梅素DPPH自由基清除率从21.75%增加到37.06%,杨梅素/G-β-CD包合物DPPH自由基清除率则从27.14%提高到77.50%,杨梅素浓度为10 mmol/L时,杨梅素/G-β-CD包合物与杨梅素相比,DPPH自由基清除率增大了109.12%,说明通过包合作用,杨梅素的DPPH自由基清除能力显著提高。推测原因可能是杨梅素被包合到环糊精腔体内后,增大了杨梅素的稳定性使其易与DPPH自由基反应[32],而且杨梅素的酚羟基与环糊精的羟基易形成分子内氢键,使包合物的羟基化程度增大而提高了包合物的抗氧化能力[33]。
3 结 论
本实验采用冷冻干燥法制备了杨梅素/G-β-CD包合物。利用XRD、红外光谱、SEM等分析方法对杨梅素/G-β-CD包合物的结构进行了表征。相溶解度法分析结果表明包合物的包合比为1∶1,缔合常数为8 594 L/mol,说明包合物稳定性好。还原能力与DPPH自由基清除能力实验表明:随着杨梅素浓度增加,杨梅素/G-β-CD包合物的还原能力与DPPH自由基清除能力增加,且测试浓度范围内的最高浓度时,与未包合前的杨梅素相比,杨梅素/G-β-CD包合物的还原能力提高了89.13%,DPPH自由基清除能力增大了109.12%。杨梅素/G-β-CD包合物具有良好的水溶性、热稳定性和抗氧化性,可作为保健食品的原料。
