活性维生素D3对UUO模型大鼠P38MAPK信号通路的影响
2020-03-11张国锐贾林杨晓萍赵瑾陶林
张国锐 贾林 杨晓萍 赵瑾 陶林
(石河子大学医学院 1第一附属医院肾病科,新疆 石河子 832000;2病理教研室)
慢性肾脏疾病(CKD)发展至终末期肾衰竭的主要病理基础和共同途径是肾间质纤维化(RIF),成纤维细胞及肌成纤维细胞(MyoF)异常增生,过量的细胞外基质(ECM),在肾间质内沉积最终导致纤维化,活性维生素D3除经典的调节钙磷代谢作用外,还具有多种其他生物学效应,CKD病人通常较正常人存在低活性维生素D3,推测活性维生素D3减少可能参与肾脏疾病的发生与发展,有研究发现其可以保护足细胞,增加肾小球肾病蛋白(Nephrin)的表达,减少尿蛋白,改善肾脏功能〔1〕。近期亦有研究发现活性维生素D3可以改善RIF,目前未明确其具体机制。本试验通过建立单侧输尿管梗阻(UUO)肾间质纤维化模型,观察活性维生素D3对P38丝裂原活化蛋白激酶(MAPK)及磷酸化(p)-P38MAPK蛋白表达的影响,探讨活性维生素D3改善RIF的机制。
1 资料和方法
1.1实验方案及模型建立
1.1.1主要实验试剂和试验动物 活性维生素D3由青岛海尔制药公司提供,以花生油为溶剂,配制浓度为0.5 μg/ml,兔抗人p-P38MAPK单克隆抗体、兔抗人P38MAPK单克隆抗体 、小鼠抗人β-action单克隆抗体(美国Cell Signaling公司);辣根过氧化物酶标记的山羊抗免疫球蛋白(Ig)G二抗(中国北京中杉金桥);Masson三色染色试剂盒(福州迈新生物工程有限公司)。4周龄清洁级健康雄性SD大鼠54只,体重(200±20)g,由新疆医科大学实验动物中心购得,石河子大学医学院中心实验室中适应性喂养1 w,室温下自然饮水、进食(石河子大学实验动物中心提供饲料)。
1.1.2大鼠模型分组 54只雄性SD大鼠,随机分为UUO模型组(模型组)、活性维生素D3干预组(干预组)、假手术组,模型组和干预组共计36只大鼠,大鼠左肾下极处游离并结扎左输尿管,建立UUO模型; 18只SD大鼠开腹后仅游离左输尿管,作为假手术组;干预组在建模起给予1 ml花生油,其中加入活性维生素D30.5 μg,每天1次灌胃,共计14 d,而假手术组、模型组每天仅给予花生油1 ml灌胃。
1.1.3标本收集 分别于术后第3、7、14天处死3组大鼠各6只,收集左侧肾脏标本。把左侧肾脏标本分成两份,一份用4%甲醛固定后制成蜡块,另一份立即用生理盐水冲洗,然后放在液氮罐中用于蛋白质的提取,蜡块由专业技师切成3 μm厚的切片,病理染色用。避免取材过程中的污染。
1.2免疫组化染色 HE染色:将切片在60℃烤箱中烤15~20 min;常规脱蜡,切片用清水冲洗水化;放入苏木素染液中染色5 min,取出用清水冲洗3 min;盐酸酒精(1%)水化15 s,再次清水冲洗1 min;将切片放入清水中,5 min蓝化;取出后切片放入伊红染液中染色2 min,然后清水冲洗;切片依次在80%酒精、90%酒精、95%酒精、无水酒精中浸泡5 min脱水;二甲苯Ⅰ、Ⅱ中各浸泡5 min;盖玻片固定,封片,晾干;
Masson染色:将切片在60℃烤箱中烤15~20 min;常规脱蜡,自来水冲洗切片水化;滴加100 μl Masson复合染色液5 min,蒸馏水冲洗;滴加100 μl磷钼酸染色5 min,甩干;滴加100 μl苯胺蓝染色,染色5 min,蒸馏水冲掉,擦干;滴加100 μl分化液,分化30~60 s;梯度酒精依次脱水5 min,然后二甲苯透明5 min;中性树胶固定,封片晾干。
光镜下观察肾小管间质损害程度并进行病理分级,石河子大学病理教研室两位专家单独观察结果。间质损害结果的判定方法: 0级(0分):无病理损害表现;Ⅰ级(1分):局部可见少量炎性细胞,轻度的肾小管扩张,未见到明显肾间质纤维化,病理损害范围< 25%;Ⅱ(2分)级:炎性细胞局灶浸润,中度肾小管扩张,可见萎缩,肾间质可见成纤维细胞弥漫分布,病理损害范围25%~49%;Ⅲ级(3分):可见大量炎性细胞,弥漫分布,重度肾小管坏死,RIF明显,肾脏病理损害范围≥50%。阳性结果判定:选高倍镜下(×400)5个小管间质视野(避开肾小球和大血管)量化染色细胞的面积和强度,算出平均值,最后结果为两位专家的结果均值。
1.3Western印迹法检测P38MAPK、p-P38MAPK表达 适量的肾组织充分研磨,置于RIPA 匀浆缓冲液中匀浆,4℃,离心力12 000 r/min,离心20 min,取上清液,聚氰基丙烯酸正丁酯(BCA)蛋白检测试剂盒测定蛋白浓度。配平后加入5×上样缓冲液,使用掌心式离心机离心30 s,混匀后将EP管置于水浴锅中,100℃,8 min煮沸;待蛋白冷却后,于-20℃冰箱中保存备用。
预制的10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶中加入适量的组织匀浆标本蛋白,电泳分离,转膜,封闭,洗涤后,用含P38MAPK及p-P38MAPK及β-actin 抗体的5%脱脂牛奶三乙醇胺缓冲盐水溶液(TBS)平衡液孵育。洗涤后,再用5% 脱脂牛奶TBS平衡液,其中含辣根过氧化酶标记二抗,孵育标本膜。再次充分洗涤后,使用电化学发光(ECL)试剂盒显影曝光;曝光后采用凝胶成像仪采图、Gel-Pro analyzer分析系统进行灰度分析。
1.4统计学方法 采用SPSS20.0软件进行单因素方差分析、t检验。
2 结 果
2.1肾脏病理损害 模型组随建模时间的延长,肾间质增宽,炎细胞的浸润范围增大,间质细胞增生明显,纤维化逐渐加重,与假手术组比较病理积分差异有统计学意义(P<0.01);干预组炎细胞浸润、纤维化程度较模型组显著减轻,病理积分差异具有统计学意义(P<0.05),见表1、图1。

表1 不同时间三组大鼠肾小管间质损害程度积分
与假手术组比较:1)P<0.01;与模型组比较:2)P<0.05;下表同

图1 肾脏免疫组化染色(×400)
2.2Western印迹法检测 与假手术组相比,模型组p-P38MAPK蛋白表达量随时间延长显著增加(P<0.01);干预组p-P38MAPK蛋白表达量较模型组显著减少(P<0.05);P38MAPK蛋白表达量各组无明显变化,差异无统计学意义(P>0.05)。见表2、表3、图2。

表2 各组不同时间p-P38MAPK蛋白表达

表3 各组不同时间P38MAPK蛋白表达
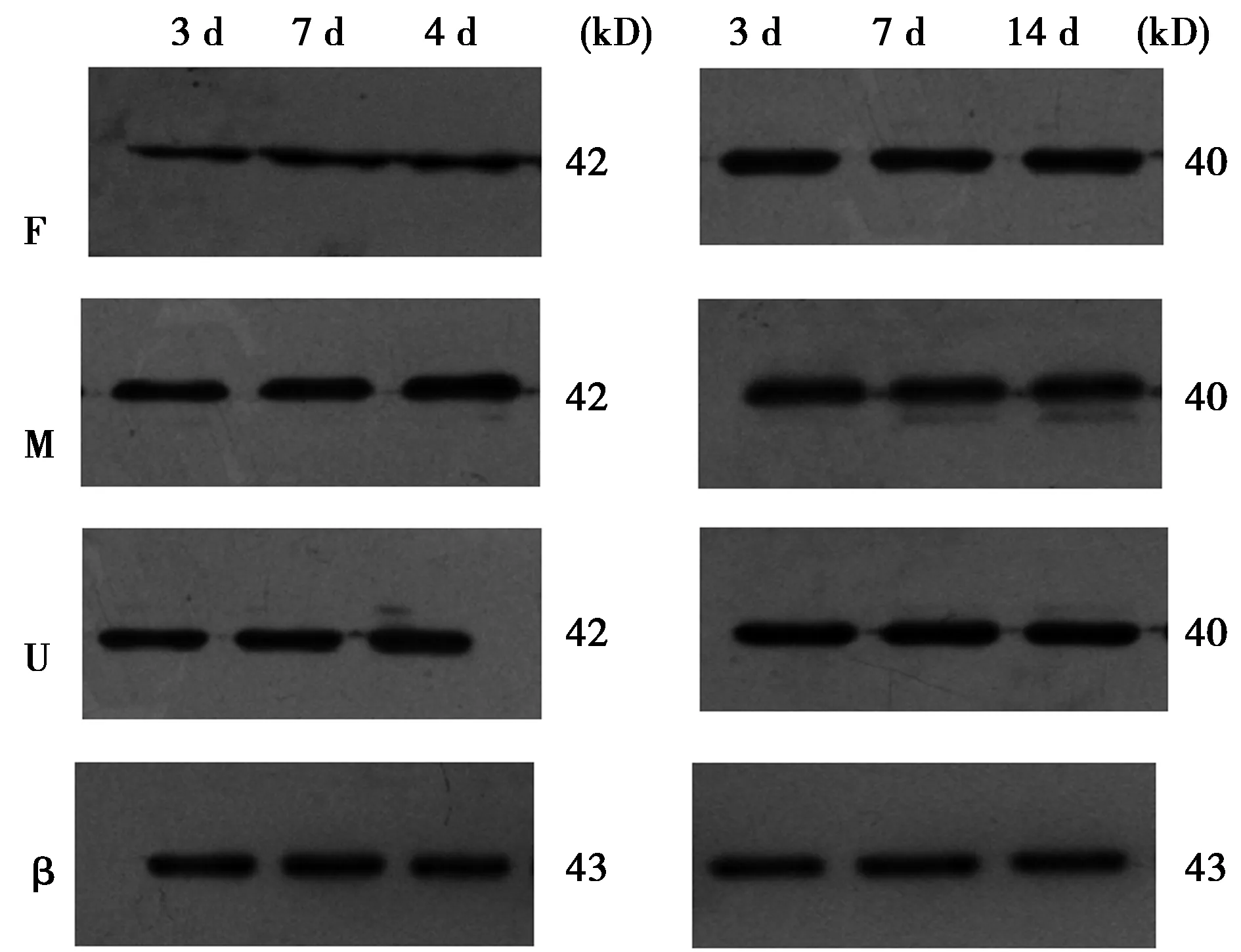
F:假手术组;M:模型组;U:干预组;β:β-actin
3 讨 论
目前应用最为广泛的研究RIF的实验动物模型是UUO模型。手术结扎单侧输尿管,肾脏积水,导致肾脏功能的改变并慢性肾脏结构的损害,因肾积水,肾血流稀疏,巨噬细胞浸润,纤维细胞增殖,进而形成瘢痕,最终导致RIF,出现肾衰竭。该模型已成熟,且相对制作简单,重复性较好,RIF发生迅速,可观察到肾脏细胞转分化过程。
1,25-二羟维生素D3〔1,25-(OH)2D3〕是体内维生素D3的活性形式,它能够调节机体免疫系统的功能,对多种细胞的增殖有抑制作用,诱导多种细胞的凋亡和分化,保护基因,对脏器有保护功能〔1〕。1,25-(OH)2D3可通过多种途径改善或延缓RIF的过程,但其机制尚不清楚〔2〕。
RIF与肾小管上皮细胞-肌成纤维细胞转分化(TEMT)过程关系密切;研究表明肾小管上皮细胞可以通过TEMT过程转变成为可以分泌ECM的MyoF,参与RIF的发生与进展;目前发现蛋白尿、TGF-β1、肝细胞生长因子(HCG)、肾组织局部肾素-血管紧张素系统(RAS)、核因子(NF)-κB等因素与RIF有关〔3,4〕。本研究前期的研究已证实整合素连接激酶(ILK)、E-钙黏素、转化生长因子(TGF)-β1等与RIF密切相关,且活性维生素D3可以通过调节ILK、E-钙黏素、TGF-β1等因子改善RIF,但是活性维生素D3改善RIF的具体机制尚不明确MAPK是真核生物细胞主要信号转导通路之一,P38MAPK属于MAPK的亚族,目前P38MAPK同型异构体已知的有6种:P38α1/α2,P38γ和P38δ,P38β1/β2,在全身组织细胞中广泛表达〔5〕。当细胞受到外界刺激后(如促炎因子、高渗、低氧、紫外线、放射线、热休克及其他应激反应)MAPK激酶 (MAPKKK)磷酸化,并将磷酸化基团向下游传递,继而MAPK激酶(MAPKK),活化的MAPKK通过P-MAPK的苏氨酸(T)和酪氨酸(Y)位点,活化MAPK,将细胞外刺激信号传递给胞核〔6〕;有学者证实:P38MAPK活化可以加速TEMT进程〔6〕,本研究团队前期研究已在人类肾小管上皮细胞中证实高糖可促进P38MAPK活化,增加p-P38MAPK蛋白表达,促进TEMT进程,而QLT0267可抑制P38MAPK的活化,减少磷酸化P38MAPK蛋白表达,延缓TEMT进程〔7〕。
本研究结果与前期动物模型试验结果一致;Western印迹法观察P38MAPK及p-P38MAPK蛋白表达量显示:UUO模型组在第3天既出现磷酸化P38MAPK蛋白表达增加,并随时间的延长、肾间质病理损害程度的加重而表达增加,磷酸化P38MAPK蛋白的表达与病理积分呈正相关,分析其原因可能是UUO模型建立以后,随着梗阻时间延续,炎细胞浸润明显,炎症介质的释放增加,磷酸化P38MAPK蛋白表达开始增加〔8〕,而P38MAPK的活化可以促进TEMT〔6〕,加速RIF的发生,这与Luo等〔9〕的研究一致;本研究结果提示:活性维生素D3干预后P38MAPK活化受到抑制,磷酸化P38MAPK蛋白水平降低,分析可能原因:①活性维生素D3可抑制UUO模型肾脏炎症反应,从而减轻P38MAPK的激活。②ILK是MAPKs家族上游蛋白,本研究团队前期试验已证明活性维生素D3可抑制UUO大鼠模型肾组织中ILK的表达,而ILK作为P38MAPK的上游信号分子,P38MAPK活化受到抑制可能与ILK表达下调有关。
综上,活性维生素D3可以间接或直接下调UUO大鼠肾组织p-P38MAPK蛋白水平,抑制P38MAPK的活化,延缓EMT发生,从而减轻RIF而保护肾脏功能,为防治RIF提供了新的研究方向和治疗靶点,本团队将会继续就活性维生素D3对TEMT及RIF保护作用做进一步研究。
