甘肃贝母种子水提取液对小白菜的化感效应
2020-03-11许美玲郭凤霞
许美玲 郭凤霞 陈 垣 武 睿
(1甘肃农业大学,生命科学技术学院,农学院/甘肃省作物遗传改良与种质创新重点实验室/甘肃省中药材规范化生产技术创新重点实验室/甘肃省药用植物栽培育种工程研究中心/甘肃省干旱生境作物学重点实验室,甘肃兰州 730070;2 甘肃省特色药用植物资源保护与利用工程实验室/甘肃省特色药材规范化可追溯栽培工程技术研究中心/甘肃中天药业有限责任公司,甘肃定西 748100)
甘肃贝母(Fritillaria przewalskiiMaxim.)系被子植物百合科贝母属多年生草本药用植物,是药材川贝母的主要基原植物之一,也是我国名贵的野生药材,干燥鳞茎入药,俗称“岷贝”,具有清热润肺、化痰止咳、散结消痈等多种功效,主治肺热燥咳、干咳少痰、阴虚劳嗽等症[1-3]。甘肃贝母是贝母属中药用价值最高的一个类群,现已被广泛应用于多种复方中成药和注射针剂[4],但由于甘肃贝母野生种群自然更新速度缓慢,生长期4年,产量很低,加之过度采挖、环境恶化等,药材蕴藏量锐减,人工栽培难度又较大,已处于濒危状态,被《中国珍稀濒危植物名录》列为国家三级保护植物[5-7]。
甘肃贝母种子繁殖系数高,具有不伤害药用部位的特点,是生产上快速解决甘肃贝母供应困难的有效途径[8]。然而,甘肃贝母种子是具有后熟特性的原胚型种子,蒴果充分成熟后种子尚无完整的胚结构,仅具胚乳状的内含物,需要经过完全的后熟过程才能吸胀发芽,属于形态生理双重休眠类型[9-10]。种子打破休眠对植物生长发育至关重要,由种子萌发内源抑制物即化感物质引起的休眠是最常见的种子休眠类型之一[11-14]。因此,进一步探究甘肃贝母种子的后熟休眠机理及打破休眠促进萌发的途径,对其规范化生产具有重要意义。
植物化感作用(allelopathy)包括自毒、自促、化感偏害和互惠作用,是自然界中普遍存在的现象[15]。马令法等[16]研究表明,不同浓度青稞秸秆水浸提液对甘肃贝母种子发芽具有影响,适当把握秸秆还田量,可以降低化感作用对甘肃贝母发芽的抑制。李志亮等[17]采用伊贝母种子浸液对小麦生长化感效应研究,证实其种子内存在某类抑制物质,且对其本身后熟过程和萌发存在抑制作用,并提出种子处理的方法。化感物质是化感作用的媒介,主要是植物的次生代谢物质通过抑制种胚生长、破坏种子亚细胞结构、植物激素及活性氧的代谢平衡,从而对种子萌发产生影响[18]。
甘肃贝母等川贝母种子具有严格的后熟和休眠特性,郭凤霞等[19]研究揭示了甘肃贝母种子的灌浆特性,常彦莉等[9]研究了经后熟的甘肃贝母种子的吸水发芽特性,这些研究解决了野生甘肃贝母抚育和驯化栽培的关键技术,但至今对甘肃贝母种子后熟过程中是否存在内源萌发抑制物质及其活性的消长规律等鲜见相关报道。因此,本试验通过对甘肃贝母种子不同后熟阶段内源化感抑制物质的提取和生物活性测定,旨在揭示其种子内是否存在此类物质以及抑制活性的强弱,从而确定种子休眠的主要原因,为进一步探明甘肃贝母种子中内源抑制物质的种类特性及后熟脱休眠机理奠定基础,为生产实践中打破其种子休眠提供理论支撑,促进濒危药用植物甘肃贝母种质资源的可持续化利用。
1 材料与方法
1.1 供试材料
供试甘肃贝母种子于2017 年7 月采集于野生甘肃贝母,采集地点为甘肃省漳县金钟镇大庄村,经甘肃农业大学药用植物资源与鉴定实验室鉴定。将甘肃贝母植株采摘后带回实验室,将种子从果实中搓揉下来,25℃蒸馏水清洗之后,用多菌灵1 000 倍液消毒,再用无菌水洗净,参考常彦莉等[9]的方法进行后熟处理。
受体材料为小白菜品种北京60,其种子纯度≥96.0%、净度≥98.0%、发芽率≥85%、含水量≤7.0%,购自兰州蔬菜种子供应站。
1.2 不同后熟阶段甘肃贝母种子水提取液的制备
在甘肃贝母后熟过程中,取形态和生理后熟两个阶段甘肃贝母种子,洗去表面沙粒后用滤纸吸干表面水分,备用。水提取液的制备参考郑景瑶等[20]的方法。称取10.0 g 种子于研钵中,经液氮冷冻后研磨,置于500 mL 烧杯中,按1∶25(m/v)的比例用蒸馏水提取,40 Hz 超声提取30 min 后,用保鲜膜封口并在室温(20~25℃)下静置浸泡24 h。粗提液进行二重过滤后,获得40 mg·mL-1的母液,储存于4℃低温冰箱中,用于小白菜种子发芽试验。使用前参考郑景瑶等[20]的方法,进行提取液浓度梯度的稀释准备。在上述甘肃贝母种子提取液母液基础上,分别吸取部分母液加蒸馏水依次稀释成0、2.5、5.0、10.0、20.0 和40.0 mg·mL-15 个质量浓度的水提取液用于小白菜种子发芽试验。
1.3 化感作用的生物活性测定
参照郭凤霞等[21]的方法。选取颗粒饱满、大小一致的小白菜种子900 粒,分成6 组,每组150 粒,3 次重复,每重复50 粒。采用培养皿(直径9 cm)双层滤纸法,各处理以6.0 mL 对应质量浓度的上述甘肃贝母种子提取液浸湿进行发芽试验,对照组(CK)加等量蒸馏水浸湿。发芽试验采用完全随机区组设计,在25℃GTOP-260Y 型恒温培养箱(浙江托普仪器有限公司)中进行,每天定时更换3.0 mL 对应提取液,从第2 天开始每天记录小白菜种子的萌发情况,直至发芽结束(连续3 d 不再发芽)。按照公式计算发芽率(germination ratio,GR)、发芽势(germination energy,GE)、发芽指数(germination index,GI)、发芽活力指数(vigor index,Ⅵ)[9,22]:

式中,Gt为第t天的发芽种子数,Dt为相应发芽天数,发芽种子的判定标准为小白菜胚根突破种皮,且伸长长度达到种子直径的1/2 为标准。
发芽结束,从各处理培养皿中随机抽样10 株小白菜幼苗,用吸水纸吸干表面水分,用游标卡尺(0.01 mm)测定苗高、幼根长、幼根直径,用电子天平(0.000 1 g)称量单苗鲜重。
采用DDS-11A 型电导率仪(上海雷磁仪器厂)测定电导率。取各浓度水提取液处理下生长一致的小白菜幼苗,去离子水冲洗干净,用滤纸吸干表面残留水分后,置于试管中,加入4 mL 去离子水,真空抽气20 min后,立即测定初始电导率d1,然后将试管加盖放入沸水浴中加热20 min,放至室温后再测定浸出液电导率d2[23]。按照公式计算相对电导率(d3):

采用化感效应指数(response index,RI)度量化感作用的类型和强度[24]。综合化感效应指数(comprehensive response index)是指同一处理下供体植物对同一受体植物各测试项目RI 的算术平均值,能反映化感效应的强弱[25]。按照公式计算RI:
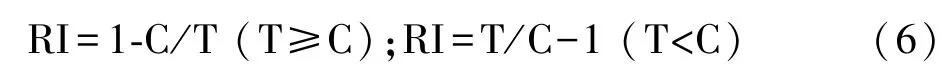
式中,C 为各指标对照值,T 为各指标处理值。RI>0 为促进作用,RI<0 为抑制作用,设定对照的RI 值为0,绝对值的大小与化感作用强度一致。
1.4 数据处理
采用Microsoft Office Excel 2010 制图,SPSS 19.0统计软件进行方差分析,试验数据均以平均值±标准差表示。处理间多重比较采用Duncan 法。
2 结果与分析
2.1 不同阶段甘肃贝母种子水提取液对小白菜种子萌发进程的影响
由图1 可知,不同后熟阶段甘肃贝母种子不同浓度水提取液对小白菜种子萌发进程和终发芽率均具有显著影响(P<0.05),其影响趋势在不同阶段表现不一致。在不同浓度甘肃贝母种子水提取液条件下,小白菜种子均从着床后第2 天开始萌发,第8 天发芽全部结束,发芽持续7 d。发芽初期(第1~第4 天),一定浓度的水提取液对小白菜种子萌发有影响,而从第5 天开始,各处理种子发芽率达到平衡,并持续到发芽终期,其中,形态后熟阶段40 mg·mL-1和生理后熟阶段10 mg·mL-1的处理对小白菜种子终发芽率具有显著影响(P<0.05)。
形态后熟阶段甘肃贝母种子水提取液中,CK、2.5、5、10、20 mg·mL-1各处理组种子的发芽率在发芽第1 天分别达到73.3%、69.3%、65.3%、66.7%、63.3%,当水提取液浓度达到40 mg·mL-1时,小白菜种子的萌发进程较CK 明显后延(图1-A)。小白菜种子的发芽速率随着甘肃贝母水提取液浓度的升高而呈现逐渐减缓的趋势,且水提取液浓度越高对萌发速度的影响越大。而生理后熟阶段各浓度水提取液处理对小白菜种子萌发的影响未表现出通常化感作用所具有的促进或抑制作用规律,而是单一的促进作用,0~5 mg·mL-1是一个作用区间,10~40 mg·mL-1是另一个作用区间,当水提取液浓度为10 mg·mL-1时,小白菜种子发芽率在整个萌发过程中持续低于CK(图1-B)。在发芽第2 天,CK、2.5、5 mg·mL-1处理组种子的发芽率分别达到80%、77.3%、80%,浓度效应不明显,而10、20、40 mg·mL-1处理组种子的发芽率分别达到58%、76.7%、82%,其中以40 mg·mL-1处理的促进作用更明显,表明此阶段水提取液中含有能够促进小白菜种子萌发的物质,并且需要水提取液浓度大于40 mg·mL-1,才可产生正向的生理效应。
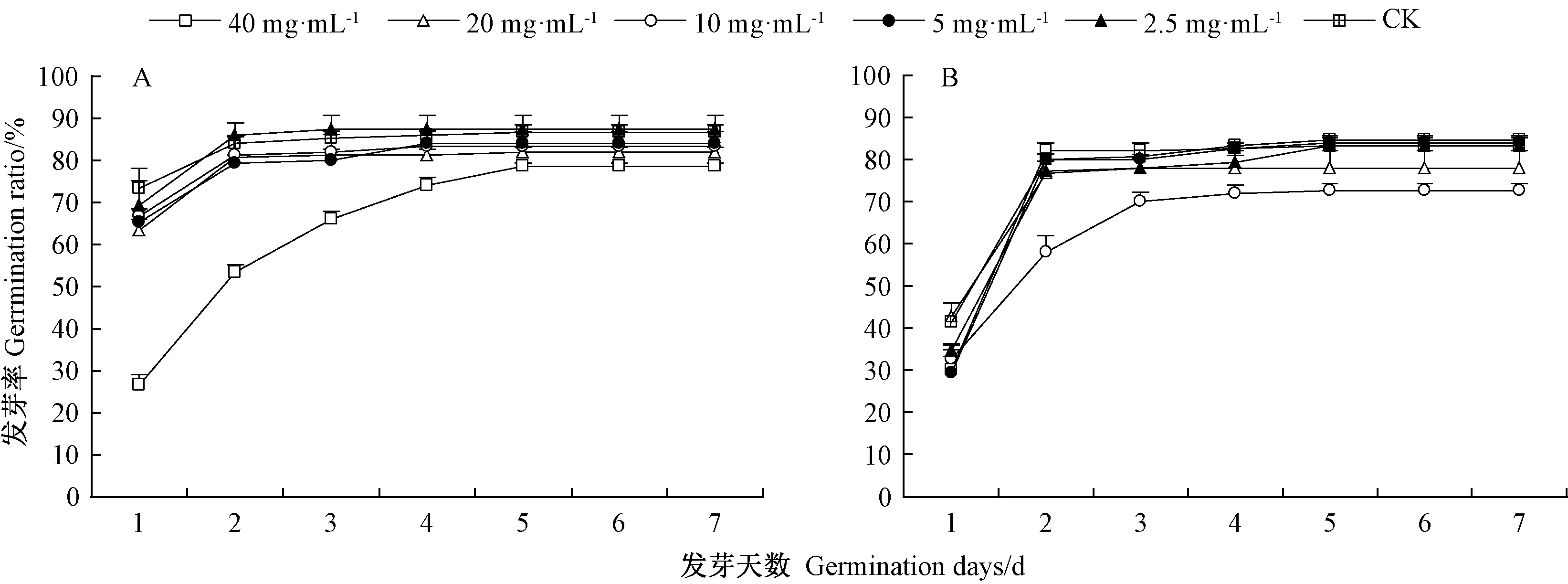
图1 不同后熟阶段甘肃贝母种子水提取液对小白菜种子萌发进程的影响Fig.1 Effects of aqueous extracts from different after-ripening stages of F.przewalskii on seeds germination process of B.chinensis
2.2 不同阶段甘肃贝母种子水提取液对小白菜种子发芽特性的影响
由表1 可知,形态后熟与生理后熟阶段甘肃贝母种子水提取液对小白菜种子发芽的作用有所差异,在两个阶段中其变化趋势不同,对发芽活力指数影响最明显。在形态后熟阶段,小白菜种子的发芽率和发芽势均随着甘肃贝母种子水提取液浓度的增大呈现低浓度促进高浓度抑制的双重作用,但对其发芽指数和发芽活力指数均表现单一的抑制作用。当水提取液浓度为2.5 mg·mL-1时,种子发芽率和发芽势均达到最大值,较CK 分别提高了0.76%、2.38%,对应RI 值分别为0.008、0.023,显著高于40 mg·mL-1处理组(P<0.05)。当水提取液浓度大于2.5 mg·mL-1时,对小白菜种子萌发开始表现出抑制作用(RI<0),其发芽率和发芽势均随着水提取液浓度增大而逐渐降低,与CK相比,5、10、20、40 mg·mL-1处理组小白菜种子发芽率分别降低3.08%、3.85%、5.39%、9.23%,发芽势分别降低5.56%、3.18%、3.96%、36.51%,抑制作用与其浓度呈正比。不同浓度甘肃贝母种子水提取液对小白菜种子发芽指数及活力指数均表现为抑制作用(RI<0),且各处理的发芽活力指数与CK 之间均达到差异显著水平(P<0.05)。当水提取液浓度升至40 mg·mL-1时,小白菜种子的化感抑制作用最强,发芽率、发芽势、发芽指数以及发芽活力指数均较CK 显著降低9.23%、36.51%、40.60%、85.96%(P<0.05),RI值分别为-0.102、-0.575、-0.684、-6.124。
在生理后熟阶段中,小白菜种子的发芽特性均异于形态后熟阶段。不同浓度水提取液处理对小白菜种子发芽率和发芽指数均表现出抑制作用(RI<0),发芽率从高到低依次为CK>5 mg·mL-1>40 mg·mL-1>2.5 mg·mL-1>20 mg·mL-1>10 mg·mL-1,发芽指数为CK>20 mg·mL-1>2.5 mg·mL-1>40 mg·mL-1>5 mg·mL-1>10 mg·mL-1,但随着水提取液浓度的增大,处于0 ~5 mg·mL-1阶段时,对小白菜种子发芽率和发芽指数均表现为抑制作用,在10 mg·mL-1时,对其各发芽指标抑制作用均达到最强,10~40 mg·mL-1时,各项发芽指标的抑制作用逐渐减弱。水提取液浓度为5 mg·mL-1时,小白菜种子发芽活力指数为117.04,高于CK,RI值为0.084,当水提取液浓度增加至10 mg·mL-1时,对小白菜种子发芽率、发芽势、发芽指数和发芽活力指数的抑制作用均达到最大,与CK 相比分别降低19.69%、27.50%、19.18%、12.01%,其RI 值分别为-0.245、-0.379、-0.237、-0.137。生理后熟阶段水提取液对小白菜种子发芽率虽均表现为抑制作用(RI<0),但水提取液浓度超过10 mg·mL-1后浓度梯度效应表现明显,种子发芽率和发芽势均随着水提取液浓度增大而逐渐升高,不同浓度水提取液处理的小白菜种子发芽率与CK 之间差距逐渐缩小,分别为19.69%、7.88%、1.58%;当水提液浓度为20 mg·mL-1时,虽然对小白菜种子发芽率、发芽势和发芽指数均有抑制,但是显著提高了其发芽活力指数。同时,除10 mg·mL-1处理组的发芽率、发芽势和发芽指数以及20 mg·mL-1和40 mg·mL-1处理组的发芽活力指数与CK 相比达到差异显著水平(P<0.05)外,其余指标与CK 均无显著差异。
由各指标的RI 值可知,不同萌发指标对甘肃贝母化感效应的影响大小不同。形态后熟阶段,每个处理RI 值均为发芽指数>发芽活力指数,由此可见,发芽活力指数对此阶段甘肃贝母水提取液的化感效应最敏感,发芽指数次之。生理后熟阶段,当水提液浓度低于10 mg·mL-1时,发芽指数表现最敏感;水提液浓度为10 mg·mL-1时,发芽势敏感作用最强;水提液浓度为10~40 mg·mL-1时,发芽活力指数对化感作用最敏感,说明水提液浓度大于10 mg·mL-1,主要影响小白菜种子的生长量。
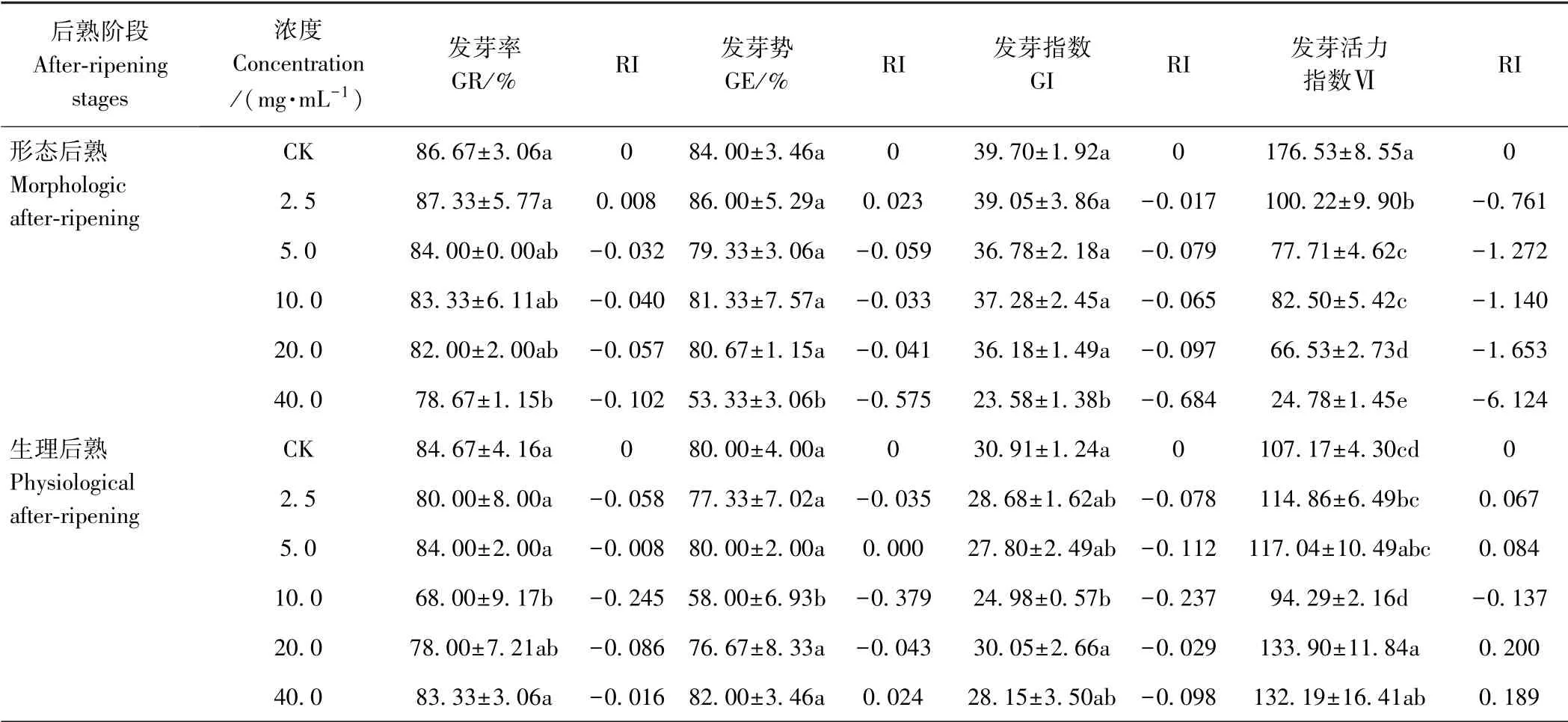
表1 不同后熟阶段甘肃贝母种子水提取液对小白菜种子萌发的影响Table 1 Effects of aqueous extracts from different after-ripening stages of F.przewalskii on seeds germination of B.chinensis
2.3 不同阶段甘肃贝母种子水提取液对小白菜幼苗生长发育的影响
不同阶段甘肃贝母种子水提取液对小白菜幼苗生长发育也具有不同影响,影响趋势在两个阶段中表现不一致。由表2 可知,发芽结束后,不同阶段甘肃贝母种子的水提取液对小白菜幼苗生长发育具有不同程度的影响。其中,形态后熟阶段水提取液对小白菜幼苗生长有明显的影响,整体表现为抑制作用(RI<0)。水提取液浓度为2.5 mg·mL-1时,对小白菜幼苗根直径的抑制作用未达到显著水平,而在其他浓度水提取液处理下,幼苗(10 株)平均苗高、根长、根直径和单苗鲜重与CK 相比均达到差异显著水平(P<0.05),且随着水提取液浓度的增高,对小白菜幼苗生长发育各项指标的抑制作用逐渐增强,40 mg·mL-1水提取液对小白菜种子抑制作用均达到最大(P<0.05),平均苗高、根长、根直径和单苗鲜重分别较CK 显著降低46.27%、76.40%、36.92%、20.48%,对应的 RI值分别为-0.861、-3.238、-0.585、-0.258。生理后熟阶段不同浓度水提取液对小白菜幼苗生长总体表现为促进作用(RI>0),但对根长影响不显著(P>0.05)。当水提取液浓度为2.5 mg·mL-1时,对小白菜幼苗苗高、根长、单苗鲜重影响不显著,但对其根直径有显著的促进作用(P<0.05);当浓度为5 mg·mL-1时,对幼苗苗高、根直径、单苗鲜重的促进作用均达到显著水平(P<0.05),各生长指标较CK 分别增加22.84%、35.14%、48.50%;而当水提取液浓度为40 mg·mL-1时,对幼苗根直径和单苗鲜重的促进作用最大,较CK 分别显著增加了70.27%、83.08%(P<0.05)。
由各指标的RI 值可知,不同生长指标受甘肃贝母化感效应的影响程度不同。形态后熟阶段根长受影响最大,对甘肃贝母化感作用更敏感。而生理后熟阶段,当水提取液浓度高于2.5 mg·mL-1时,单苗鲜重对化感作用最敏感。
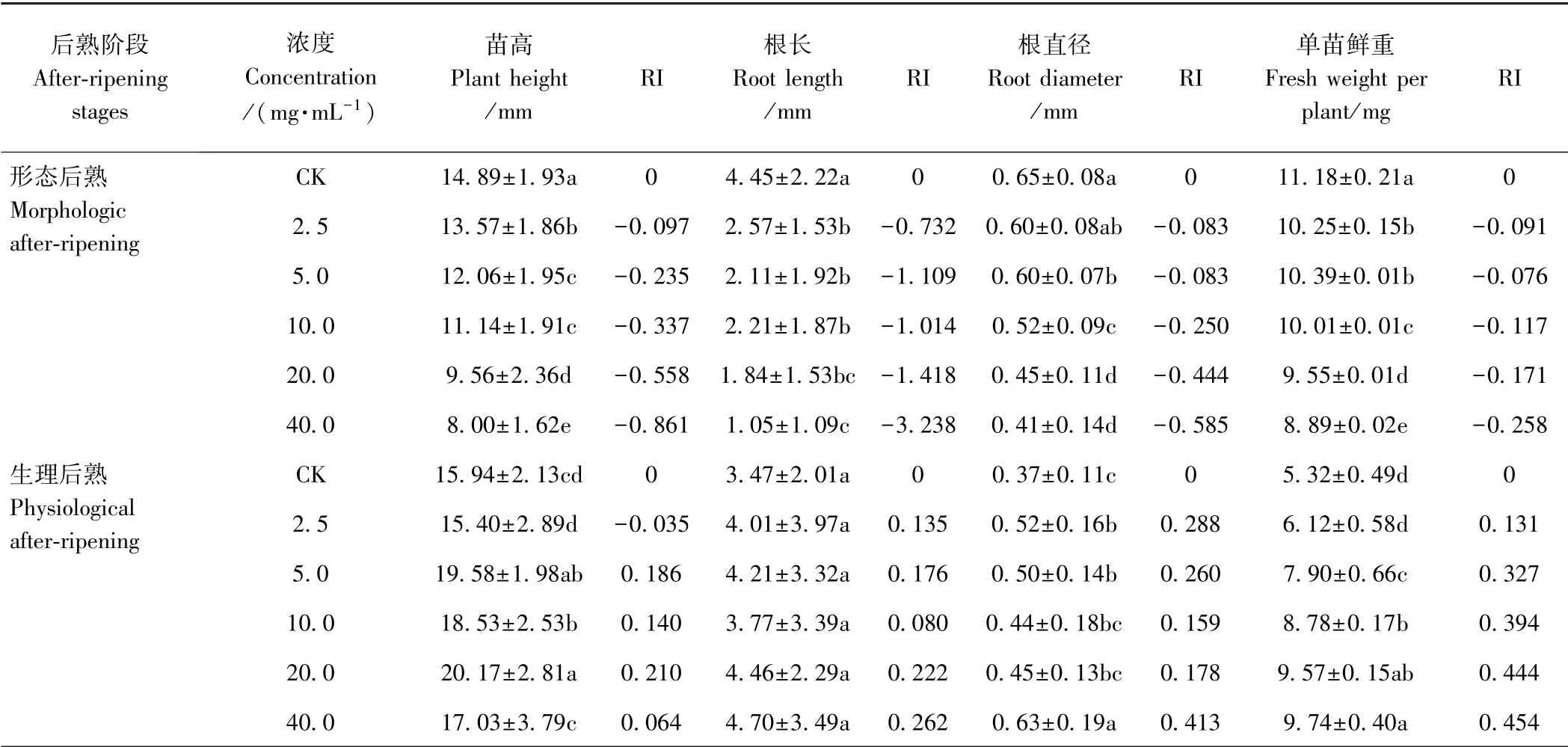
表2 不同后熟阶段甘肃贝母种子水提取液对小白菜幼苗生长的影响Table 2 Effects of aqueous extracts from different after-ripening stages of F.przewalskii on plant growth of B.chinensis
2.4 甘肃贝母种子不同阶段水提取液对小白菜幼苗电导率的影响
电导率可以很好地反映植物细胞的稳定程度。由表3 可知,不同阶段各浓度的甘肃贝母种子水提取液对小白菜幼苗的电导率表现出差异性。形态后熟阶段,随着甘肃贝母种子水提取液浓度的增大,小白菜幼苗浸出液电导率(d2)呈升高趋势,与CK 相比,2.5、5、10、20、40 mg·mL-1处理组d2分别增加8.80%、2.56%、3.86%、11.58%、25.27%,且水提取液浓度为40 mg·mL-1时与CK 间差异达到显著水平(P<0.05),而初始电导率(d1)和相对电导率(d3)并无明显的变化规律性。而生理后熟阶段,不同浓度甘肃贝母种子水提取液处理小白菜幼苗后,其初始电导率、浸出液电导率及相对电导率与CK 相比均未达到显著水平(P>0.05)。
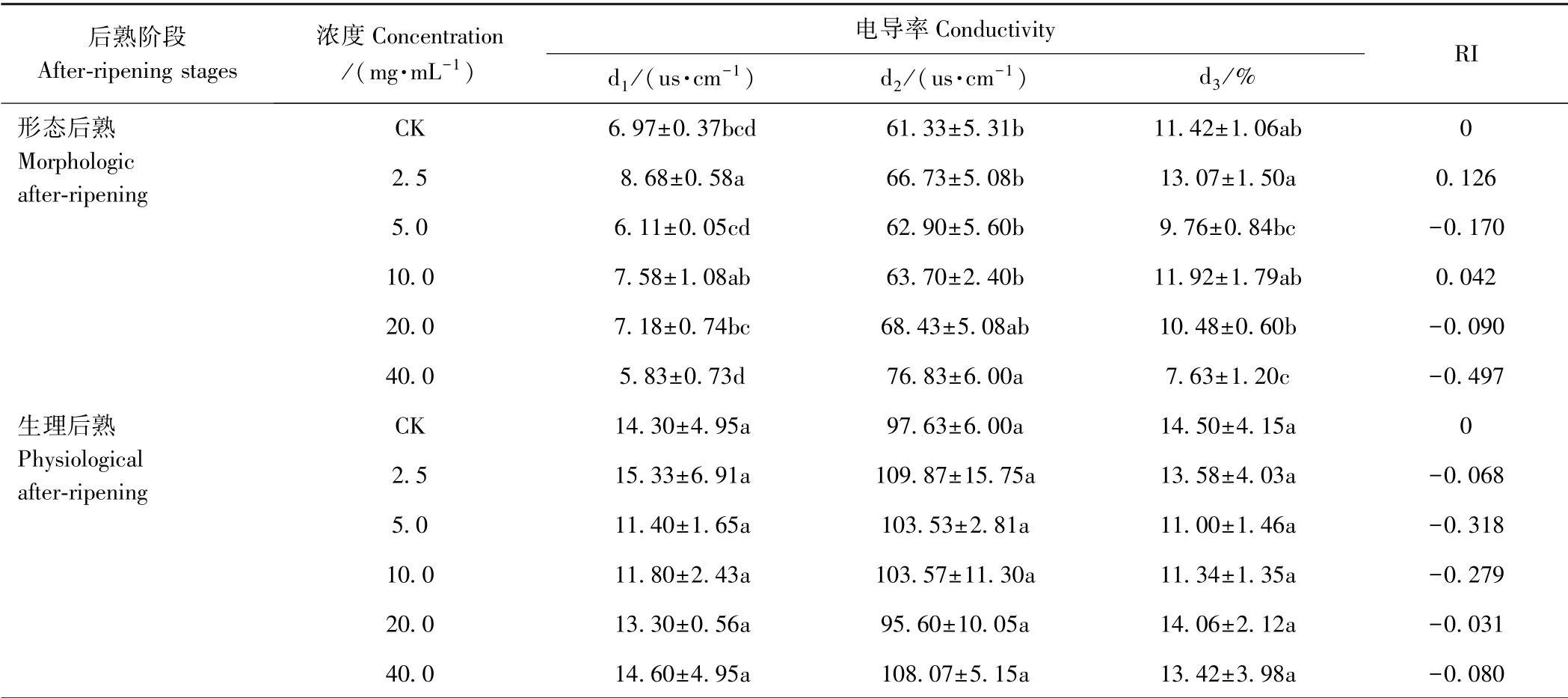
表3 不同后熟阶段甘肃贝母种子水提取液对小白菜幼苗电导率的影响Table 3 Effects of aqueous extracts from different after-ripening stages of F.przewalskii on the conductivity of B.chinensis
2.5 综合化感效应分析
由表4 可知,不同阶段甘肃贝母种子水提取液对小白菜萌发特性、幼苗形态与电导率指标的综合化感效应表现不同,影响程度因阶段不同而异。形态后熟阶段,不同浓度水提取液对小白菜发芽大体表现为抑制作用,且其抑制作用随着水提取液浓度的增大而逐渐增强。水提取液对小白菜种子发芽率、发芽势、发芽指数及发芽活力指数的抑制效应强度分别为0.045、0.135、0.188、2.190,即对发芽活力指数的化感抑制效应最大,表明此阶段中化感物质对小白菜种子萌发率的影响较小,而对种子萌发速度和生长量的影响较大。幼苗形态中根长对此阶段水提取液的综合化感效应响应表现得最为敏感,综合化感效应指数为-1.502,其次为苗高、根直径和单株鲜重。相对电导率的综合化感效应指数为-0.118,其敏感程度最低。生理后熟阶段,不同浓度水提取液对小白菜种子的终发芽率虽有抑制作用(RI<0),但当水提取液浓度>10 mg·mL-1时,其对发芽率和发芽势的抑制作用强度随着水提取液浓度的增大不断降低。小白菜种子萌发特性各指标不同浓度的综合化感效应指数为-0.050,幼苗形态与电导率指标的综合化感效应指数为0.148,而在形态后熟阶段,其综合化感效应指数分别为-0.640、-0.494。总体来看,水提液浓度为2.5、5、10、20、40 mg·mL-1的形态后熟阶段水提取液化感抑制作用强度均大于同等浓度的生理后熟阶段水提取液。
3 讨论
种子打破休眠进而萌发是一个非常复杂的过程,由许多内部和外部因素自发地进行调节,共同控制[26]。其中导致种子萌发率低的原因有很多,如机械障碍[27]、激素平衡以及种子后熟特性[28]、内源抑制物[29]等。诸多研究发现,种子内源抑制物即化感物质是导致种子休眠的主要原因,化感物质可促进或抑制不同物种种子的萌发,对植物的生长发育有着重要的影响[30-31]。药用植物普遍存在化感作用,如中药材种子滇重楼[32]、蒙古黄芪[21]、玉铃花[33]等均是由于种子内存在内源化感抑制物质,从而导致其难以萌发。研究发现,化感作用存在浓度梯度效应,一般表现为低促高抑,即当提取液浓度达到一定“阈值”时才表现出抑制作用,浓度越大,抑制作用越明显[34-35]。本研究结果表明,药用植物甘肃贝母种子中的内源化感抑制物质,在不同后熟阶段表现出不同程度的化感效应,两个阶段甘肃贝母种子不同浓度水提取液对小白菜种子萌发进程、萌发特性的综合化感敏感程度表现为形态后熟>生理后熟,其中在形态后熟阶段,抑制效应随着水提取液浓度增大,呈现先减弱后增强的趋势,而生理后熟阶段水提取液虽然抑制了小白菜种子的萌发,但当水提取液浓度为10 mg·mL-1时达到最低,超过10 mg·mL-1时,对发芽率和发芽势的抑制作用逐渐降低。说明不同后熟阶段,其种子所含的抑制物质含量不同,对小白菜种子呈现的抑制效果有所差异,有些抑制物质在浓度较低时反而会出现促进作用。一般认为生理后熟的过程即是萌发促进物质含量与抑制物质含量比值增大的过程[36]。
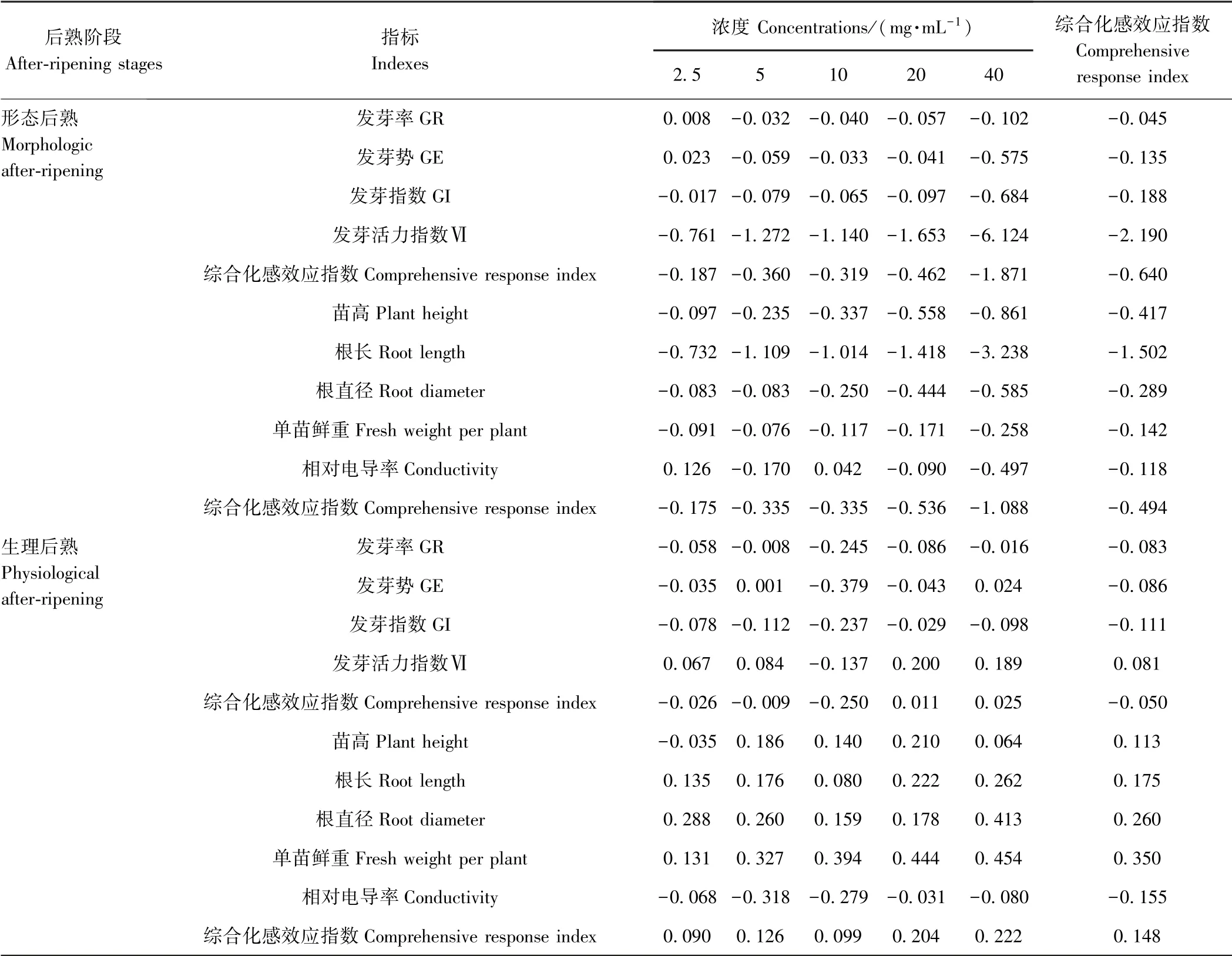
表4 不同后熟阶段甘肃贝母种子水提取液对小白菜种子萌发与幼苗生长的化感效应Table 4 Allelopthic effects of aqueous extracts from different after-ripening stages of F.przewalskii on seeds germination and seedling growth of B.chinensis
植物化感抑制物质对种子的影响不仅表现在萌发特性上,对种子生长发育表现更为突出[37]。郭凤霞等[21]研究发现,蒙古黄芪种子不同时间水浸提液对党参种子幼苗生长均具有极显著影响,且影响趋势在2个党参种中表现基本一致,即随着浸提时间延长,对不同党参萌发及幼根促进作用逐渐减弱而抑制作用逐渐增强。李彩琴等[38]通过不同温度宽叶羌活种子水浸提液对白菜种子萌发和幼苗生长的研究,证明宽叶羌活种子中含有较强的内源抑制物质,且随着温度升高,其浸提液中内源抑制物质活性越强。本研究结果表明,不同阶段不同浓度甘肃贝母种子水提取液对小白菜种子的生长指标也具有显著作用,且对小白菜种子幼苗生长的影响要强于其萌发特性,不同阶段对小白菜的化感效应存在较大差异。形态后熟阶段,对小白菜苗高、幼根长、幼根直径及单苗鲜重等各项生长指标均表现为单一的抑制作用,且除当水提取液浓度为2.5 mg·mL-1时对小白菜幼苗根直径的抑制作用不显著,其他均与对照相比达到统计差异显著水平,化感敏感程度总体表现为根长>苗高>幼根直径>单苗鲜重(个别浓度除外),说明小白菜幼苗对此阶段贝母种子内部化感物质的敏感部位主要集中在根部。生理后熟阶段,虽然规律性不明显,但是其在水提取液浓度为2.5 mg·mL-1时,已经开始表现出对小白菜幼根直径明显的促进作用。
电导率代表种子中的化感物质对质膜的损伤程度,水提取液中的化感物质可在一定程度上破坏细胞膜系统或改变细胞膜功能,从而影响植物对矿质元素和水分的吸收以及蛋白质的合成,抑制受体植物幼苗的生长[39]。本试验中,形态后熟阶段低浓度水提取液(2.5 ~10.0 mg·mL-1)处理的小白菜幼苗浸出液电导率显著低于高浓度(40 mg·mL-1)处理,表明小白菜幼苗在较低浓度下,细胞膜稳态性较强,这与邹丽娜等[40]的研究结果一致。生理后熟阶段,各处理之间无显著差异。综合分析表明,生理后熟阶段水提取液处理对小白菜幼苗细胞的伤害最低,甘肃贝母种子后熟过程中,形态后熟阶段水提取液对小白菜幼苗的抑制作用高于生理后熟阶段。
4 结论
本研究结果表明,甘肃贝母种子中含有一定活性的内源化感抑制物质,且与种子休眠有关系。在种子不同后熟阶段,其内源化感抑制物质的含量变化有显著差别,形态后熟阶段对小白菜种子幼根生长的抑制活性高于对其种子萌发的抑制活性,生理后熟阶段正好相反。本研究对内源化感抑制物质与甘肃贝母种子休眠之间的关系以及对其后熟处理过程中内源抑制物质的活性消长规律有了初步探讨,为进一步详细研究甘肃贝母种子萌发的抑制机理提供了科学依据,进而为甘肃贝母的引种驯化提供了重要参考。
