芹菜水孔蛋白基因AgPIP2;1的克隆及其对非生物胁迫的响应
2020-03-11尚珂含杨舒婷卞诗村刘梦婷安亚虹王广龙熊爱生
尚珂含 杨舒婷 卞诗村 刘梦婷 安亚虹 王广龙 熊爱生
(1淮阴工学院,江苏淮安 223003;2南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室,江苏南京 210095)
水孔蛋白(aquaporins,AQPs)又称水通道蛋白,是主要内在蛋白(major intrinsic protein,MIP)超家族中的一个大家族,可以促进包括水以及其他小分子物质经由生物膜的运输[1]。高等植物的水孔蛋白可分为五类,分别是质膜内在蛋白(plasma membrane intrinsic protein,PIP)、液泡膜内在蛋白(tonoplast intrinsic protein,TIP)、小分子碱性膜内在蛋白(small and basic intrinsic protein,SIP)、类Nod26 膜内在蛋白(nodulin 26-like intrinsic protein,NIP)和X 固有蛋白(X intrinsic proteins,XIP)[2]。PIPs 是一类定位于质膜上的水孔蛋白。PIPs 不仅与植物水分、小分子物质传输有关,还参与植物应对非生物胁迫的进程[3]。在结构上,PIPs蛋白具有MIP 家族典型的跨膜螺旋结构特征,即5 个短环(loopA ~loopE)连接的6 个跨膜α-螺旋(TM1 ~TM6),在B 环和E 环上含有高度保守的氨基酸基序NPA(Asn-Pro-Ala),这两个NPA 基序对于水通道形成起着至关重要的作用[4]。根据序列特征可将PIPs 分为PIP1 和PIP2 两大类。PIP2 类的N 端比PIP1 类短,而其C 端比PIP1 类长,这可能是导致两者功能不完全相同的原因[5]。研究表明,PIP2 类蛋白一般具有很高的水分运输活性,而PIP1 类蛋白活性则较低或不具有活性,当两者同时表达时,其活性和细胞膜通透性比PIP2 类单独作用时高[6-7]。
目前,PIP2 基因在许多植物中已经被克隆或鉴定,其在几乎所有组织中均可表达,同时容易受到高温、干旱、盐等非生物胁迫的诱导。研究发现,从水稻中分离的OsPIP2;1 可通过调节水分运输效率和根系生长响应干旱胁迫[8];月季中的RhPIP2;1 参与了乙烯介导的花瓣扩展,且该基因受到转录因子PTM 的调节[9-10];葡萄根特异表达的VvPIP2;4N可以调节根系导水性和叶片气体交换速率[11];在草莓中克隆的3 个PIP2 基因在不同组织中均可以表达,且可能参与草莓果实发育和成熟过程[12]。这些结果说明,PIP2 基因在植物生长发育和抵御非生物胁迫的过程中发挥着重要作用。芹菜(Apium graveolensL.)属伞形科芹属蔬菜作物,含有丰富的营养物质,在世界各地普遍栽培。随着高温、干旱等极端气候频繁发生以及土壤盐渍化等问题的加剧,芹菜等园艺作物的产量和品质受到严重的威胁[13-16]。如何增强植株抗逆能力,提高作物对逆境的适应能力成为育种专家和农业技术人员关注的焦点。本试验以芹菜品种六合黄心芹为研究材料,克隆获得AgPIP2;1 基因,利用生物信息学工具对该基因进行序列分析,并对其在不同组织和非生物胁迫下的表达和功能进行分析,以期为芹菜等作物抗逆育种提供理论依据。
1 材料与方法
1.1 材料及处理
试验材料为芹菜品种六合黄心芹,该品种是南京六合地区的优良品种,因具有产量高、商品性好、品质优、抗逆性强等优点,深受广大群众欢迎[17]。将芹菜植株种植于南京农业大学人工气候室,待植株2 月龄时,分别对其进行高温(38℃)、低温(4℃)、干旱(20%PEG 6000)以及盐(200 mmol·L-1NaCl)的非生物胁迫处理,分别于处理0、1、2、4、8 和24 h 各选取5 株植株的顶部第2 ~第3 片叶,并取同时期未经任何处理的根、叶柄和叶片,用于RNA 的提取及cDNA 的合成。每个处理设3 次重复。
1.2 主要试剂与工具酶
ExTaq聚合酶和反转录试剂盒购自大连TaKaRa生物工程公司;琼脂糖凝胶回收试剂盒购自美国Omega 公司;ChamQ SYBR qPCR Master Mix 荧光定量试剂盒购自南京诺唯赞生物科技有限公司。
1.3 芹菜AgPIP2;1 基因的克隆
根据芹菜基因组数据库[18],检索并拼接出芹菜水孔蛋白基因AgPIP2;1 序列,设计一对克隆引物PIP-F(ACAAATTATCCATACCAACTCTGCT)和PIP-R(CTT GTCTTCCATAAATACTTTCTTG),以六合黄心芹cDNA作为PCR 反应模板,PCR 反应程序为94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,共40 个循环;72℃再延伸10 min。目标产物用1.2%琼脂糖凝胶进行电泳分离,回收后将产物连入pMD19-T载体(大连TaKaRa 生物工程公司),并转化大肠杆菌DH5α 感受态细胞[天根生化科技(北京)有限公司],挑选阳性克隆并进行PCR 鉴定后委托南京金斯瑞生物科技有限公司进行测序。
1.4 序列分析
测序结果用NCBI BLAST(http:/ /www.ncbi.nlm.nih.gov/)进行比对。采用ProtParam(https:/ /web.expasy.org/protparam/)对氨基酸成分、蛋白质相对分子质量、等电点和蛋白质疏水性/亲水性等进行分析;利用DNAMAN 软件进行蛋白质多重序列比对;使用MEGA 5 构建进化树;采用在线软件Softberry 对其亚细胞定位进行预测;采用SOPMA 预测蛋白二级结构;利用在线软件TMHMM(http:/ /www.cbs.dtu.dk/services/TMHMM/)对AgPIP2;1 蛋白的跨膜结构域进行分析;通过Swiss-Model 在线软件(http:/ /swissmodel.expasy.org)预测蛋白三级结构。
1.5 AgPIP2;1 基因表达分析
根据AgPIP2;1 的序列,设计一对PIP2-BD-F(GC AGTCATAGCGGAGTTCATAGCA)和PIP2-BD-R(GAA TGCCAACGCCACCACACT),采用ChamQ SYBR qPCR Master Mix 荧光定量试剂盒(南京诺唯赞生物科技有限公司)进行荧光定量PCR 反应。芹菜内参基因AgACTIN的引物为AgACTIN-BD-F(AGAAGTCCTGTTC CAGCCGTCTT)和AgACTIN-BD-R(CGAACCACCACTG AGCACTATGTT)[19]。反应体系:ChamQ SYBR qPCR Master Mix 10 μL,上下游引物各0.4 μL,cDNA 2 μL,RNase Free ddH2O 7.2 μL。在荧光定量PCR 仪上进行反应,具体程序为95℃预变性30 s;95℃变性5 s,60℃退火20 s,72℃延伸15 s,40 个循环。每个样品进行3 次生物学重复和3 次技术重复。采用2-ΔΔCt法[20]分析目的基因的相对表达水平。
1.6 数据统计
采用Microsoft Office Excel 2013 和SPSS 16.0 软件进行数据整理和统计分析,使用Duncan 法进行多重比较和差异显著性分析(P<0.05)。
2 结果与分析
2.1 芹菜AgPIP2;1 基因的克隆与序列分析
以芹菜品种六合黄心芹的cDNA 为模板,经过RT-PCR 获得了1 条大约1 000 bp 的片段(图1)。回收测序后得到一条1 028 bp 的片段,其含有1 个861 bp 的开放阅读框(open reading frame,ORF),编码286个氨基酸(图2),预测其蛋白质相对分子质量为30.68 kD,等电点为8.27。
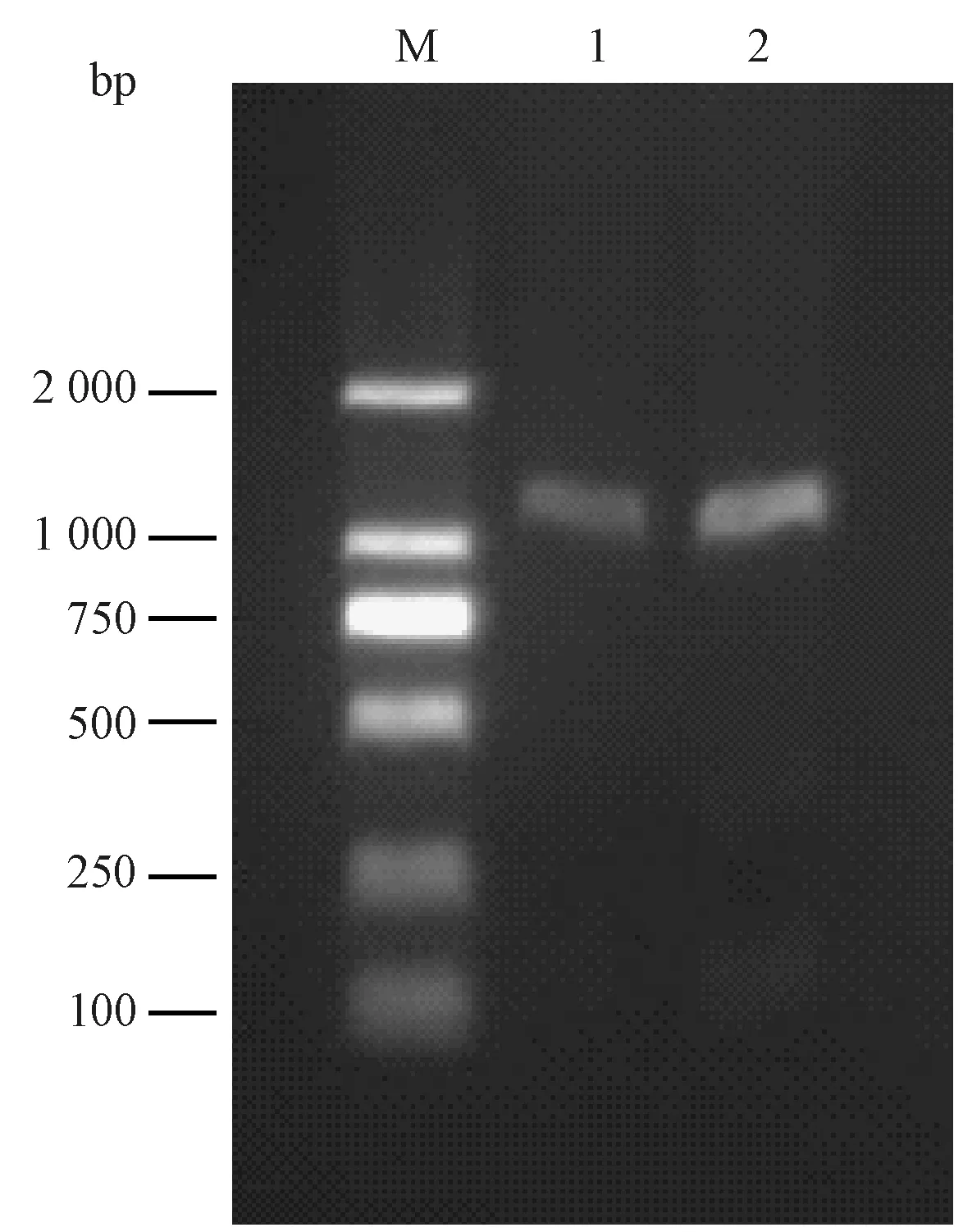
图1 芹菜AgPIP2;1 基因的RT-PCR 扩增图谱Fig.1 RT-PCR amplification pattern of AgPIP2;1 gene from celery
2.2 芹菜AgPIP2;1 基因及其编码蛋白的序列分析
NCBI BLAST 比对发现,AgPIP2;1 基因编码的蛋白属于PIP2 类家族蛋白。AgPIP2;1 蛋白GRAVY 值为0.450,是疏水性蛋白,不稳定系数(instability indexⅡ)为28.84,为稳定蛋白。亚细胞定位预测AgPIP2;1基因定位于质膜上。SOPMA 软件预测AgPIP2;1 的二级结构含有32.52%α-螺旋、18.18%延伸链、3.5%β-转角和45.80%随机卷曲。TMHMM 软件分析显示,AgPIP2;1 具有6 个跨膜区(分别位于氨基酸序列第40~62、77~99、122~144、169~188、201~223、249~271位),由膜两侧的5 个环状结构连接,其中第1、第3 和第5 环在细胞膜外,第2 和第4 环及N、C 末端都位于细胞膜内(图3)。以菠菜SoPIP2;1(PDB ID:4jc6.2.D)为模板,采用Swiss-Model 在线软件对该蛋白进行三级结构分析,发现AgPIP2;1 的三级结构主要由α-螺旋构成,且以四聚体的形式存在(图4)。
2.3 芹菜AgPIP2;1 的氨基酸序列同源性分析
将芹菜AgPIP2;1 的氨基酸序列分别与胡萝卜(Daucus carota)DcPIP2;1 和DcPIP1;3、绿豆(Vigna radiate)VrPIP2;1、大豆(Glycine max)GmPIP2;1、苹果(Malus domestica)MdPIP2;2、莴苣(Lactuca sativa)LsPIP2;5、野草莓(Fragaria vesca)FvPIP2;1、玉米(Zea mays)ZmPIP1;1、高粱(Sorghum bicolor)SbPIP1;2、拟南芥(Arabidopsis thaliana)AtPIP1;4、萝卜(Raphanus sativus)RsPIP1;1、南瓜(Cucurbita moschata)CmPIP1;3及甜瓜(Cucumis melo)CmPIP1;2 的氨基酸序列进行BLAST 同源性比对,发现芹菜的AgPIP2;1 氨基酸序列与其他物种的PIP2 氨基酸序列具有较高的同源性,其中与胡萝卜DcPIP2;1 的氨基酸序列同源性达到97.90%,但与PIP1 类氨基酸序列同源性相对偏低;相对于PIP1 类蛋白,PIP2 类蛋白N 端更短,而C 端更长。此外,AgPIP2;1 具有两个高度保守的NPA 基序、MIP 家族特有的SGGHINPAVTFG 序列以及植物PIPs的保守序列 GGGANXXXXGY 和 TGI/TNPARSL/FGAAI/Ⅵ/VF/YN(图5)。

图2 芹菜AgPIP2;1 基因的核苷酸序列及其编码的氨基酸序列Fig.2 Nucleotide acid and predicted amino acid sequences of AgPIP2;1 gene from celery

图3 AgPIP2;1 的跨膜结构域预测Fig.3 The transmembrane region prediction of AgPIP2;1

图4 AgPIP2;1 的蛋白质三级结构预测Fig.4 The predicted three-dimensional structure of AgPIP2;1
2.4 芹菜AgPIP2;1 的系统进化树分析
利用Mega 5 软件对芹菜AgPIP2;1 基因编码的氨基酸序列与部分物种的PIP 氨基酸序列进行系统进化树分析。由图6 可知,13 个物种共14 个PIP 蛋白分为两类,其中PIP1 占据一个分支,PIP2 占据另一个分支。AgPIP2;1 属于PIP2 亚类,与同属PIP2 亚类的其余物种的氨基酸序列同源性明显高于PIP1 亚类,AgPIP2;1 与大豆GmPIP2;1、胡萝卜DcPIP2;1 和绿豆VrPIP2;1 的亲缘关系较为接近。
2.5 芹菜AgPIP2;1 基因在不同组织的表达和对非生物胁迫的响应
由图7 可知,AgPIP2;1 基因在芹菜根、叶柄和叶片中均有表达,但相对表达量差异较大。其中,在芹菜叶片中的表达水平最高,叶柄次之,在根中的表达水平最低,呈现比较明显的组织特异性。
芹菜AgPIP2;1 基因表达水平在高温(38℃)、低温(4℃)、模拟干旱(20% PEG 6000)和盐(200 mmol·L-1NaCl)非生物胁迫处理后发生显著变化(图8)。高温(38℃)处理下,随着处理时间的延长,AgPIP2;1 基因的表达量呈现先升高后降低的趋势,且在处理后2~8 h 时维持较高的表达水平;低温(4℃)和模拟干旱(20% PEG 6000)条件下,芹菜AgPIP2;1基因表达水平均在处理后24 h 升至最高;盐胁迫处理(200 mmol·L-1NaCl)下,AgPIP2;1 基因的表达量呈现先升高后下降再上升的趋势,在处理后1 h 时达到峰值,之后下降,在处理后8 h 时AgPIP2;1 基因的相对表达量达到最低。

图5 芹菜AgPIP2;1 与其他物种PIP 氨基酸序列的多重比对Fig.5 Multiple alignment of amino acid sequences of AgPIP2;1 from celery and PIPs from other species
3 讨论
水分子可通过自由扩散的形式进出细胞,但速率缓慢,不能满足特定情况下细胞代谢的需求。水孔蛋白是细胞膜上调控水分等小分子物质跨越细胞膜快速运输的重要调节蛋白,普遍存在于动物和植物等生物中[21]。自第1 个水孔蛋白在动物中被发现以来,越来越多的动植物和微生物水孔蛋白基因被分离和鉴定[22]。本研究从芹菜六合黄心芹中克隆得到了1 个水孔蛋白基因AgPIP2;1,具有水孔蛋白典型的6 个跨膜区、2 个NPA 基序以及高等植物PIPs 特有的GGGANXXXXGY 和TGINPARSL/FGAAI/VIYN 高 度保守序列,亚细胞定位预测该蛋白定位于质膜上,这些特征是水孔蛋白分类的重要标准,也是执行水孔蛋白功能的关键序列单元[23]。此外,AgPIP2;1 基因与PIP2 类蛋白同源性较高,与胡萝卜DcPIP2;1 的同源性达到97.90%,但与PIP1 类同源性相对偏低,说明了水孔蛋白家族内部不同类别的高度保守性。

图6 芹菜AgPIP2;1 与部分物种PIP 氨基酸序列的系统进化树Fig.6 Phylogenetic tree of amino acid sequences of AgPIP2;1 from celery and PIPs from several plant species
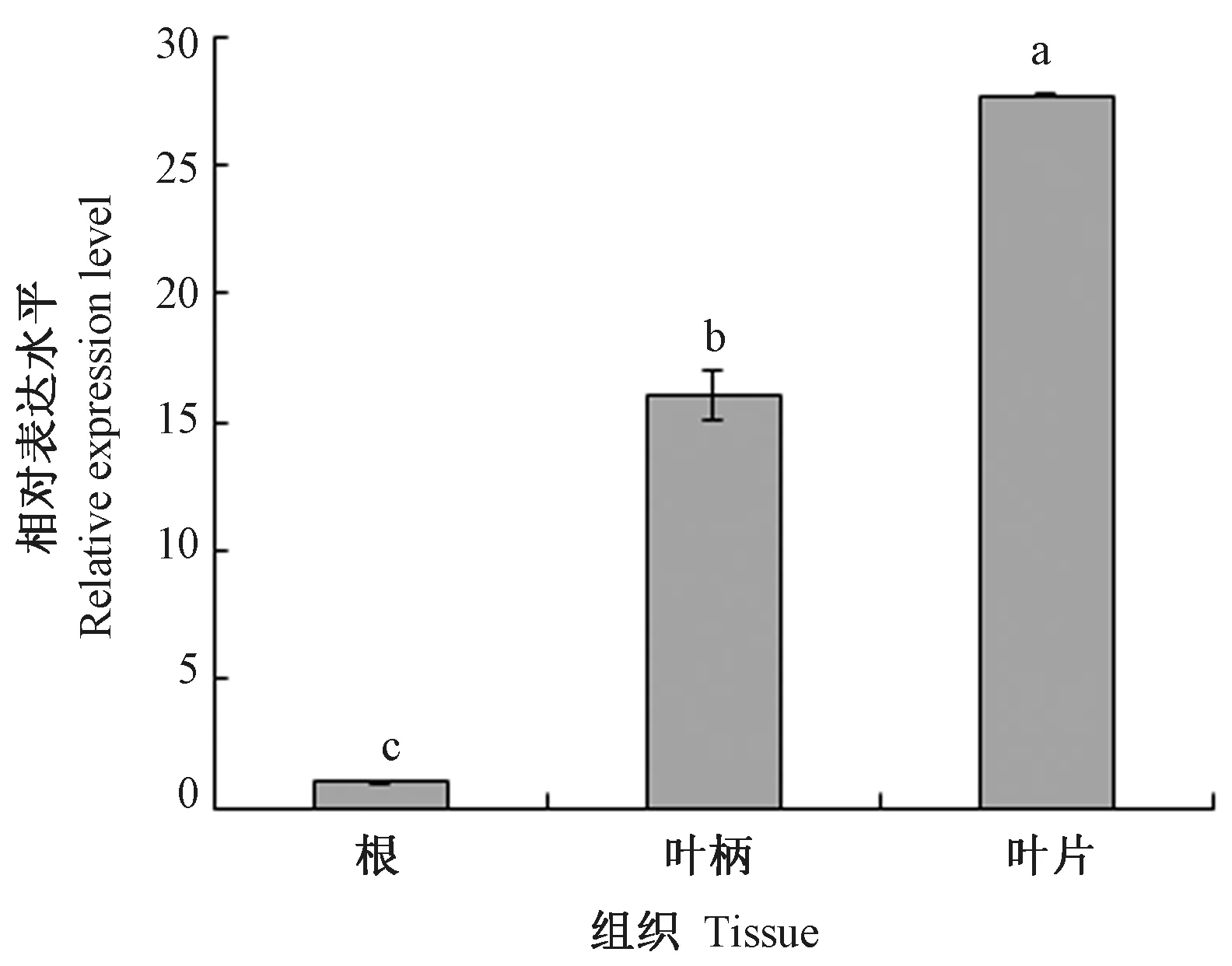
图7 AgPIP2;1 基因在芹菜不同组织中的表达水平Fig.7 Expression levels of AgPIP2;1 gene in different tissues of celery
水孔蛋白参与植物花的发育、种子休眠和萌发、叶片蒸腾等过程[1,24-25],因此,水孔蛋白不同成员在不同组织的差异表达可能与其具体担负的生理功能有关。本研究克隆的AgPIP2;1 基因在叶片中表达最高,表明该基因可能主要在叶片中发挥功能。大量研究结果表明,PIPs 通过调节水分运输参与植物抵御非生物胁迫的过程[3]。Heinen 等[26]指出低温驯化过程中PIP转录水平的下调有助于防止冻干引起的细胞脱水,从而提高细胞的抗冻性。烟草植株中过表达芥菜BjPIP1 时,能降低蒸腾速率和气孔导度,保持叶片合理的水分状态,增强植株对干旱和镉的抗性[27]。在番茄中,PIP2 类基因可通过提高细胞膜的导水率来增强植株在正常和干旱胁迫下的生存能力[28]。将野生大豆的GsPIP2;1 基因异源表达进拟南芥中,发现植株对于盐胁迫以及水分胁迫的敏感性发生变化[29]。此外,PIP2 能与其他逆境响应因子互作调节水分传输,共同参与植株应对盐胁迫的过程[30]。本研究克隆的AgPIP2;1 基因能响应高温、低温、干旱和盐等非生物胁迫的诱导,说明该基因参与了植株抵御非生物胁迫的过程,其可能通过调节根部和叶片的水分吸收、运输和消耗来提高植株的抗逆性。但AgPIP2;1 基因如何响应信号因子启动抗逆反应,以及在不同非生物逆境中的应对和调节方式是否有变化,尚需进一步深入研究。
4 结论
本研究克隆的芹菜AgPIP2;1 基因属于PIP2 类家族成员,在芹菜叶片中的表达水平最高,叶柄次之,在根中的表达水平最低,呈现比较明显的组织特异性,且能够响应高温、低温、干旱和盐等非生物胁迫,说明该基因可能参与了植株抵御非生物胁迫的过程,但其具体的作用机制有待进一步研究。本研究结果为接下来开展该基因在芹菜抵御非生物胁迫中的作用及其调控机制研究奠定了基础。鉴于该基因可响应非生物胁迫的诱导,将来在明确其功能及其调控机制的情况下可有望利用该基因进行抗逆育种,为提高芹菜等作物对干旱等非生物胁迫的适应能力提供思路和方向。
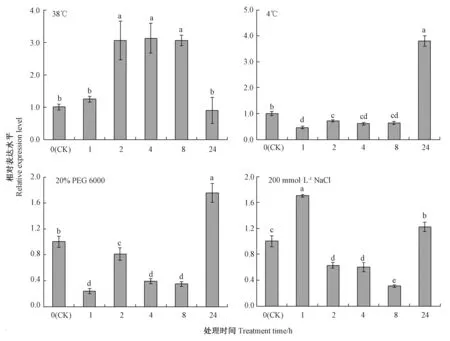
图8 芹菜AgPIP2;1 基因对不同非生物胁迫的响应Fig.8 Responses of AgPIP2;1 gene from celery to different abiotic stresses
