罗汉果皂苷提取物对INS-1胰岛β细胞糖脂毒性的保护作用研究
2020-03-11喻柯柯刘合生杨文康曹少谦陈秋平戚向阳
喻柯柯 刘合生 张 境 杨文康 曹少谦 陈秋平 戚向阳
(1 浙江万里学院生物与环境学院,浙江 宁波 315100;2浙江医药高等专科学校食品学院,浙江 宁波 315100)
罗汉果[Siraitia grosvenorii(swingle)C.Jeffrey]为我国特有的药食两用资源,大量研究表明其具有多种生物功能,如抗氧化、降血糖、抗炎等[1-2],罗汉果皂苷(mogroside)是其主要活性成分[3]。近年来,关于皂苷类降血糖的作用已有诸多报道[4-8],而关于罗汉果皂苷降血糖方面的研究较少。Suzuki 等[9-10]研究发现罗汉果皂苷提取物可抑制正常大鼠餐后高血糖,其降血糖机制可能与罗汉果皂苷抑制小肠麦芽糖酶活性有关,进一步研究表明,罗汉果皂苷可降低2 型糖尿病大鼠血糖,促进胰岛素分泌及增加糖耐量,减轻肝脏和血浆的氧化应激。白玉鹏等[11]研究发现罗汉果皂苷具有降血糖、抗糖尿病作用,但其作用机制及靶向组织或器官尚不清楚。胰岛β 细胞通过分泌胰岛素,调节机体糖、脂肪、蛋白质等代谢,维持代谢稳态,一旦其功能受损,会引起机体分泌胰岛素能力降低,导致糖尿病的发生和发展[12-15]。另一方面,糖尿病引起的高血糖和脂代谢失调诱发胰岛β 细胞的糖脂毒性,加速了β 细胞功能受损和凋亡[16-20]。越来越多的研究表明,2 型糖尿病患者的胰岛β 细胞功能受损、逐渐凋亡,而抑制胰岛β 细胞凋亡是治疗2 型糖尿病的有效方法[21-22]。
前期研究表明,罗汉果皂苷提取物具有降低糖尿病小鼠血糖、血脂及体外清除活性氧的功能[23-24],但其作用机制尚未阐明。Xu 等[25]研究发现罗汉果皂苷干预棕榈酸诱导的NIT-1 胰岛β 细胞凋亡,降低胞内活性氧积累,但其抗凋亡作用仍不明确。体内、体外研究表明,糖尿病状态下的高血糖及伴随的游离脂肪酸水平上升可加速胰岛β 细胞凋亡,且两者具有协同促凋亡作用,远大于单纯高糖或高脂的作用[17]。为此,本研究以INS-1 胰岛β 细胞为试验对象,利用高浓度葡萄糖联合高浓度棕榈酸,模拟2 型糖尿病的病理特征,建立胰岛β 细胞体外凋亡模型,探讨罗汉果皂苷提取物(mogroside extract,MGE)对高糖、高脂诱导INS-1 胰岛β 细胞凋亡的抑制作用,初步探讨其抗凋亡机制,旨在为罗汉果资源的深度开发及利用提供参考。
1 材料与方法
1.1 材料与试剂
大鼠胰岛素瘤细胞系INS-1,上海基免实业有限公司;1640 培养基,中国Hyclone 公司;β-巯基乙醇,美国Gibco 公司;丙酮酸钠、葡萄糖、棕榈酸(palmitic acid,PA)、牛血清白蛋白(bovine serum albumin,BSA)、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、Hoechst 33342、碘化丙啶(propidium iodide,PI)、台盼蓝以及胰蛋白酶,美国Sigma 公司;胎牛血清及β-tubulin,北京全式金生物技术有限公司;青霉素-链霉素溶液、BCA(bicinchoninic acid)蛋白浓度测定试剂盒及细胞与组织裂解液,上海碧云天生物技术有限公 司;cleaved caspase 3、caspase 3 抗 体、HRP(horseradish peroxidase)标记山羊抗鼠lgG(H+L)、HRP 标记山羊抗兔lgG(H+L),美国Cell Signaling Technology;罗汉果皂苷提取物(MGE,总皂苷含量≥80%),桂林莱茵生物科技股份有限公司。
1.2 主要仪器与设备
MCO-15AC CO2培养箱,日本松下公司;Ti-S 荧光倒置显微镜,日本Nikon 公司;Centrifuge 5430 离心机,美国Eppendorf 公司;Multiskan FC 通用酶标仪,美国Thermo Fisher;Universal Hood Ⅱ凝胶成像系统和Mini-PROTEAN·Tetra 垂直电泳仪,美国Bio-Rad 公司。
1.3 试验方法
1.3.1 细胞复苏及培养 液氮冻存的INS-1 胰岛β细胞于37℃水浴快速解冻,1 000 r·min-1离心5 min 后弃上清液,加入5 mL 培养液重悬,反复吹打成单细胞悬液,加入适量含10%胎牛血清的INS-1 胰岛β 细胞专用培养基,于37℃、饱和湿度及5% CO2的培养箱中培养过夜,待细胞融合度为70%~90%时,用0.25%胰蛋白酶消化、传代培养。本试验所用INS-1 胰岛β 细胞代数在20~30 代之间[24]。
1.3.2 INS-1 胰岛β 细胞活力检测 INS-1 胰岛β细胞按1.2×104个/孔接种于96 孔板,培养48 h 后每孔加入20 μL 5 mg·mL-1MTT 溶液,37℃孵育4 h 至有蓝紫色结晶析出,3 000 r·min-1离心10 min,弃上清液,每孔加入100 μL 二甲亚砜,400 r·min-1震荡10 min 使甲瓒结晶完全溶解,于492 nm 波长处测定吸光度。按照公式计算细胞活力:

1.3.3 Hoechst 33342/PI 荧光染色 细胞处理结束后弃上清液,用0.01 mol·L-1磷酸缓冲液(phosphate buffer solution,PBS,pH 值7.4)清洗2 次,每次3 min,每孔加入200 μL 5 μg·mL-1Hoechst 33342 和200 μL 5 μg·mL-1PI 工作液,室温孵育15 min。PBS 再清洗2次,每次3 min,弃上清,荧光倒置显微镜选用紫外光滤光片(ultraviolet,UV)观察Hoechst 33342 染色情况,正常细胞呈现弱蓝色荧光,而凋亡细胞呈亮蓝色荧光;绿光滤光片(green,G)观察PI 染色情况,正常细胞呈现弱红色荧光,而晚期凋亡和坏死细胞呈亮红色荧光。
1.3.4 MGE 细胞毒性试验 待细胞融合度为70%~90%时按1.2×104个/孔接种于96 孔板,设置对照组和MGE 处理组,其中对照组加入200 μL 完全培养基,MGE 处理组加入200 μL 0.1 ~500 μg·mL-1的MGE。加入MGE 前,INS-1 细胞无血清培养基饥饿2 h 使细胞同步化,培养结束后检测INS-1 胰岛β 细胞活力,每组设置5 个复孔。
1.3.5 高糖高脂对INS-1 胰岛β 细胞活力的影响 待细胞融合度为70%~90%时按1.2×104个/孔接种于96 孔板,设置对照组和高糖高脂处理组,其中对照组加入200 μL 完全培养基;高糖高脂处理组加入200 μL 含不同浓度高糖(10 ~20 mmol·L-1,high glucose,HG)和PA(0.2~0.6 mmol·L-1)的完全培养基。加入MGE 前,INS-1 细胞无血清培养基饥饿2 h 使细胞同步化,培养结束后检测INS-1 胰岛β 细胞活力,每组设置5 个复孔。
1.3.6 MGE 对糖脂毒性损伤INS-1 胰岛β 细胞的影响 待细胞融合度为70%~90%时按1.2×104个/孔接种于96 孔板,设置对照组、高糖高脂模型组、MGE处理组,其中对照组加入200 μL 完全培养基;模型组加入50 μL 80 mmol·L-1HG、50 μL 1.6 mmol·L-1PA与100 μL 完全培养基,体系最终含20 mmol·L-1HG,0.4 mmol·L-1PA;MGE处理组加入50 μL 80 mmol·L-1HG、50 μL 1.6 mmol·L-1PA 和100 μL 初始浓度分别为0.2、2、20、200 μg·mL-1的MGE 溶液。加入MGE 前,INS-1 细胞无血清培养基饥饿2 h 使细胞同步化,培养结束后检测INS-1 胰岛β 细胞活力,每组设置5 个复孔。
1.3.7 MGE 对糖脂毒性损伤细胞凋亡和坏死的影响 待细胞融合度为70%~90%时按1×105个/孔接种于24 孔板,试验分组及处理同1.3.6。培养结束后进行Hoechst 33342/PI 染色,荧光显微镜观察INS-1 胰岛β 细胞凋亡和坏死情况,每组设置3 个复孔。
1.3.8 caspase 3 蛋白表达分析 待细胞融合度为70%~90%时按8×105个/孔接种于6 孔板,试验分组及处理同1.3.6。模型组含20 mmol·L-1HG、0.4 mmol·L-1PA,MGE 处理组含20 mmol·L-1HG、0.4 mmol·L-1PA 及1 μg·mL-1或100 μg·mL-1MGE;加入MGE 前,INS-1 细胞无血清培养基饥饿2 h 使细胞同步化。培养结束后弃上清,用预冷PBS 洗涤2 次,每孔加入200 μL 细胞裂解液,冰上裂解并反复吹打使细胞充分裂解,4℃、13 000×g 离心30 min,按BCA 法试剂盒说明书测定上清液总蛋白含量。
聚丙烯酰胺凝胶电泳分离胶浓度10%~12%,浓缩胶5%,每孔加入等量总蛋白(30~50 μg),电泳结束后凝胶湿法电转移至硝酸纤维素膜(nitrocellulose,NC),5%脱脂奶粉室温封闭1 h,4℃孵育一抗(cleaved caspase 3 和caspase 3,1∶1 000;β-tubulin,1∶2 500)过夜,弃一抗,1×TBST(tris-buffered saline with Tween 20)洗涤5 次,每次5 min。加二抗(1∶5 000)室温孵育1 h,弃二抗,1×TBST 洗涤5 次,每次5 min。采用增强型化学发光(enhanced chemiluminescence,ECL)法使X光胶片曝光,显影、定影后显色。
1.3.9 数据分析 试验数据用平均值±标准差表示,根据Western blotting 条带灰度值对蛋白质相对表达水平进行半定量分析。采用SPSS 17.0 软件进行单因素方差分析(ANOVA),两组间比较采用双侧t检验,P<0.05 差异显著,P<0.01 差异极显著。采用Origin 8.0和GraphPad Prism 5.0 软件绘图。
2 结果与分析
2.1 高糖、高脂对INS-1 胰岛β 细胞活力的影响
由图1 可知,10、15 和20 mmol·L-1的高糖单独作用于INS-1 胰岛β 细胞48 h,细胞活力分别为105.6%、100.8% 和 94.8%;而 0.2、0.4 和 0.6 mmol·L-1的PA 单独作用INS-1 胰岛β 细胞48 h,细胞活力分别下降至70.4%、53.8%和36.7%。表明高浓度PA 处理极显著降低了INS-1 胰岛β 细胞活力;低浓度葡萄糖处理对细胞活力有促进作用,但浓度高于20 mmol·L-1时,细胞活力降低;而高糖和高脂混合体系诱导INS-1 胰岛β 细胞活力显著降低,并呈现明显的剂量效应关系。为使INS-1 胰岛β 细胞既发生适度损伤,又不过度凋亡,本研究选用20 mmol·L-1HG 与0.4 mmol·L-1PA 组成混合体系作为高糖高脂损伤模型。
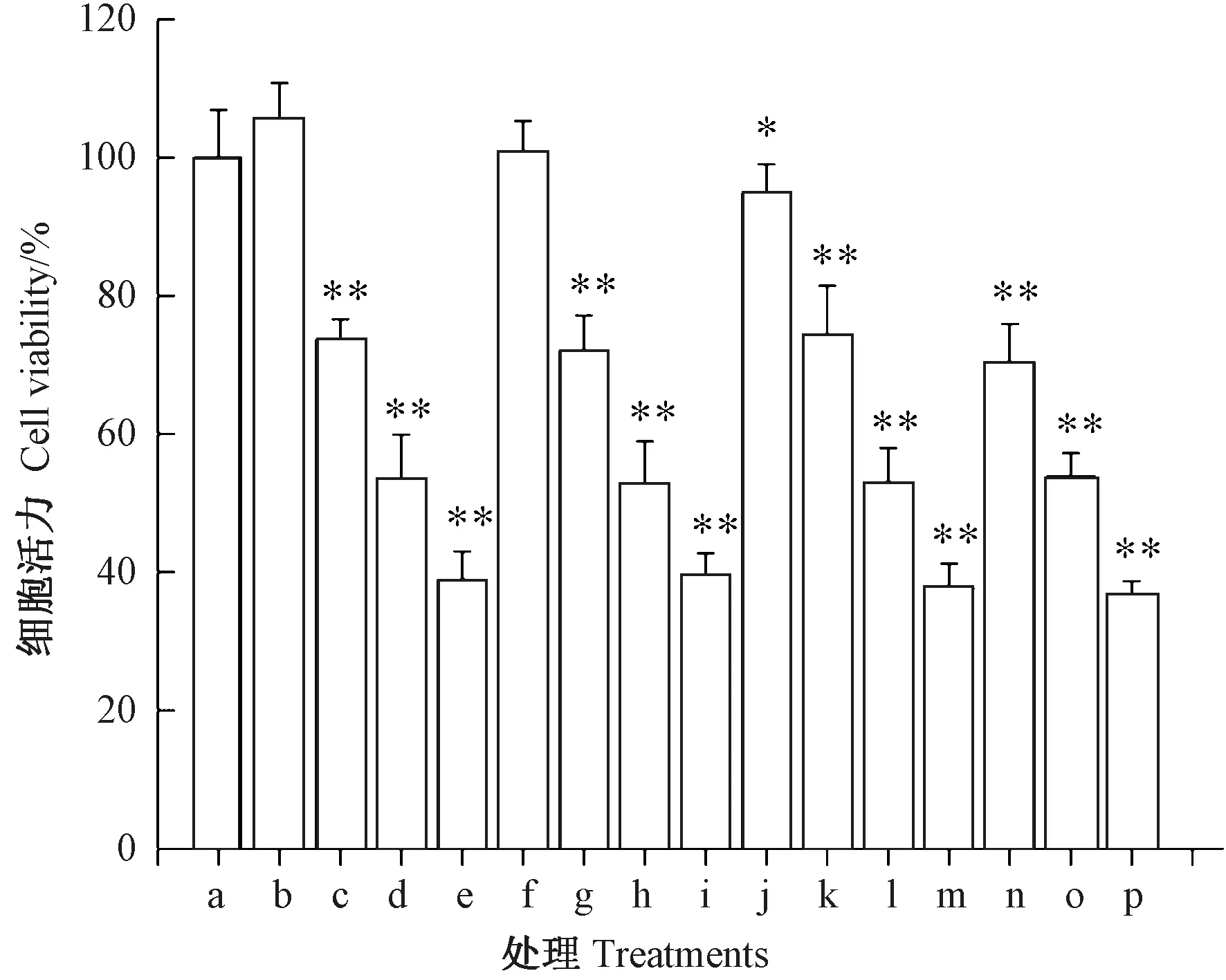
图1 葡萄糖和棕榈酸长期暴露对INS-1胰岛β 细胞活力的影响Fig.1 Effect of long-term exposure of glucose and palmitic acid on INS-1 pancreatic islet β cell viability
2.2 MGE 对INS-1 胰岛β 细胞毒性的影响
由图2 可知,在0.1 ~100 μg·mL-1浓度范围内,MGE 对INS-1 胰岛β 细胞活力无显著抑制作用(P>0.05);当MGE 浓度达到500 μg·mL-1时极显著降低了INS-1 胰岛β 细胞活力(P<0.01),为对照组的68.3%。为此本研究中MGE 作用浓度不宜高于100 μg·mL-1。
2.3 MGE 对高糖、高脂损伤的INS-1 胰岛β 细胞活力的影响
由图3 可知,高糖高脂模型组细胞活力仅为对照组的53.5%,10 ~100 μg·mL-1MGE 干预显著增强了高糖、高脂损伤的INS-1 胰岛β 细胞活力,且在0.1 ~10 μg·mL-1浓度范围内呈明显的剂量效应关系。与模型组相比,100 μg·mL-1MGE 干预组细胞活性提高了15.5%。
2.4 MGE 对高糖、高脂诱导INS-1 胰岛β 细胞凋亡和坏死的影响
由图4、5 可知,对照组只有极少数细胞发生凋亡,高糖、高脂处理组INS-1 细胞凋亡明显增多,而不同浓度MGE 干预,INS-1 细胞凋亡数量明显减少。表明高糖、高脂暴露促进INS-1 胰岛β 细胞凋亡,并进一步发展为细胞坏死,而MGE 干预对INS-1 胰岛β 细胞的糖脂毒性具有明显保护作用,且呈明显的剂量效应关系。
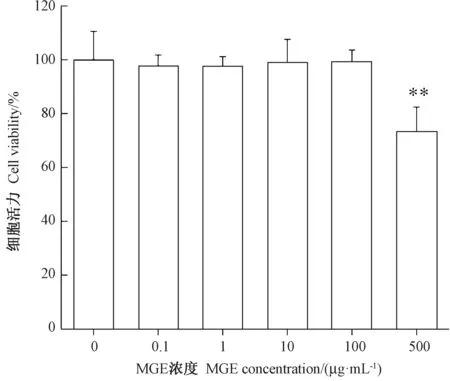
图2 MGE 对INS-1 胰岛β 细胞毒性的影响Fig.2 Effect of MGE on cytotoxicity of INS-1 pancreatic islet β cell
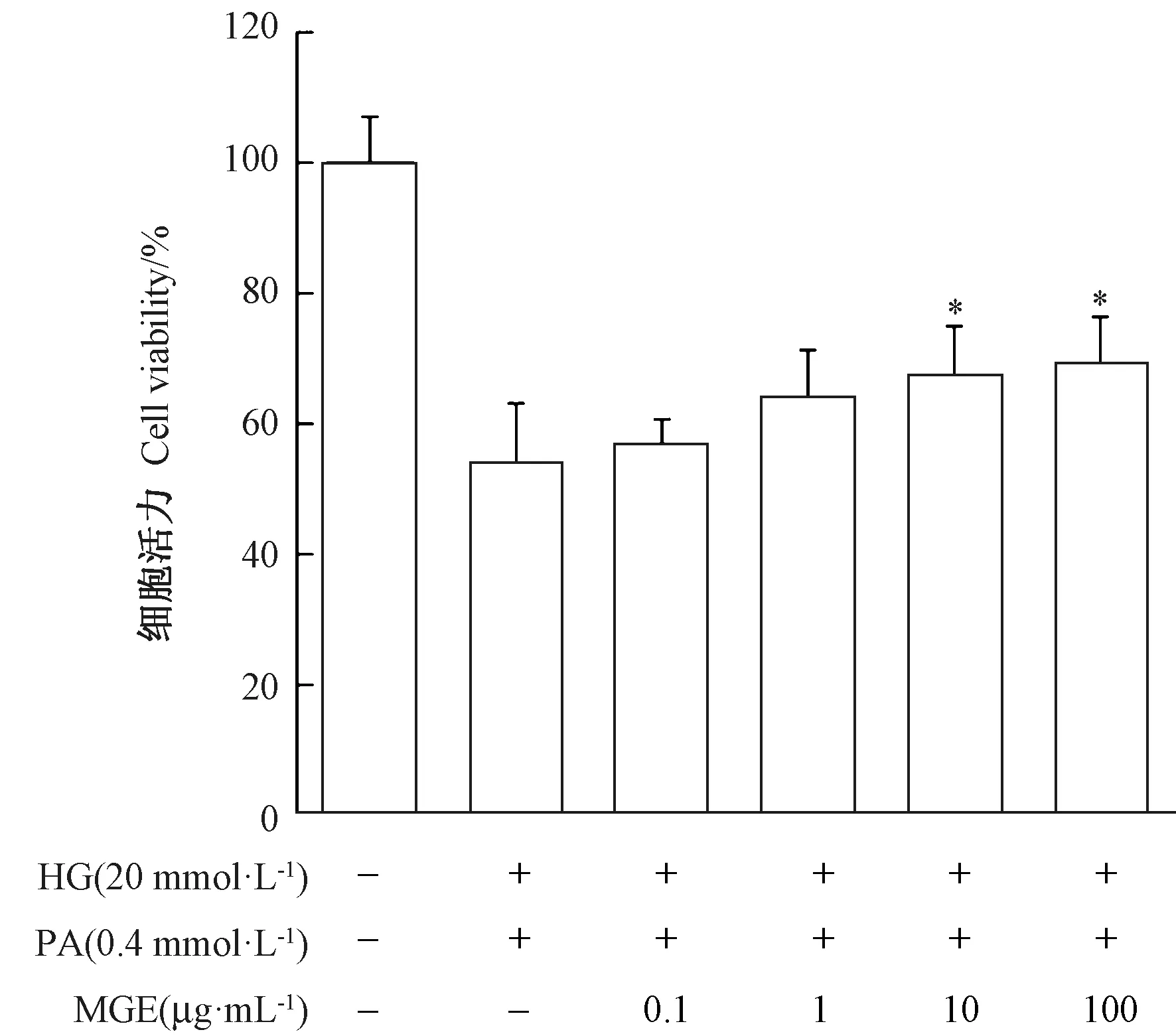
图3 MGE 对INS-1 胰岛β 细胞糖脂毒性的抑制作用Fig.3 Inhibitory effect of MGE on glucolipotoxicity of INS-1 pancreatic islet β cell
2.5 MGE 干预对caspase 3 蛋白表达水平的影响
由图6 可知,长期暴露于高糖、高脂的INS-1 胰岛β 细胞,cleaved caspase 3 表达水平显著上调,而MGE 干预显著下调了cleaved caspase 3 表达水平,且与1 μg·mL-1MGE相比高浓度的MGE(100 μg·mL-1)下调cleaved caspase 3 水平的效果更明显。
3 讨论
胰岛β 细胞凋亡在2 型糖尿病的发生发展中发挥着重要作用,从传统中药中开发具有保护胰岛β 细胞功能的活性物质是目前国内外糖尿病治疗药物研发的热点之一[26-27]。糖尿病诱发的持续高血糖和脂代谢失调是胰岛β 细胞功能受伤和凋亡的主要诱因。研究表明,糖脂毒性对胰岛β 细胞的促凋亡作用与bcl-2 家族蛋白的调节有关[28]。bax 和bcl-2 均属于bcl-2 基因家族,bcl-2 为细胞凋亡抑制基因,而bax 拮抗bcl-2 的抗凋亡作用,且具有促进细胞凋亡的功能,胞内bcl-2/bax 比值降低,诱导caspase 级联反应,caspase 3 蛋白被剪切而激活,诱发细胞凋亡[29]。caspase 家族(半胱氨酸天冬氨酸蛋白酶)是细胞凋亡的主要执行者[30],正常状态的caspase 3 以无活性的蛋白酶原procaspase 3 存在,当受到内部或外部信号刺激后,活化为具有凋亡作用的cleaved caspase 3[31-32]。本研究发现高糖、高脂暴露使INS-1 细胞活力显著下降,caspase 3 被剪切而激活,加速了细胞凋亡,而MGE干预可显著增强胰岛β 细胞活力,下调cleaved caspase 3 的表达水平,由此推断MGE 对胰岛β 细胞凋亡的抑制作用可能与cleaved caspase 3 表达水平下调有关。尽管高糖、高脂诱导胰岛β 细胞凋亡的分子机制极其复杂,且尚未阐明,但已有研究表明,高糖高脂引起的内质网应激、氧化应激、炎症反应参与了胰岛β 细胞的功能失调和凋亡过程,且活性氧过度积累是这3 种机制的共同特征[33-36]。胰岛β 细胞内源性抗氧化酶,如超氧化物气化酶、过氧化氢酶、谷胱甘肽过氧化物酶等表达水平较低,易受到活性氧攻击而导致功能失调和凋亡[37],因此具有清除活性氧的抗氧化物质可抑制胰岛β 细胞因氧化损伤而导致的凋亡[38]。
尽管三萜类化合物在化学结构上并不具备抗氧化剂的典型特征,但某些特殊结构的三萜类物质具有较强活性氧清除作用[39]。王步江等[40]研究发现,苦瓜皂苷(葫芦烷型四环三萜糖苷)体外具有明显的清除超氧阴离子和羟基自由基活性。类似地,前期研究发现,同为葫芦烷型三萜糖苷类化合物的罗汉果皂苷,在体外、体内均表现出较强的自由基清除作用及增强抗氧化酶活性能力,且11-O-罗汉高皂苷Ⅴ比罗汉高皂苷Ⅴ具有更高的超氧阴离子自由基清除活性,可能与11 号位的羟基转变为羰基有关[41-42]。Zhang 等[43]研究亦表明,高纯度罗汉果皂苷Ⅴ抑制脂多糖(lipopolysaccharides,LPS)和佛波醇12-十四酸酯13-乙酸酯引起的THP-1 单核细胞活性氧积累,增强了细胞抗氧化防御。由此推断本研究中罗汉果皂苷抑制高糖、高脂诱导的胰岛β 细胞凋亡,可能与罗汉果皂苷抑制高糖、高脂引起的活性氧积累有关,但此抗凋亡作用由单一罗汉果皂苷贡献还是多种皂苷协同作用所致,以及其抗凋亡机制尚未明确,需进一步探讨。
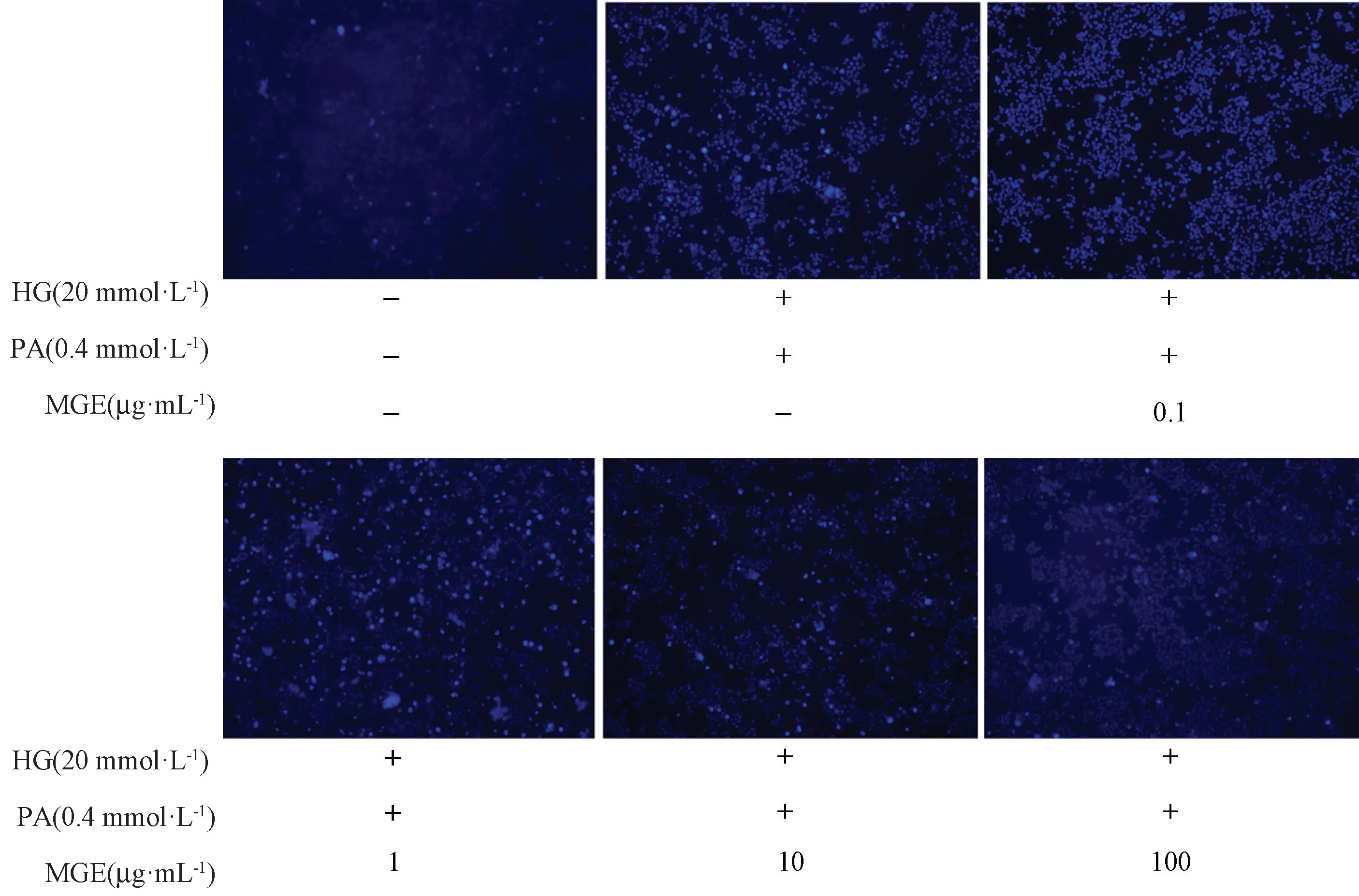
图4 MGE 干预对高糖、高脂诱导INS-1 胰岛β 细胞凋亡的影响(Hoechst 33342 染色)Fig.4 Effect of MGE treatment on HG- and PA-mediated apoptosis of INS-1 pancreatic islet β cell(Hoechst 33342 staining)

图5 MGE 干预对高糖、高脂诱导INS-1 胰岛β 细胞凋亡的影响(PI 染色)Fig.5 Effect of MGE treatment on HG- and PA-mediated apoptosis of INS-1 pancreatic islet β cell(PI staining)
4 结论
本研究结果表明,高糖、高脂诱导INS-1 胰岛β细胞损伤、细胞膜通透性增加、cleaved caspase 3 表达水平上调以及β 细胞凋亡;而罗汉果皂苷提取物干预可显著抑制高糖、高脂引起的胰岛β 细胞凋亡,且抑制caspase 3 凋亡通路的激活,均呈现明显的剂量效应关系。尽管本研究尚未阐明罗汉果皂苷提取物改善胰岛β 细胞糖脂毒性的分子机制,但证明了其直接作用于胰岛β 细胞而发挥抗糖尿病作用,为深入研究其分子机制提供了一定参考。
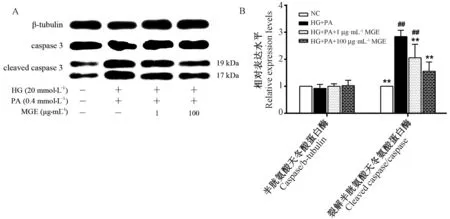
图6 MGE 干预对INS-1 胰岛β 细胞caspase 3 相对表达水平的影响Fig.6 Effect of MGE treatment on relative expression of caspase 3 in INS-1 pancreatic islet β cell
